基因共突變對晚期非小細胞肺癌預后的影響
張莉莉,楊雙寧,王麗萍
(鄭州大學第一附屬醫院腫瘤科,河南 鄭州 450052)
在我國,肺癌不僅是發病率第一,也是死亡率第一的惡性腫瘤[1]。2020年我國肺癌預估新發病例達81.6萬,占所有新發惡性腫瘤的17.9%,死亡人數占惡性腫瘤總死亡人數的23.8%[2]。肺癌分為非小細胞肺癌(non-small cell lung cancer,NSCLC)和小細胞肺癌(small cell lung cancer,SCLC)2大病理類型,其中NSCLC占肺癌的85%[3]。對于驅動基因陰性的晚期NSCLC,一線含鉑雙藥化療的PFS僅4個月-6個月[4]。21世紀以來表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor-tyrosine-kinase inhibitor,EGFR-TKIs)的發現顯著改善了EGFR敏感突變患者的預后[5]。近年來,免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)的出現在惡性腫瘤治療領域取得了突破性的進展。但無論是靶向治療還是免疫治療在治療過程中都會出現大量的臨床異質性,這些異質性與基因共突變相關[6]。有研究[7]發現TP53/PIK3CA和KRAS/TP53突變與化療較短的PFS相關;還有研究[8]發現KRAS/TP53突變與程序性死亡配體-1(programmed death-ligand 1,PD-L1)高表達和免疫治療預后較好相關。但目前針對KRAS/PIK3CA和TP53/PIK3CA突變的研究很少,因此,本研究分析KRAS/PIK3CA(KI組)、TP53/PIK3CA(TI組)等2組共突變對晚期NSCLC化療和免疫治療預后的影響。現將結果報道如下。
1 資料與方法
1.1 一般資料回顧性選取2019年2月至2022年1月經鄭州大學第一附屬醫院收治的NSCLC患者66例,臨床資料收集經鄭州大學醫學倫理學委員會討論并通過。其中KI組33例,TI組33例;男46例,女20例;ECOG評分0分19例,1分47例;有吸煙史44例,無吸煙史22例;肺腺癌36例,肺鱗癌30例。2組在吸煙史、年齡、性別、ECOG評分和病理類型方面比較差異無統計學意義(P>0.05),具有可比性。見表1。

表1 2組患者一般資料 n(%)
1.2 納入和排除標準納入標準:1)經組織病理學和影像學確診為NSCLC;分期為IV期,參照2016年IASLC修訂的第8版分期[9];2)二代基因測序檢測只有分組中TP53/PIK3CA或KRAS/PIK3CA基因突變且常見驅動基因(EGFR、ROS1、ALK等)突變陰性;3)均為初治病例,初治方案為化療或免疫聯合化療(免疫治療);4)至少完成2個及以上的治療周期。排除標準:1)嚴重的肝、腎功能損傷;2)嚴重的心臟、肺部疾病:心肌梗死、肺間質纖維化等;3)病例資料不完整等影響評估預后的病例。
1.3 治療方法肺腺癌化療:培美曲塞二鈉(500 mg/m2,第1天)靜脈滴注,順鉑(75 mg/m2,第2天)靜脈滴注或者給予卡鉑(曲線下面積=5,第2天)靜脈滴注;肺鱗癌化療:吉西他濱(1 000 mg/m2,第1、8天)或白蛋白結合型紫杉醇(260 mg/m2,第1天)靜脈滴注,同時給予順鉑(75 mg/m2,第1天)靜脈滴注或給予卡鉑(曲線下面積=5,第1天)靜脈滴注;免疫治療在上述化療基礎上加上帕博利珠單抗200 mg/次,靜脈滴注。所有患者治療周期均為21 d,每2個周期評估患者治療療效,4~6個周期后整體評估患者病情后維持治療直至病情進展。
1.4 觀察指標臨床療效評價:2個周期治療后參照實體瘤療效評價標準RECIST 1.1評價近期療效[10],記錄患者完全緩解(complete response,CR)、部分緩解(partial response PR)、疾病進展(disease progression,PD)、病情穩定(stable disease,SD),以CR+PR+SD計算疾病控制率(disease control rate,DCR),并比較2組化療和免疫治療的DCR。生存情況評價:每2個周期評估患者療效,6個周期后整體評估患者情況,并行電話隨訪,記錄并比較2組患者化療和免疫治療的疾病無進展生存期(progression free survival,PFS)。
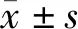
2 結果
2.1 2組DCR比較KI組:化療21例,CR 0例、PR 1例、SD 4例、PD 16例,DCR 23.81%(5/21);免疫治療12例,CR 0例、PR 3例、SD 7例、PD 2例,DCR 83.33%(10/13);免疫治療DCR高于化療,差異有統計學意義(χ2=8.644,P=0.003)。TI組:化療19例,CR 0例、PR 1例、SD 1例、PD 17例,DCR 10.53%(2/19);免疫治療14例,CR 0例、PR 1例、SD3 例、PD 10例, DCR 28.57%(4/14);化療和免疫治療DCR比較差異無統計學意義(χ2=0.760,P=0.492)。KI組免疫治療的DCR高于TI組,差異有統計學意義(χ2=10.437,P=0.008)。
2.2 2組PFS比較KI組和TI組化療的PFS分別為3.98(95%CI:3.66~4.30)、3.83(95%CI:3.55~4.12)個月,免疫治療的PFS分別為9.00(95%CI:8.21~9.79)、6.30(95%CI:4.22~8.38)個月。2組免疫治療均較化療偏高,差異均有統計學意義(χ2=24.561,P<0.001;χ2=15.654,P<0.001);KI組免疫治療的PFS較TI組偏高,差異有統計學意義(χ2=16.077,P<0.001);KI組化療的PFS與TI組比較差異無統計學意義(χ2=0.187,P=0.773)。見圖1。

圖1 2組化PFS的生存曲線比較
2.3 PFS的影響因素分析結果以PFS結局,對可能影響的因素進行COX單因素分析,結果顯示,KRAS/PIK3CA和免疫治療是影響PFS的因素(P=0.022;P<0.001)。基于單因素分析篩選的變量,對基因共突變類型和治療方式進行多因素分析,結果顯示KRAS/PIK3CA和免疫治療是影響PFS的獨立保護性因素(P=0.001;P<0.001)。見表2。

表2 PFS的影響因素分析結果
3 討論
KRAS是一種膜結合型的蛋白,位于細胞膜的內側,其發生突變時編碼的異常蛋白與鳥苷三磷酸的結合,促進惡性腫瘤細胞的生長[11]。研究[12]發現KRAS突變與PD-L1高表達成正相關,提示KRAS突變NSCLC患者可能為免疫治療的潛在的優勢人群,同時研究[13]證實免疫治療能夠延長KRAS突變患者的總生存期。此外,研究[14]表明KRAS與其他基因同時發生突變的頻率很高,高達53.5%。PIK3CA基因突變時激活AKT/mTOR通路導致腫瘤的發生,并與預后較差相關[15]。研究[16]表明PIK3CA與KRAS共突變時激活PIKα介導的c-MYC、GSK3β、p27KIP1、Survivin和RB通路促進肺癌的發生。TP53是一種抑癌基因,在調節細胞周期、凋亡、基因轉錄和DNA修復中發揮關鍵作用且與NSCLC預后不良[17]。研究[18]發現TP53突變與PD-L1表達的上調和T效應激活有關。同時研究[19]證實ICIs治療TP53合并其他基因共突變的NSCLC患者,共突變患者較野生患者有更長的PFS(9.2個月和4.2個月,P=0.01)。
本研究分析KRAS/PIK3CA和TP53/PIK3CA共突變對晚期NSCLC化療和免疫治療預后的影響,結果發現兩組免疫治療PFS均較化療明顯延長,這可能與TP53突變和KRAS突變與PD-L1高表達成正相關有關系[19]。本研究結果顯示TP53/PIK3CA與化療PFS縮短有關,與上述研究[8]結果基本一致。既往研究[16]表明KRAS和PIK3CA突變與預后不良相關,本研究結果顯示KRAS/PIK3CA突變與化療PFS縮短有關。因此,KRAS/PIK3CA和TP53/PIK3CA突變NSCLC患者,免疫治療的PFS較化療顯著延長,且KRAS/PIK3CA突變免疫治療的PFS較TP53/PIK3CA突變明顯延長。
綜上所述,KRAS/PIK3CA和TP53/PIK3CA突變的NSCLC患者能夠免疫治療中有更多的臨床獲益,且KRAS/PIK3CA突變NSCLC患者獲益更明顯,可作為免疫治療的潛在優勢人群。

