唑吡坦對慢性睡眠剝奪老年失眠大鼠神經遞質及下丘腦-垂體-腎上腺皮質軸相關激素的影響
林明霞 李寶梅 朱春燕
失眠主要表現為入睡困難、睡后反復醒來難以再次入睡或睡眠質量差,極易影響白天日常生活。根據電生理參數,睡眠被分為快速動眼睡眠(rapid eye movement sleep,REMS)和非快速動眼睡眠,前者表現為腦電圖與肌肉張力不同步和快速眼球運動,此階段睡眠中大腦活動類似清醒狀態,交感神經張力增加,血壓和心率隨之升高但肌肉松弛。人類隨著年齡增加,REMS時間逐漸縮短,睡眠效率降低,睡后覺醒增多[1]。近半數老年人存在慢性失眠[2]。研究表明:失眠與許多精神疾病相關,持續性失眠的老年患者患抑郁癥、認知障礙等的風險增加[3-4]。行為療法和藥物療法是目前治療失眠的主要手段,所用藥物主要藥效學機制多與神經遞質和下丘腦-垂體-腎上腺皮質軸(hypothalamus-pituitary-adrenal cortex axis,HPA)激素相關,但多數藥物存在嚴重的不良反應,如苯二氮花罩類受體激動劑通過作用于苯二氮花罩受體和γ-氨基丁酸(γ-aminobutyric acid receptors,GABA)受體打開氯離子通道,對中樞系統產生抑制作用,具有抗焦慮、催眠鎮靜等作用,但可引起嗜睡、頭暈、頭痛、共濟失調等不良反應[5],因此需要療效相似但更加安全的藥物。唑吡坦是一種非苯二氮花罩類受體調節劑,具有改善睡眠潛伏期和睡眠持續時間,減少短暫性失眠患者覺醒次數的作用[6]。本研究通過建立慢性睡眠剝奪老年失眠大鼠模型,探究唑吡坦對其神經遞質及HPA相關激素的影響,以期為臨床治療老年性失眠提供參考。
1 材料和方法
1.1 材料
1.1.1 實驗動物 60只SPF級SD大鼠,32周齡,體質量350~400 g,購于北京維通利華實驗動物技術有限公司,許可證號:SCXK(京)2021-0006。本次實驗經浙江大學實驗動物中心動物實驗倫理委員會批準(批號:ZJDXDWLL20210121L),符合3R原則。
1.1.2 主要藥品與試劑 酒石酸唑吡坦片購自賽諾菲(杭州)制藥有限公司(國藥準字:J20130015,規格:10 mg),艾司唑侖片購自上海上藥信誼藥廠有限公司(國藥準字:H31021534,規格:1 mg),多巴胺(dopamine,DA)、5-羥色胺(5-hydroxytryptamine,5-HT)、去甲腎上腺素(norepinephrine,NE)檢測試劑盒購自武漢菲恩生物科技有限公司(批號分別為FN-EU0392、ER1463、EU2565),大鼠腎上腺皮質激素釋放激素(corticotropin releasing hormone,CRH)、促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)、皮質酮(cortisol,CORT)、ELISA試劑盒購自上海酶研生物科技有限公司(批號分別為EK-R37071、EK-R37072、EK-R38929),蛋白質定量試劑盒購自武漢博士德生物工程有限公司(批號:AR0146),5-羥色胺1A受體(5-hydroxytryptamine 1Arecrptor,5-HT1AR)、A型γ-氨基丁酸受體(γ-aminobutyric acid receptors type A receptor,GABAAR)抗體購自美國Abcam公司(批號分別為ab227165、ab92747)。
1.2 方法
1.2.1 動物分組、建模與干預 60只大鼠隨機分為環境對照組、模型組、唑吡坦低、中、高劑量組和陽性藥組,每組10只,采用花盆法復制慢性睡眠剝奪失眠老年大鼠模型[7-8]。準備2種倒置花盆平臺裝置,中間凸起部分(平臺)直徑分別為6.5和12.5 cm,平臺周圍注滿水。除環境對照組大鼠飼養在較大的平臺上外,其余組大鼠飼養在較小的平臺上,所有大鼠均可在平臺上自由活動。裝置設有金屬籠蓋,籠蓋有凹槽可供大鼠自由攝食,大鼠每日在裝置中飼養18 h,剩余6 h轉至常規飼養籠具中正常喂養,持續21 d。第22天開始藥物干預,按照人與大鼠等效劑量比計算劑量,唑吡坦低、中、高劑量組大鼠分別為1/2、1、2倍大鼠等效劑量,即以0.52、1.05、2.10 mg/kg唑吡坦灌胃,陽性藥組大鼠以艾司唑侖0.50 mg/kg[9]灌胃,環境對照組和模型組大鼠以10 ml/kg的0.9%氯化鈉溶液灌胃,1次/d,持續14 d。治療前、后對大鼠稱體質量。
1.2.2 行為學實驗 藥物干預結束后通過行為學實驗評估各組大鼠學習和記憶能力。(1)曠場實驗:將大鼠放入曠場實驗裝置中央,記錄5 min內大鼠的運動距離和中央運動時間。(2)Morris水迷宮實驗:實驗第1~3天,將大鼠從隨機位置放入水中,記錄其找到并爬上平臺的時間(逃避潛伏期),若90 s內未找到平臺,則將其引導至平臺,將時間記為90 s;第4天撤去平臺,將大鼠從原先平臺所在象限的對側放入水中,記錄其進入原先平臺所在象限的次數和停留時間。實驗重復3次取平均值。
1.2.3 腦系數計算 行為學實驗結束后,用10%水合氯醛腹腔注射麻醉大鼠,腹主動脈取血后,迅速取出全腦稱質量,計算腦系數。腦系數=腦質量(g)/體質量(g)×100%。
1.2.4 下丘腦神經遞質和血清HPA軸相關激素檢測 將稱量后的全腦置于冰上分離下丘腦,手動勻漿;大鼠腹主動脈血靜置2 h后,離心分離血清。采用ELISA法分別檢測下丘腦神經遞質DA、5-HT、NE和血清HPA軸相關激素CRH、ACTH、CORT水平。按照試劑盒方法在酶標板中加入50 μl樣本和50 μl生物素化抗體工作液,37℃孵育45 min;洗板3次后加入100 μl工作液,37 ℃孵育30 min;洗板5次,加入90 μl底物溶液,37℃孵育15 min,加入50 μl工作終止液。測量450 nm下的吸光度,計算神經遞質和激素水平。
1.2.5 下丘腦5-HT1AR、GABAAR蛋白表達水平檢測 采用Western blot法。下丘腦組織加入裂解液充分勻漿、水浴變形后,進行蛋白定量,在電泳儀上進行電泳和電轉。蛋白條帶膜在5%脫脂牛奶封閉1 h后,搖床漂洗條帶3次;4℃一抗孵育過夜,搖床漂洗條帶3次;二抗孵育2 h,搖床漂洗條帶3次。凝膠成像顯色,以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參,采用Image J軟件分析條帶灰度值。
1.3 統計學處理 采用SPSS 24.0統計軟件,所有實驗均重復3次。計量資料以表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 6組大鼠體質量、腦系數比較 比較6組大鼠體質量,環境對照組大鼠體質量呈逐漸升高趨勢,其余各組呈先降低后升高趨勢;治療后唑吡坦中、高劑量組和陽性藥組大鼠體質量均高于模型組(均P<0.05)。與環境對照組比較,模型組大鼠腦系數降低(P<0.05);與模型組比較,唑吡坦中、高劑量組和陽性藥組大鼠腦系數均升高(均P<0.05)。見表1。
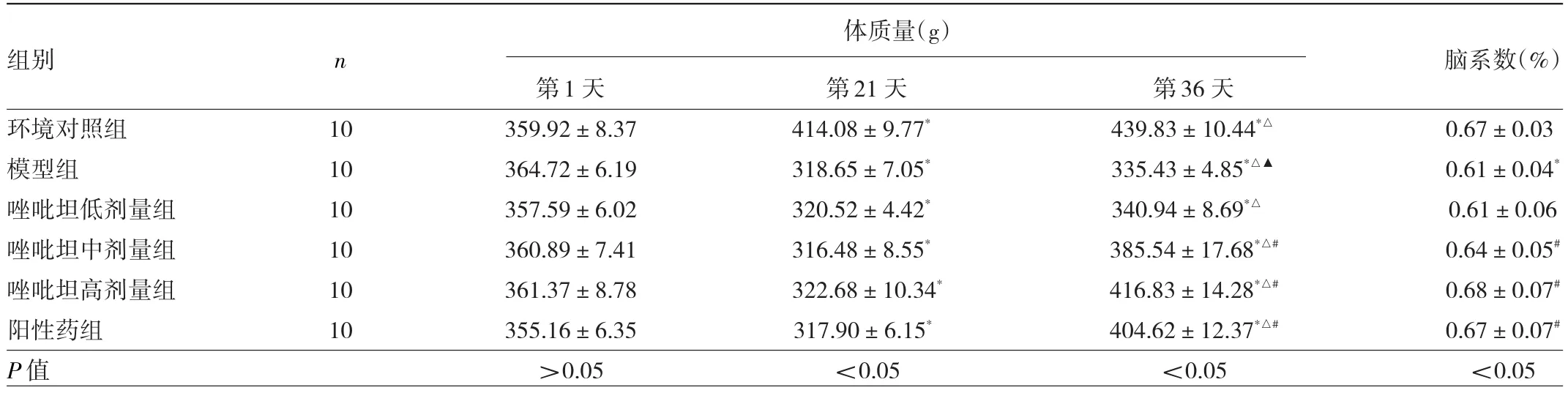
表1 6組大鼠體質量、腦系數變化
2.2 6組大鼠行為學實驗變化比較 曠場實驗結果顯示:與環境對照組比較,模型組大鼠5 min內運動距離和中央運動時間均升高(均P<0.05);與模型組比較,唑吡坦中、高劑量組和陽性藥組大鼠5 min內運動距離和中央運動時間均降低(均P<0.05)。Morris水迷宮實驗結果顯示:與環境對照組比較,模型組大鼠90 s內逃避潛伏期延長(P<0.05),原平臺象限停留次數、停留時間均減少(均P<0.05),與模型組比較,唑吡坦中、高劑量和陽性藥組大鼠90 s內逃避潛伏期均縮短(均P<0.05),原平臺象限停留次數、停留時間均增加(均P<0.05)。見表2。
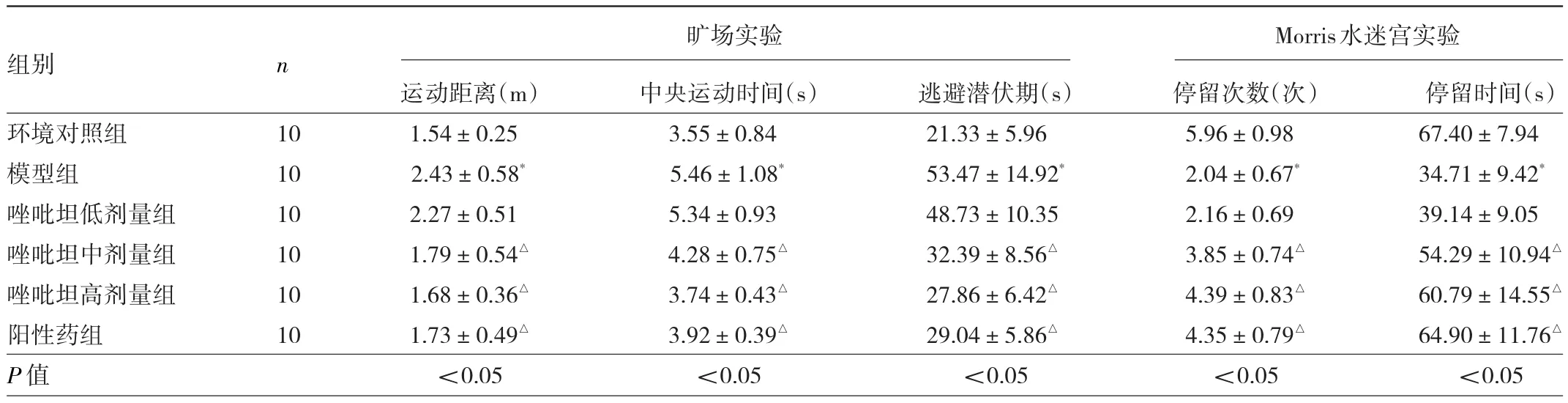
表2 6組大鼠曠場實驗、Morris水迷宮實驗結果比較
2.3 6組大鼠下丘腦神經遞質變化比較 與環境對照組比較,模型組大鼠下丘腦DA、NE質量濃度升高(P<0.05),5-HT質量濃度降低(P<0.05)。與模型組比較,唑吡坦中、高劑量組和陽性藥組大鼠下丘腦DA、NE質量濃度降低(P<0.05),5-HT質量濃度升高(P<0.05)。見表3。
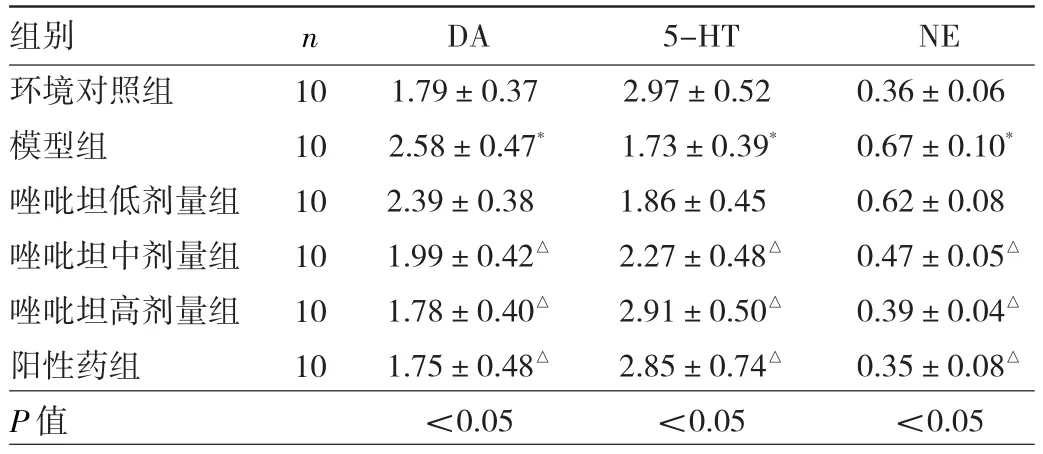
表3 6組大鼠下丘腦DA、5-HT、NE變化比較(μg/L)
2.4 6組大鼠血清HPA相關激素水平變化比較 與環境對照組比較,模型組大鼠血清CRH、ACTH、CORT質量濃度升高(P<0.05);與模型組比較,唑吡坦中、高劑量和陽性藥組大鼠血清CRH、ACTH、CORT質量濃度降低(P<0.05)。見表4。
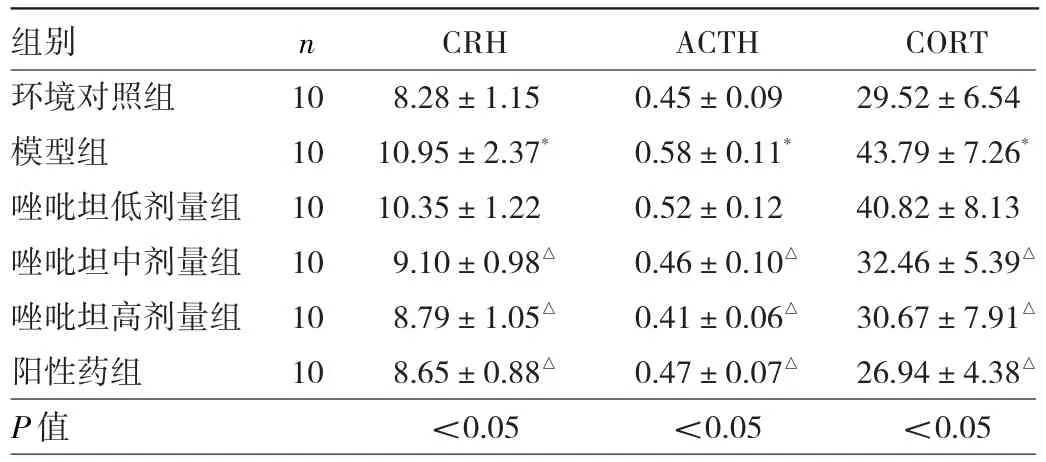
表4 6組大鼠血清CRH、ACTH、CORT水平變化比較(μg/L)
2.5 6組大鼠下丘腦GABAAR、5-HT1AR蛋白表達變化比較 與環境對照組比較,模型組大鼠下丘腦GABAAR、5-HT1AR蛋白相對表達量降低(P<0.05);與模型組比較,唑吡坦中、高劑量組和陽性藥組大鼠下丘腦GABAAR、5-HT1AR蛋白相對表達量升高(P<0.05)。見圖1。
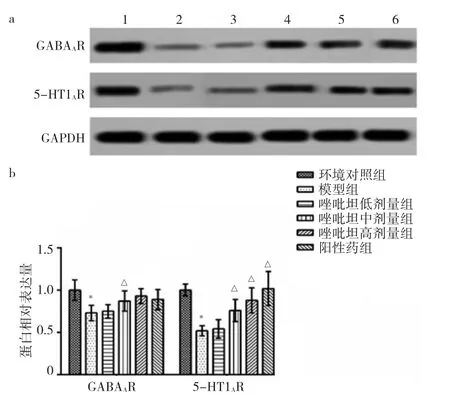
圖1 唑吡坦對大鼠下丘腦GABAAR、5-HT1AR蛋白表達變化的影響(a:GABAAR、5-HT1AR蛋白電泳圖;1-6依次為環境對照組、模型組、唑吡坦低劑量組、唑吡坦低中劑量組、唑吡坦高劑量組和陽性藥組。b:GABAAR、5-HT1AR蛋白相對表達量)
3 討論
睡眠受中樞系統主導的晝夜節律和機體動態平衡的調節,在維持正常生理生理活動中具有重要作用。自然衰老過程中,睡眠結構和參數不斷變化,N1、N2睡眠階段占比和夜間清醒時間不斷增加,而睡眠效率、穩態和慢波睡眠占比不斷降低[10]。研究表明:19~75歲,REMS比例呈線性下降,每10年下降0.6%[11]。實驗性REMS剝奪可影響大腦中酶、代謝物、神經遞質以及導致細胞凋亡的神經元結構蛋白。花盆法是目前常用的REMS剝奪方法[12]。本研究采用花盆法建立老年失眠大鼠模型,21 d建模期后,大鼠體質量和腦系數明顯降低,學習和記憶能力降低。表明老年大鼠在經過慢性REMS剝奪后表現出異常興奮,動物模型建立成功。
唑吡坦是一種非苯二氮花罩類藥物,通過與GABA受體復合體上的苯二氮花罩類結合起作用,引起神經抑制并誘導睡眠,對GABAAR的α1亞型具有很高的親和力,半衰期短、起效較快。目前國外出現了有關其濫用傾向的報道[13],但國內相關報道較少;在規定劑量內,唑吡坦的濫用和依賴風險較低,相比阿普唑侖,唑吡坦在失眠癥上的治療效果更好,安全性更高[14-15]。本研究發現:經中、高劑量唑吡坦干預后,老年失眠大鼠體質量和腦系數明顯高于模型組,學習和記憶能力顯著改善,與謝光璟等[16]研究結果類似。表明唑吡坦可改善老年慢性失眠大鼠的學習和記憶能力。
中樞神經遞質紊亂在失眠的復雜機制中具有重要作用,包括NE、DA、GABA和5-HT等在內的單胺類神經遞質參與了睡眠調節[17]。5-HT主要分布于腦皮質和神經突觸,可作用于大腦中與睡眠和清醒控制相關的多個區域,抑制覺醒并延長REMS,5-HT1AR是5-HT的受體[18-19]。DA主要分布于中腦腹側被蓋區和黑質致密部,在清醒時逐漸升高[20]。GABA是中樞神經系統的主要抑制性神經遞質,其受體GABAAR與睡眠相關,GABA與GABAAR結合對喚醒系統具有抑制作用。GABAAR是苯二氮卓類藥物、巴比妥類藥物等多種神經類藥物的靶標,參與神經系統多種疾病機制[21]。本研究中,老年慢性失眠大鼠下丘腦DA、NE質量濃度升高,5-HT質量濃度降低,GABAAR、5-HT1AR蛋白相對表達量降低;經中、高劑量唑吡坦干預后均有所改善,與張利平[22]研究結果類似。表明唑吡坦可改善老年慢性失眠大鼠下丘腦神經遞質紊亂。
HPA參與調節人體體內平衡和應激反應,其功能障礙與失眠相關。研究表明:HPA功能障礙與CRH、ACTH和CORT水平提高有關[23]。HPA激活是一連串復雜過程,由下丘腦分泌的CRH可直接作用于垂體,促進垂體分泌ACTH,ACTH可促進腎上腺皮質分泌糖皮質激素,而糖皮質激素可對垂體和下丘腦產生反饋,進而調整HPA[24]。因此,維持HPA軸穩定對調節睡眠具有重要意義。本研究發現:老年慢性失眠大鼠血清CRH、ACTH、CORT質量濃度升高,經唑吡坦干預后回落,與Dong等[25]的研究結果一致。表明唑吡坦可改善老年慢性失眠大鼠血清HPA相關激素水平。
綜上所述,唑吡坦對老年慢性睡眠剝奪失眠大鼠學習和記憶能力和睡眠情況具有改善作用,可提升血清HPA相關激素水平,改善下丘腦神經遞質紊亂,上調下丘腦GABAAR、5-HT1AR蛋白表達。

