實驗裝置的連接順序問題應答策略例析
邊永平
(河北省豐寧滿族自治縣第一中學 068350)
化學綜合實驗題考查內容全面,知識與能力考查并重.在高中化學中基本概念和理論、元素與化合物、有機化學等板塊內容均可命制綜合實驗題.實驗裝置的連接是進行實驗的必要環節,其中實驗裝置的連接順序問題在考題中常常出現,對整道題起到統領作用,可以說是實驗目的的直接體現.只有對實驗目的完全領會,對整個實驗過程中各個環節真正研究透徹,才能解答完整.很多考生解答過程中常出現實驗裝置連接順序顛倒,或者缺少某些必要裝置.本文擬通過幾例習題,對實驗裝置連接順序問題應答策略進行分析,供參考.
1 物質制備實驗
試題特點給出某些裝置和試劑,制備指定物質.
應答策略明確實驗目的,理解各部分裝置的功能,制備實驗的裝置連接順序一般是:制備原料—防倒吸裝置(安全瓶)—除雜—干燥—合成目標產物—尾氣處理
例1采用如圖1所示的裝置可以用氫氣還原三氧化鎢來制取金屬鎢,(注:鋅粒中含有少量雜質硫,少量氧氣可以采用焦性沒食子酸溶液加以吸收),下列敘述正確的是( ).

圖1
A.圖中裝置①、②、③內盛裝的試劑依次為酸性高錳酸鉀溶液、濃硫酸、焦性沒食子酸溶液
B.在加熱三氧化鎢之前,需要裝置末端收集氣體做爆鳴試驗,用以檢驗氣體純度
C.實驗結束時,應先將活塞K關閉,然后停止加熱管式爐
D.實驗室采用MnO2和濃HCl反應制Cl2時也可以采用裝置Q
解析第二個裝置為安全瓶,起到防倒吸作用.Q為啟普發生器,用于制H2,因鋅粒含雜質,制得的H2中可能混有H2S,需要用KMnO4溶液進行除雜.接下來用焦性沒食子酸溶液吸收氧氣,再進行干燥,故①、②、③中依次盛裝酸性高錳酸鉀溶液、焦性沒食子酸溶液、濃硫酸,即A項錯誤;B項操作是對H2進行驗純,正確;為了防止生成的金屬W在受熱時被空氣氧化,結束反應時要先停止加熱,再繼續通入氫氣直至冷卻,故C項錯誤;二氧化錳與濃鹽酸反應制備氯氣需要加熱條件,而啟普發生器不能加熱,即D項錯誤.答案為B.
2 定量測定實驗
試題特點題目常要求測定某物質的純度、或者某結晶水合物中結晶水的含量、或是測定氣體摩爾體積的數值、或者某反應的轉化率(產率)等等.
應答策略通過特定反應,將原物質分解、轉化、吸收,或者再通過新的反應生成新物質,借助某些吸收裝置的質量變化找出相關數據.為提高實驗的準確性,必要時還需要在裝置的前端通入經過處理的不參與反應的氣體,確保殘留在裝置中的氣體被充分吸收.裝置末端要注意連接防止空氣進入造成干擾的裝置.
例2二氧化硫可以反應成三氧化硫,可用如圖2所示裝置來測定該反應的轉化率.已知三氧化硫的熔、沸點分別是16.8℃和44.8℃.已知制備二氧化硫的化學方程式為:

圖2

Na2SO4+SO2↑+H2O
(1)為了完成實驗,選擇圖3提供的裝置填空,裝置Ⅰ、Ⅱ、Ⅲ方框中分別是____、____、____(填裝置代號).

圖3
(2)從乙處導管均勻通入氧氣,為提高二氧化硫的轉化率,實驗時向燒瓶中滴加濃硫酸和加熱V2O5(催化劑)的兩步操作中,應先進行的是____.
(3)用amol亞硫酸鈉粉末和濃硫酸(足量)進行實驗,待反應結束時,繼續通入一定量氧氣,最后測得裝置Ⅲ增加的質量為bg,則該實驗中二氧化硫的轉化率為____%(用含有a、b的代數式表示)
(4)裝置末端使用球形干燥管的作用是____.
解析(1)利用裝置Ⅰ對二氧化硫進行干燥,應選用濃硫酸;三氧化硫的熔點是16.8℃,沸點是44.8℃,當溫度低于16.8℃時,三氧化硫以晶體狀態存在,因此可以用冰水對生成的SO3進行冷卻;二氧化硫、三氧化硫的尾氣處理用燒堿溶液吸收.故答案為:B;A;E.
(2)為提高二氧化硫生成三氧化硫的轉化率,應先加熱催化劑再進行滴加濃硫酸,這樣可以確保生成的二氧化硫盡可能地參與反應.故答案為:先加熱催化劑再滴入濃硫酸.

(4)在裝置末端使用球形干燥管的作用是:防止空氣中的二氧化碳和水蒸氣進入裝置造成干擾.
答案見解析.
3 物質的檢驗實驗
試題特點試題提供幾種備選試劑和必要的實驗裝置,要求檢驗指定反應生成的各種產物.
應答策略一般的試題中,待檢驗的物質往往有多種,解題的關鍵是要確定出檢驗的先后順序.常常把容易受到干擾的物質先檢驗,如水蒸氣.能參與多個反應的物質也需要盡可能放在前面檢驗.
例3將過量的鐵粉加到濃硫酸中, 反應生成的混合氣體中含有二氧化硫、氫氣及水蒸氣,為了檢驗此混合氣的成分,某同學設計了以下實驗:
(1)若過量鐵粉和濃硫酸反應后,產生相等體積的二氧化硫和氫氣,則寫出總的化學方程式:____.
(2)按氣流從左到右的方向,為完成上述實驗,圖4所示各裝置連接順序是A→____(每種裝置只能使用一次).

圖4
(3)裝置A中導管的作用是____,在裝置E中的球形干燥管內盛放堿石灰,其作用是____.
(4)能夠證明反應中有氫氣生成的實驗現象為____.
解析(1)根據原子守恒和轉移電子守恒,可知反應的化學方程式為:
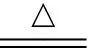
2FeSO4+SO2↑+H2↑+2H2O
(2)三種氣體中應先檢驗水蒸氣,因為從溶液中導出的氣體會帶有水蒸氣,檢驗水蒸氣常用無水硫酸銅;剩下的兩種氣體應先檢驗SO2,利用品紅溶液檢驗;利用CuO檢驗H2,并用無水硫酸銅檢驗生成的水蒸氣.要注意通入CuO中的H2必須經過干燥.則裝置連接順序為:ADBCFE.
(3)A中導管的作用為安全管,平衡氣壓.裝置E中的干燥管中盛放堿石灰,其作用是防止空氣中的水蒸氣進入裝置干擾實驗,并吸收多余的SO2.
(4)H2還原CuO生成Cu和H2O,證明有H2存在的實驗現象為:F中黑色粉末變紅,E中無水硫酸銅變藍.
答案見解析.
4 探究性實驗
試題特點試題提供陌生的素材和情景,對某些物質的性質進行探究,多以設計實驗方案和評價為主要形式.
應答策略將題中素材和問題與已有知識建立聯系,提出假設,并據此設計可行性實驗方案.評價某種實驗方案是否可行多從反應的可行性、試劑的選用要求、反應條件以及產物分離角度加以分析.
例4東風中學的課外興趣小組的同學們設計了如下探究實驗:(1)液溴和苯發生的是取代反應;(2)液溴和苯在催化劑作用下發生反應的反應機理,采用圖5所示的裝置進行實驗.

圖5

Br2↑+MnSO4+Na2SO4+2H2O
(1)寫出實驗室制備溴苯的化學方程式為____;儀器X的名稱為____.
(2)制取溴苯有以下操作:
①連接儀器,各裝置連接順序為(填接口字母):d接____,____接____,____接c;
②進行氣密性檢查;
③在裝置C中加入固體藥品,____,再將D處開關K打開,將C處的酒精燈點燃;將鐵絲插入混合液中,幾分鐘以后,發現裝置D三頸燒瓶中液體沸騰,原因是____;
④將C中活塞關閉.
(3)裝置A中要對廣口瓶采用熱水浴,其目的是____.
(4)若裝置B燒杯中出現淡黃色沉淀,能否據此判斷苯與液溴發生的反應是取代反應?____(答“能”或“否”).
(5)同學們査閱文獻發現:苯和液溴在三溴化鐵催化時的反應歷程有如下三步:
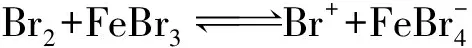
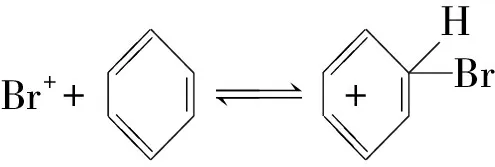
①請寫出第三步反應:Ⅲ____;
②該小組同學將裝置A中濃硫酸更換為稀硫酸,結果造成實驗失敗,試從反應機理分析造成實驗失敗的可能原因是____.
解析(1)實驗室制溴苯的化學方程式為:
(催化劑寫FeBr3也可以);儀器X的名稱為:球形冷凝管.
(2)①根據制溴苯的化學方程式可知,首先要制Br2,C裝置中產生的溴蒸氣中混有水蒸氣,可通過濃硫酸(A裝置)干燥,再通入D裝置進行反應,即d接a,b接e,用硝酸銀溶液(B裝置)檢驗 HBr,即f接c,故接口順序為dabefc.③裝置C中加入固體藥品MnO2和NaBr后,再通過分液漏斗滴加濃硫酸;D中液體沸騰說明苯和溴的反應為放熱反應.
(3)A裝置對廣口瓶進行熱水浴的目的是防止溴蒸氣冷凝.
(4)從D裝置中揮發出的HBr中帶有溴蒸氣,溴蒸氣也可以和硝酸銀溶液作用產生溴化銀沉淀,因此若B中有淡黃色沉淀生成,不能確定苯與液溴發生了取代反應.若將裝置改進,即在D和B之間增加一個裝置,吸收溴蒸氣,只允許HBr進入B裝置,就可以證明.
(5)①FeBr3為催化劑,中間過程可能參與了反應,但最后仍為FeBr3,因此反應式為:
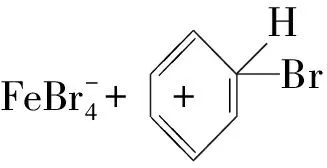
②A裝置中濃硫酸若換成稀硫酸,則Br2與水反應,生成Br-和BrO-,無法生成Br+,即導致實驗失敗.
答案見解析.
需要強調的是:在連接各裝置時,要特別注意各個裝置的接口方向,如洗氣裝置要“長進短出”,冷凝管中冷卻水要“下進上出”,還要注意整套裝置的氣密性和平衡壓強方面的問題,以及實驗安全問題等等.

