非耐藥和耐多藥肺結核患者外周血T淋巴細胞亞群動態變化及臨床意義Δ
高 瑜,仵倩紅,胡 萍,王 立,郭 樂
(1.陜西省結核病防治院/陜西省第五人民醫院內四科,西安710100; 2.陜西省結核病防治院/陜西省第五人民醫院影像中心,西安 710100; 3.陜西省結核病防治院/陜西省第五人民醫院內五科,西安 710100)
隨著國家對肺結核的管控,肺結核發病率呈現降低趨勢,但患者疾病負擔及總經濟負擔表現為升高趨勢,仍需將肺結核的防治作為重點關注內容[1]。目前,臨床對于肺結核的治療以服用抗結核藥為主,但隨著耐藥菌株的增多和擴散,耐多藥結核病(multidrug resistant tuberculosis,MDR-TB)發生率也越來越高[2]。耐藥結核病的治療極為棘手,MDR-TB患者中僅48%的患者獲得治療成功,病死率和失訪率分別高達15%和28%。結核分枝桿菌為胞內寄生菌,其感染率很高,發病率卻較低,除與感染的細菌量和毒力等相關外,還與患者機體免疫功能有關[3-4]。機體抗結核免疫主要為細胞免疫,而影響細胞免疫程度的主要為T淋巴細胞亞群。有研究結果顯示,肺結核患者外周血T淋巴細胞亞群含量與健康人群存在顯著差異,且與預后相關[5]。因此,本研究探討了非耐藥和耐多藥肺結核患者外周血T淋巴細胞亞群動態變化及臨床意義,以期為肺結核治療提供資料。
1 資料與方法
1.1 資料來源
本研究經醫院倫理委員會批準[(2020)年臨審第(1)號],納入2020年1月至2021年6月我院收治的97例肺結核患者。納入標準:(1)非耐藥肺結核患者,①X線檢查或胸部CT檢查考慮肺結核,且為初次治療;②痰找抗酸桿菌陽性、痰結核分枝桿菌培養陽性;③結核分枝桿菌藥物敏感試驗未發現耐藥。(2)耐多藥肺結核患者,①X線檢查或胸部CT檢查考慮肺結核;②痰結核分枝桿菌培養陽性;③結核分枝桿菌藥物敏感試驗結果顯示,至少對利福平、異煙肼耐藥。排除標準:患有肺外結核者;合并免疫系統相關疾病者;長期服用激素或者近1年內曾用免疫抑制劑者;因患有其他疾病,不能耐受一線或二線抗結核藥治療者;人類免疫缺陷病毒陽性者;合并腫瘤者;妊娠或哺乳期婦女。97例患者中,男性53例,女性44例;年齡20~68歲,平均(41.57±9.26)歲。
1.2 病原菌培養與藥物敏感試驗
采集所有患者痰液,接種于M-H培養基中進行病原菌培養,培養條件:37 ℃環境中培養24 h,取單個菌落接種于羅氏固體培養基,培養16~24 h。采用Kirby-Bauer紙片擴散法(K-B法)進行藥物敏感試驗,在同一平板中選擇3~5個性狀相似的菌落,采用接種環進行接種,于35 ℃環境中培養2~6 h,以0.9%氯化鈉溶液稀釋后接種于MHA平板上。孵育完成后,根據臨床實驗室標準化研究所制定的標準[6]進行結果判斷,采用游標卡尺(精確度為1 mm)測量抑菌圈直徑,若發現抑菌圈內有散在菌落生長,提示可能為混合生長,需重新分離純化鑒定,再次行藥物敏感試驗。耐多藥判斷標準:符合《耐藥結核病化學治療指南(2015)》[7]中MDR-TB診斷標準。根據結核分枝桿菌藥物敏感試驗結果,將患者分為耐多藥組、非耐藥組。
1.3 治療方法
耐多藥組患者根據藥物敏感試驗結果,依據《中國耐多藥和利福平耐藥結核病治療專家共識》(2019年版)制定治療方案。非耐藥組患者采用異煙肼(1次0.3 g,1日1次)、利福平(體重<50 kg者1次0.45 g,1日1次;體重≥50 kg者1次0.6 g,1日1次)、吡嗪酰胺(1次0.5 g,1日3次)和鹽酸乙酰丁醇(1次0.75 g,1日1次)等常規抗結核藥治療。
1.4 外周血T淋巴細胞亞群檢測
抽取所有受檢者新鮮EDTA抗凝血4 mL,分為2份,一份通過流式細胞儀檢測CD3、CD4、CD8、CD4/CD8以及Tregs亞群水平;另一份檢測Thl、Th2和Thl7細胞亞群水平。耐多藥組和非耐藥組患者于接受抗結核治療療程結束后1 d抽取2份新鮮血液樣本,用于檢測外周血T淋巴細胞亞群水平。使用美國Beckman Coulter公司熒光校正微球校準儀器光路與流路,根據試劑使用說明書,按照所測的樣本數取相應數目的流式細胞儀專用試管。CD3、CD4、CD8和Tregs亞群測定:向每支試管中分別加入熒光素標記的抗體試劑各10 mL,再加入EDTA抗凝全血10 μL,混勻后于室溫(25 ℃)下避光孵育20 min,向每支試管中各加入溶血劑500 μL,混勻后于室溫下避光孵育10 min后上機。分別計算外周血T淋巴細胞CD3+、CD4+、CD8+和CD4+/CD8+水平,外周血Th1、Th2和Th17細胞亞群水平。
1.5 治療效果評定
參照文獻[8],根據治療后病灶吸收情況評定治療效果:治療后病灶縮小≥50%為預后良好,治療后病灶縮小<50%為預后不良。
1.6 統計學方法
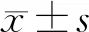
2 結果
2.1 結核分枝桿菌藥物敏感試驗結果
結果顯示,耐多藥肺結核患者39例,非耐藥肺結核患者58例。耐多藥組患者中,男性23例,女性16例;年齡20~66歲,平均(44.20±8.25)歲。非耐藥組患者中,男性33例,女性25例;年齡20~68歲,平均(40.18±9.10)歲。兩組患者基線資料相似,有可比性。
2.2 外周血T淋巴細胞CD3+、CD4+、CD8+和CD4+/CD8+水平比較
治療前,耐多藥組患者外周血T淋巴細胞CD3+、CD4+和CD4+/CD8+水平顯著低于非耐藥組,差異均有統計學意義(P<0.05);兩組患者CD8+水平比較,差異無統計學意義(P>0.05)。與治療前比較,非耐藥組患者治療后外周血T淋巴細胞CD3+、CD4+和CD4+/CD8+水平均顯著升高,差異均有統計學意義(P<0.05);而耐多藥組患者治療后外周血T淋巴細胞CD3+、CD4+和CD4+/CD8+水平與治療前比較,差異無統計學意義(P>0.05),見表1。

表1 兩組患者治療前后外周血T淋巴細胞CD3+、CD4+、CD8+和CD4+/CD8+水平比較
2.3 外周血Th1、Th2和Th17細胞亞群水平比較
治療前,耐多藥組患者外周血Th1、Th2水平顯著低于非耐藥組,外周血Th17水平顯著高于非耐藥組,差異均有統計學意義(P<0.05)。與治療前比較,非耐藥組患者治療后外周血Th1、Th2水平顯著升高,外周血Th17水平顯著降低,差異均有統計學意義(P<0.05);而非耐藥組患者治療前后上述指標水平比較,差異均無統計學意義(P>0.05),見表2。

表2 兩組患者治療前后外周血Th1、Th2和Th17細胞亞群水平比較
2.4 抗結核治療效果比較
非耐藥組患者抗結核治療預后良好率為77.59%(45/58),顯著高于耐多藥組的35.90%(14/39),差異有統計學意義(χ2=17.009,P<0.001)。
3 討論
結核病防治一直是臨床研究的重點,如今越來越多的抗結核藥在臨床發揮了較好的治療效果,控制了疾病進展和泛濫[9]。但也伴隨著一些不合理用藥情況的出現,導致結核菌耐藥增加[10-11]。耐藥結核病是由于基因突變使藥物對結核分枝桿菌的效力降低導致的,耐藥基因間的相互關系尚不知曉,耐藥機制極其復雜仍處于不斷探索階段。耐藥性直接關系到患者的治療效果及預后,分析MDR-TB患者的病情對提高臨床治愈率具有至關重要的作用。
研究結果發現,人體在感染結核菌之后并不會馬上發病,而是在免疫功能降低或細胞介導病態反應增高時才會發病[12]。因此,有學者認為,結核病的發生發展不僅與致病菌感染有關,還與患者自身的免疫功能密切相關,其在細胞免疫功能降低的情況下更易發病[13]。T淋巴細胞在結核病患者的細胞免疫過程中起著重要作用。CD3+T細胞可以激活T淋巴細胞參與細胞免疫;CD4+T細胞可以激活效應T細胞及其他免疫細胞聚集于感染部位發揮免疫保護作用;CD8+T細胞也共同作用CD4+T細胞所介導的免疫反應,可以溶解已經吞噬的結核菌及受抗原影響產生的巨噬細胞,并分泌γ干擾素等細胞因子增加抗原呈遞,拮抗結核菌感染[14-15]。Th細胞能夠進一步分化為不同的亞群,通過不同的轉錄因子,分泌細胞因子和趨化因子,通過復雜的作用機制協調不同的免疫效應機制。Th1細胞在誘導結核分枝桿菌等細胞外致病菌的保護性免疫反應方面起著關鍵作用,能刺激分泌白細胞介素(IL)2、IL-18和干擾素細胞因子,是器官特異性自身免疫的主要驅動因素。Th2可以產生IL-4、IL-5等細胞因子介導細胞免疫及細胞毒T細胞的生長和活化,抑制致病菌的感染作用。Th17是近年來越來越受到關注的細胞亞群,在結核分枝桿菌感染過程中,Th17有利于機體形成結核保護性免疫并加速二次免疫應答,從而起到清除結核分枝桿菌的作用[16-17]。
本研究中,耐多藥組患者外周血T淋巴細胞CD3+、CD4+和CD4+/CD8+水平顯著低于非耐藥組,外周Th1、Th2水平顯著低于非耐藥組,Th17水平顯著高于非耐藥組,說明肺結核患者存在明顯的免疫功能受損狀態,且耐多藥肺結核患者的免疫功能受損狀態更嚴重。接受抗結核治療3個月后,非耐藥組患者抗結核治療預后良好率顯著高于耐多藥組;復查外周血T淋巴細胞亞群水平發現,與治療前比較,非耐藥組患者治療后CD3+、CD4+和CD4+/CD8+水平及Th1、Th2水平均顯著升高,Th17水平顯著降低,而耐多藥組患者治療后CD3+、CD4+、CD4+/CD8+、Th1、Th2和Th17水平與治療前相似,與相關文獻報道結果一致,均顯示耐多藥肺結核患者治療效果不佳。且本研究進一步分析發現,結核分枝桿菌的耐藥性可以影響肺結核患者體內的免疫狀態,因此認為,在接受抗結核治療時,機體對于結核分枝桿菌的清除是在免疫應答的作用下完成的,對于結核病患者尤其是耐多藥肺結核患者免疫狀態的探究有助于更好地認識耐多藥肺結核治療效果不佳的原因。
綜上所述,肺結核患者體內存在明顯的免疫功能受損,檢測外周血T淋巴細胞亞群動態變化將有利于耐多藥肺結核患者的臨床治療,更好地改善其預后。

