針刺結合西醫常規療法治療胃癌術后胃癱的臨床觀察
張建杰,趙建更,焦保平,李志貴
(1.山西中醫藥大學附屬醫院,山西 太原 030024;2.山西省腫瘤醫院,山西 太原 030013)
術后胃癱綜合征(postoperative gastroparesis syndrome,PGS)又稱殘胃功能排空障礙,是指胃部手術后胃腸道功能紊亂導致的胃腸動力不足、胃流出道排空障礙為主要臨床表現的一種疾病,是胃大部切除術后常見的并發癥[1]。患者主要表現為進食后惡心、嘔吐、腹脹、胃引流量增多,導致患者不能進食,嚴重影響其術后營養及恢復。中醫將本病歸于“納呆”“痞滿”等范疇,認為腹部手術損傷中焦脾胃,中焦氣機升降失調,氣血運行不暢而致胃氣上逆,從而引起胃動力不足,胃排空受阻。西醫以胃腸減壓、腸內外營養支持、胃腸動力藥物等對癥治療為主,但單純西醫治療PGS存在療效欠佳、患者恢復慢等不足,因此如何提高PGS的治療效果成為目前臨床研究的熱點之一。本研究在西醫治療基礎上使用針刺療法治療PGS,觀察其臨床療效,現報道如下。
1 臨床資料
1.1 一般資料 選取山西中醫藥大學附屬醫院普外科及山西省腫瘤醫院普外一病區2018年1月至2020年12月收治的胃癌術后發生胃癱患者48例,其中男27例,女21例;年齡46~75歲,平均(58.58±17.85)歲;開腹手術32例,腹腔鏡手術16例,全部患者均行遠端胃大部分切除術,分別在術后第5~9日出現胃癱癥狀,病程18~66 d,平均(42.65±13.64)d。采用隨機數字表法將48例患者分為對照組22例和治療組26例。對照組男13例,女9例;年齡≥65歲12例,年齡<65歲10例;開腹手術15例,腹腔鏡手術7例。治療組男14例,女12例;年齡≥65歲14例,年齡<65歲12例;開腹手術17例,腹腔鏡手術9例。兩組患者一般資料比較,差異均無統計學意義(P>0.05),具有可比性。本研究符合《赫爾辛基宣言》中倫理要求[2]。
1.2 診斷標準 胃癱診斷標準如下:胃癌術后;夾閉胃管后患者出現頻繁惡心、嘔吐、腹脹等癥狀,胃腸減壓引流量>800 m L/d;胃鏡檢查提示無胃流出道機械性梗阻,可見大量潴留液,殘胃擴張;無引起胃癱的基礎疾病,如糖尿病、甲狀腺功能減退等疾病,無水電解質紊亂、低蛋白血癥;術后未應用影響平滑肌收縮的藥物,如嗎啡;行消化道造影可見胃蠕動減弱或消失[3-4]。
1.3 納入標準 符合上述診斷標準;病例資料完整;患者及家屬同意,并簽署知情同意書。
1.4 排除標準 胃癌合并有遠處器官轉移者;有其他腹部手術史者;術前存在中重度營養不良者。
2 治療方法
2.1 對照組 給予西醫對癥支持治療,包括禁飲食、持續胃腸減壓、維持水電解質平衡、腸內外營養支持、抑酸和胰酶抑制劑等治療,經營養管給予枸櫞酸莫沙必利片(魯南貝特制藥有限公司,國藥準字H19990317,5 mg/片),每次1片,每日3次;多潘立酮片(丹東宏業制藥有限公司,國藥準字H20123053,10 mg/片)每次1片,每日3次。7 d為1個療程,治療2~3個療程。
2.2 治療組 在西醫常規治療基礎上予以針刺治療。取穴:中脘、下脘、氣海、內關(雙側)、上巨虛(雙側)、足三里(雙側)、陰陵泉(雙側)、三陰交(雙側)。患者取仰臥位,穴位定位后,用75%酒精棉球常規消毒局部皮膚,用0.25 mm×40 mm針灸針快速進針,行提插捻轉法,患者感到酸、脹、麻、重感后留針30 min,每日1次。7 d為1個療程,治療2個療程。
3 療效觀察
3.1 觀察指標 ①痞滿癥狀分級與評分,評分標準見表1[5]。痞滿證分級如下,1級:癥狀評分0分;2級:癥狀評分1~6分;3級:癥狀評分7~12分;4級:癥狀評分13~18分。②胃動力恢復時間、胃引流液量、平均住院天數。
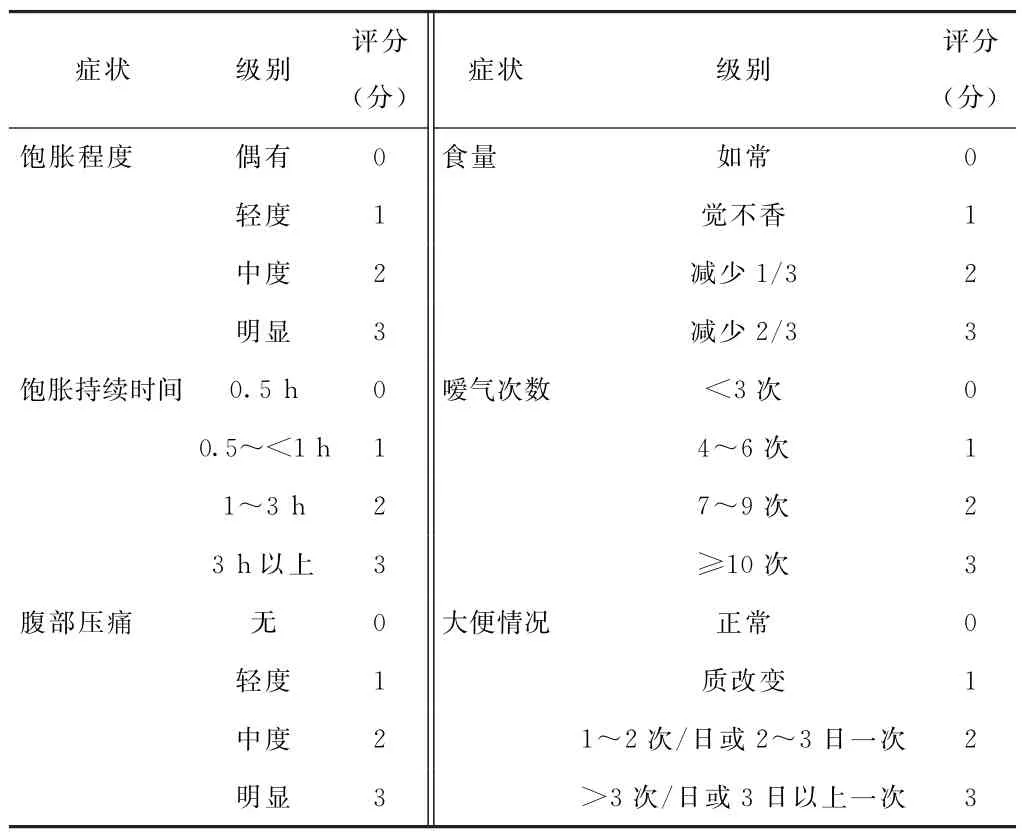
表1 痞滿癥狀分級評分表
3.2 療效評定標準 痊愈:治療后患者惡心、嘔吐、腹脹等癥狀消失,胃管夾閉24 h后無不適癥狀,胃腸道鋇餐透視可見胃排空和蠕動正常,進食后無不適癥狀出現;好轉:治療后患者癥狀消失,胃管夾閉24 h后有輕微腹脹不適癥狀,胃腸道鋇餐透視可見胃排空延遲,蠕動較差;無效:治療后患者癥狀無緩解或加重,造影檢查胃蠕動無改善[6]。總有效率=(痊愈例數+好轉例數)/總例數×100%。
3.3 統計學方法 采用SPSS 17.0統計軟件進行統計分析。計量資料用均數±標準差(±s)表示,采用t檢驗;計數資料以百分率(%)表示,采用χ2檢驗;等級資料采用秩和檢驗。P<0.05差異有統計學意義。
3.4 結果
(1)痞滿癥狀分級及評分比較 治療后,兩組患者痞滿癥狀分級比較,差異有統計學意義(P<0.05)。見表2。治療前,兩組患者痞滿癥狀評分比較,差異無統計學意義(P>0.05);治療后,兩組患者痞滿癥狀評分均較治療前下降,差異均有統計學意義(P<0.05)。見表3。
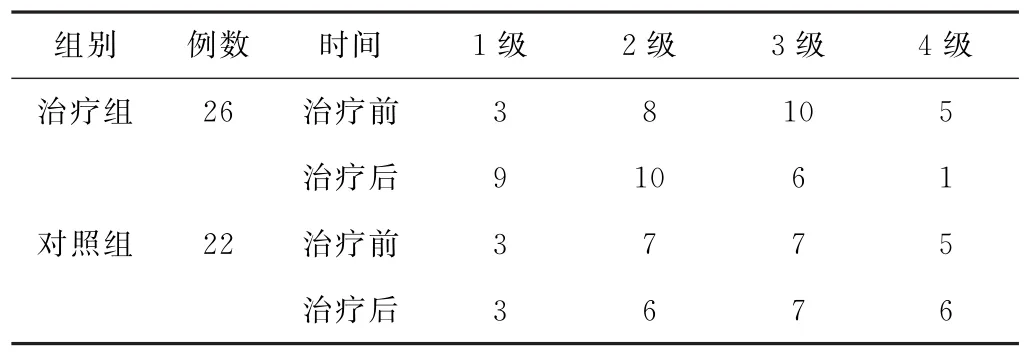
表2 兩組胃癌術后胃癱患者治療前后痞滿癥狀分級比較(例)
表3 兩組胃癌術后胃癱患者治療前后痞滿癥狀評分比較(分,±s)
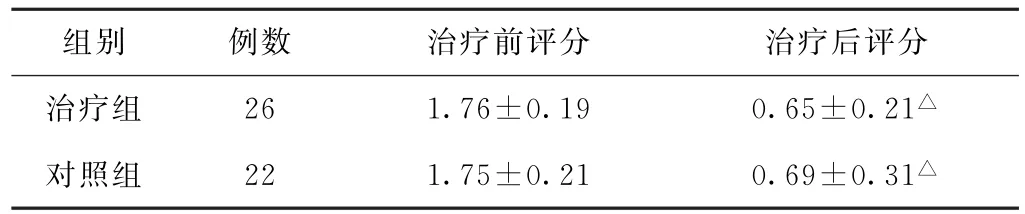
表3 兩組胃癌術后胃癱患者治療前后痞滿癥狀評分比較(分,±s)
注:與本組治療前比較,△P<0.05。
組別 例數 治療前評分 治療后評分治療組 26 1.76±0.19 0.65±0.21△對照組 22 1.75±0.21 0.69±0.31△
(2)臨床療效比較 治療組總有效率高于對照組,差異有統計學意義(P<0.05)。見表4。
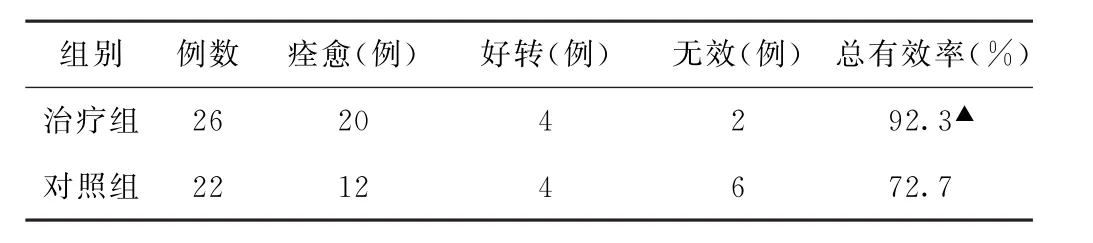
表4 兩組胃癌術后胃癱患者臨床療效比較
(3)胃動力恢復時間、胃引流液量、平均住院天數比較 治療組胃動力恢復時間短于對照組,胃引流液量少于對照組,平均住院天數少于對照組,差異均有統計學意義(P<0.05)。見表5。
表5 兩組胃癌術后胃癱患者胃動力恢復時間及胃引流液量、平均住院天數比較(±s)

表5 兩組胃癌術后胃癱患者胃動力恢復時間及胃引流液量、平均住院天數比較(±s)
注:與對照組比較,▲P<0.05。
平均住院天數(d)治療組 26 17.30±2.69▲ 913.35±52.34▲ 25.23±3.64▲對照組 22 23.00±3.28 1 105.83±34.35 32.43±2.56組別 例數 胃動力恢復時間(d)胃引流液量(mL)
4 討論
PGS是胃大部切除術后常見的并發癥之一,目前發生機制尚不明確,西醫認為其發病多與以下原因有關[5,7]。一是手術因素,手術中可激活交感神經系統,抑制胃腸神經叢的興奮神經元,從而抑制胃動力,或手術后胃和迷走神經的完整性受到破壞,影響術后胃的蠕動。二是合并基礎疾病,術前幽門梗阻可導致電解質紊亂、低蛋白血癥等,或合并糖尿病、甲狀腺功能減退等疾病。三是精神心理因素,患者焦慮、精神緊張可導致體內激肽酶、兒茶酚胺、糖皮質激素等水平改變,從而減弱胃平滑肌蠕動功能,導致食糜及胃腸液潴留,導致PGS發生。四是飲食因素,術后過早、過量進食或進食高脂、高蛋白等不易消化食物后,脂肪作用于十二指腸壁分泌腸抑胃素,抑制胃液分泌,從而降低胃動力。總之PGS的發生是多因素綜合作用的結果,各因素之間具有交互作用。呂振曄等[7]對1 046例胃癌手術患者發生PGS的多因素分析結果顯示:性別、圍手術期、高血糖、術前營養不良、焦慮、術前幽門梗阻、畢Ⅱ式吻合、低蛋白血癥與PGS的發生有關;術中迷走神經干保留是PGS的保護性因素。劉德連等[8]對684例胃癌手術患者發生PGS的多因素分析顯示:年齡、Hp感染、焦慮、圍手術期白蛋白水平、術前梗阻情況、切除位置、吻合方式、是否保留迷走神經干、圍手術期血糖水平和腹腔感染情況是PGS發生的危險因素;年齡<67歲、圍手術期白蛋白>35 g/L和保留迷走神經干是PGS發生的保護性因素。盧翔等[9]通過多因素Logistic回歸分析對456例胃癌手術患者發生PGS的因素進行分析,結果顯示性別、高血糖、術前營養不良、焦慮、術前幽門梗阻、臨床分期、術前新輔助化療、手術方式、術后低蛋白血癥與PGS發生有關;術前分期晚和伴有梗阻癥狀是PGS的主要因素,實施新輔助化療可明顯降低PGS的發生率。
中醫將本病歸于“納呆”“痞滿”等范疇,認為手術損傷脈絡,導致脾胃受損,脾失健運,胃失和降,不能升清降濁,氣機運行受阻,氣血生化不足,不通則痛,故患者出現腹脹、惡心、嘔吐、呃逆等癥狀[10]。中醫認為“六腑以通為用”,不通則痛,治療以疏通氣機為主。在本研究使用的穴位中,足三里可調理脾胃,補中益氣;三陰交健脾益血,調肝補腎,可消除腹脹;上巨虛調中和胃,通腸化滯;中脘健脾和胃,益氣消積;內關寬胸理氣,和胃降逆,理氣止痛,瀉之有抑制嘔吐、呃逆的作用;陰陵泉健脾理氣,通經活絡,針刺該穴可增強胃腸道蠕動。氣海行氣止痛,配足三里、上巨虛可減輕腹脹、腹痛、呃逆、嘔吐、水谷不化等癥狀。線胤生等[6]研究認為,中西醫結合治療腹部腫瘤PGS療效明顯優于單純西藥治療,能夠明顯縮短胃動力恢復時間,改善患者癥狀,促進傷口愈合。有研究者使用針灸及拔罐治療36例PGS患者,總有效率為91.7%,認為針灸配合拔罐治療腹部癌癥PGS臨床療效顯著[11]。高向軍[12]研究認為“木不疏土”為腫瘤PGS的重要發病機制,特點以脾胃虛弱、氣機逆亂、木不疏土為主,證型以脾虛肝胃不和多見,治療應以疏土行氣和中為主。
本研究結果顯示,針刺結合西醫常規療法治療PGS在總有效率、胃動力恢復時間、胃引流液量、平均住院天數方面明顯優于對照組,取得較好的療效,可作為治療PGS的一種有效的方法。本研究未能對影響PGS相關因素進行歸納及統計學分析,將在今后研究中進一步探討相關內容。

