載錳氧化物活性沸石的制備及去除水中Mn(Ⅱ)試驗研究
傅金祥,張思佳,金 星,李 欣,張延平
(沈陽建筑大學(xué) 市政與環(huán)境工程學(xué)院,遼寧 沈陽 110168)
天然沸石具有離子交換性能。陽離子交換型沸石常用于吸附污水中氨氮及飲用水中部分金屬離子[1],但相比于錳砂和石英砂,其在飲用水除錳領(lǐng)域應(yīng)用較少[2]。沸石具有致密疏松的孔道結(jié)構(gòu),可使錳離子更好地吸附在表面,且較強的陽離子交換特性也能使錳離子以M—O形式固化于沸石表面[3],所以,可對沸石進行載錳改性制備吸附劑。
目前,國內(nèi)從水中去除錳多用生物氧化法[4]和接觸氧化法[5]。其中,接觸氧化法是以錳砂為濾料,錳砂表面的水合二氧化錳中的H+交換出Mn2+,使生成MnO·MnO2·H2O,其在原水中有溶解氧存在條件下可再次被氧化成以水合二氧化錳為主要成分的錳質(zhì)活性濾膜,進而又有新的除錳效能,可以循環(huán)往復(fù)。待出水中錳離子穩(wěn)定在較低水平可判定為濾料成熟[6]。但錳砂成本較高,獲取難度較大,且離子交換能力有限,水廠中原水錳離子質(zhì)量濃度一般為1~2 mg/L[7],生成水合二氧化錳的速率較慢且溶解氧氧化能力有限,因此成熟時間較長,除錳效果一般[8-9]。
試驗針對接觸氧化法濾料成熟過程,以沸石為基質(zhì),從濃度較高的含錳溶液中吸附錳,吸附后浸于強氧化劑溶液中進行氧化,分別增強吸附與氧化過程。綜合考慮成本與去除效果,制備一種無須熟化、可直接投入生產(chǎn)的除錳材料[10-11],并通過動態(tài)過濾試驗驗證其除錳效果。
1 試驗部分
1.1 試驗材料、試劑及儀器
天然沸石:取自遼寧省北票市,粒徑1.5~2.5 mm,參數(shù)指標見表1。

表1 天然沸石的參數(shù)
NaClO,高錳酸鉀,過氧化氫,硫酸錳固體(MnSO4·H2O),天津福晨精細化工廠,均為分析純;水,蒸餾水。
紫外可見光分光光度儀(752型),恒溫振蕩培養(yǎng)箱(HZQ-X700型),慎密電子天平,抽濾機(SHC-ZB型),亞克力過濾柱(直徑60 mm,高1 500 mm),潛水泵(50WQ15-12-101型),反沖洗泵(65WYJL-003型)。
1.2 試驗方法
1.2.1 載錳氧化物沸石的制備
用MnSO4溶液分別與KMnO4、NaClO、H2O2溶液交替浸泡天然沸石制得載錳氧化物沸石。
1)MnSO4溶液中Mn2+質(zhì)量濃度200 mg/L。稱取30 g洗凈后的天然沸石浸泡于100 mL MnSO4溶液中,于25 ℃恒溫振蕩培養(yǎng)箱中在160 r/min振蕩速度下振蕩10 h至吸附飽和,取吸附后的上清液,過0.45 μm濾膜后用過硫酸銨分光光度法測定Mn2+質(zhì)量濃度。
2)控制氧化劑種類為KMnO4、NaClO、H2O2,氧化劑的濃度分別為1.0、5.0、10.0 mmol/L,氧化劑的pH分別為6.0、7.0、8.0。將吸附Mn2+后的沸石分別浸泡氧化劑溶液中,在25 ℃、攪拌速度160 r/min條件下振蕩培養(yǎng)9 h,使其表面生成高價錳氧化物MnOz,之后再用蒸餾水沖洗去除表面氧化劑溶液及其他雜質(zhì)。
3)交替重復(fù)1)、2)步驟12次,使濾料表面負載較高含量高價錳氧化物MnOz。單次載錳量(q)計算公式見式(1),整個過程載錳總量對式(1)求和即可得。通過單次載錳量變化與總載錳量進行最優(yōu)制備路線選取。
(1)
式中:ρ—MnSO4溶液中Mn2+質(zhì)量濃度,mg/L;ρ0—浸泡沸石后MnSO4溶液中剩余Mn2+質(zhì)量濃度,mg/L;V—MnSO4溶液體積,L;m—沸石質(zhì)量,g。
表征方法:采用TESCAN MIRA4掃描電子顯微鏡觀察載錳氧化物活性沸石的形態(tài)和表面結(jié)構(gòu);采用Xplore型X射線與能譜分析儀、X射線光電子能譜儀(英國KRATOS,Ultra DLD)測定載錳氧化物活性沸石表面元素。
1.2.2 除錳原理及方法
錳氧化物對Mn2+的去除分兩步:第1步為吸附,溶液中的Mn2+與錳氧化物MnOz(z≥1.5)表面的陽離子Yn+進行離子交換,生成的MnOz·Mn2+具有較強的還原性,表面的二價錳被水中的溶解氧氧化為新的錳氧化物。新的錳氧化物也具備除錳功能,使水中的Mn2+不斷被吸附、氧化進而被去除。主要反應(yīng)如下[6]:
離子交換過程,

(2)
氧化過程,

(3)
采用亞克力濾柱模擬水廠濾池運行過程,動態(tài)裝置如圖1所示,箭頭方向為水流方向。1#濾柱為空白組,填料為天然沸石;2#濾柱為試驗組,填料為載錳氧化物沸石;3#濾柱為對照組,填料為某水廠培養(yǎng)成熟的濾料。填料層高度均為60 cm。
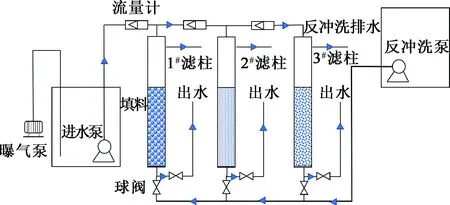
圖1 動態(tài)試驗裝置
待處理原水用硫酸錳配制,MnSO4·H2O加入量3 g/m3,即Mn2+質(zhì)量濃度1 mg/L。由于原水中含有少量Cl-,具有一定還原性,因此,過濾前在水箱中加入2 g無水亞硫酸鈉,用500 L/min增氧泵曝氣10 min,去除Cl-,同時提供溶解氧。自濾柱運行之日起,每隔一定時間在進水水箱回流管處與出水管處取樣,測定進出水Mn2+質(zhì)量濃度,考察除錳效果。
2 試驗結(jié)果與討論
2.1 載錳氧化物沸石制備條件的優(yōu)化
沸石的載錳量受氧化劑的種類、濃度和pH影響。選取L9(33)正交試驗方案,綜合考察氧化劑種類、濃度及pH對沸石載錳量的影響。
正交試驗因素、水平及結(jié)果見表2,單次載錳量變化趨勢如圖2所示。
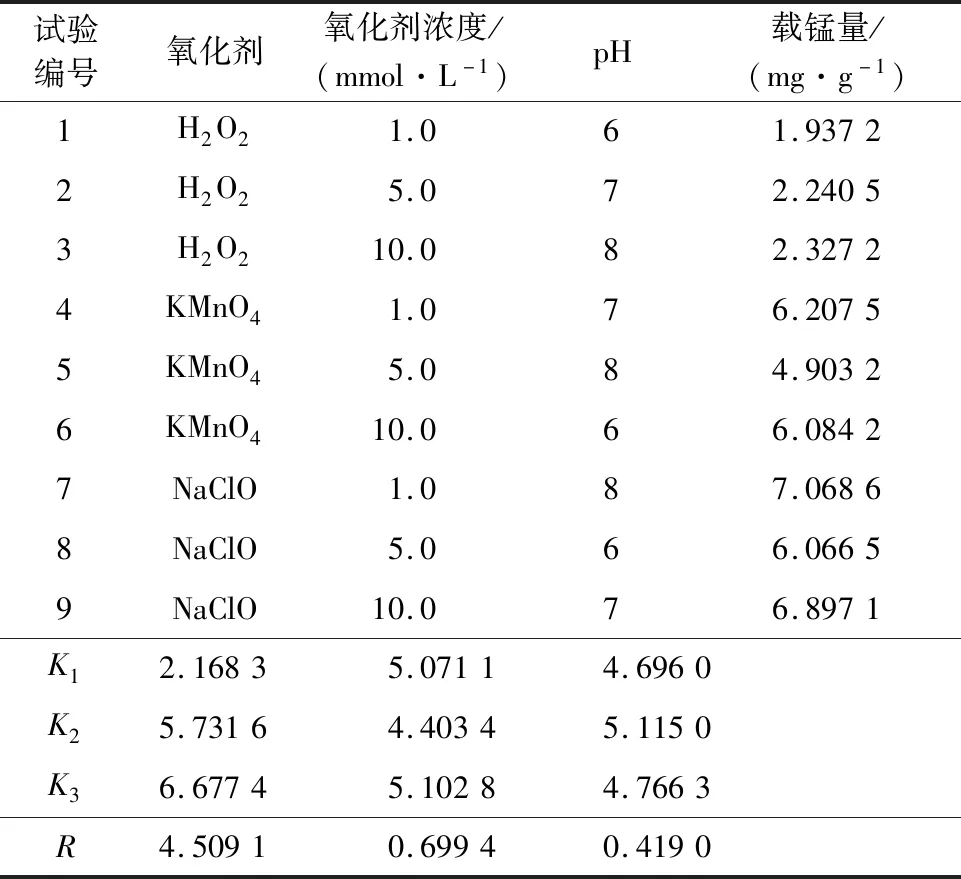
表2 正交試驗因素、水平及結(jié)果
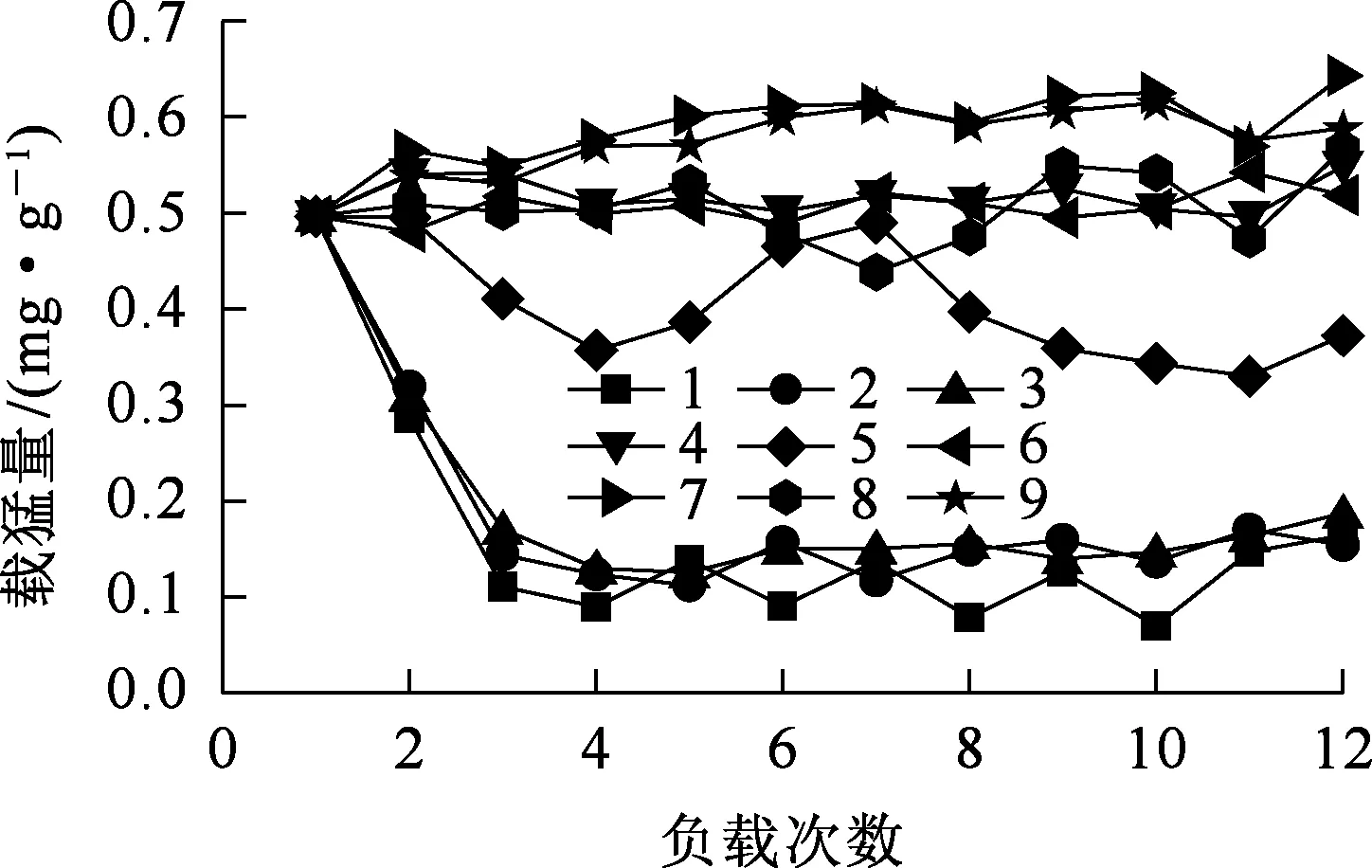
圖2 單次載錳量變化趨勢
由表2看出:以H2O2為氧化劑,沸石表面負載錳氧化物,最后一次載錳量遠小于最大載錳量,隨負載次數(shù)增加,單次載錳量迅速降低;第4次負載后,載錳量逐步趨于平穩(wěn)并有小幅增加趨勢,表明H2O2對沸石表面負載的Mn2+的氧化作用微乎其微,Mn2+依靠天然沸石的吸附作用而負載于沸石表面;最后一次載錳時已達吸附飽和。以KMnO4為氧化劑,沸石表面載錳量較高,隨負載次數(shù)增加,單次載錳量升高;但在pH=8、氧化劑濃度為5.0 mmol/L條件下,單次載錳量出現(xiàn)先下降后升高而后又下降趨勢,這是因為堿性條件下,KMnO4氧化能力降低,載錳過程穩(wěn)定性變差。以NaClO為氧化劑,隨負載次數(shù)增加,整個負載過程中載錳量呈現(xiàn)單邊升高趨勢,載錳能力持續(xù)增強。
由圖2看出:NaClO將Mn2+轉(zhuǎn)化為高價錳的能力最強;載錳過程不僅依靠吸附作用,還需要較強的氧化作用。極差分析結(jié)果表明:3因素對沸石載錳量的影響程度為:氧化劑種類>氧化劑濃度>pH。結(jié)合試驗結(jié)果,確定沸石載錳最佳條件為:沸石用質(zhì)量濃度200 mg/L的MnSO4溶液與濃度1.0 mmol/L、pH=8的NaClO溶液交替浸漬12次,可制得載錳總量7.068 6 mg/g的載錳氧化物沸石。
2.2 載錳氧化物沸石的表征
2.2.1 SEM-EDS表征
天然沸石和所制備載錳氧化物活性沸石表面形貌如圖3所示。可以看出:天然沸石表面存在菱狀結(jié)構(gòu),粗糙程度較小,為典型的菱沸石結(jié)構(gòu);所制備載錳氧化物活性沸石表面孔洞結(jié)構(gòu)分布密集,菱狀結(jié)構(gòu)消失,說明表面成功負載錳氧化物,具有較大的比表面積,利于吸附質(zhì)在其表面孔道中的傳輸和吸附,也利于沸石顆粒與錳氧化物結(jié)合,從而進一步氧化Mn2+。

圖3 天然沸石(a)與載錳氧化物活性沸石(b)的SEM照片
天然沸石與所制備載錳氧化物活性沸石的EDS譜圖如圖4所示。可以看出:天然沸石與載錳氧化物活性沸石表面的Mn、O元素含量有差別,判斷錳氧化物已有效負載于沸石基質(zhì)表面;二者天然沸石與載錳氧化物活性沸石的EDS分析圖譜中均出現(xiàn)O、Al、Si特征峰,且峰面積接近,表明元素含量差距較小,均以硅鋁氧化物為主;點掃過程中,天然沸石未見Mn信號,而載錳氧化物活性沸石出現(xiàn)了Mn特征峰。

圖4 天然沸石(a)與載錳氧化物活性沸石(b)的EDS分析圖譜
通過峰面積計算得出載錳氧化物活性沸石對應(yīng)的元素質(zhì)量分數(shù),結(jié)果見表3。與天然沸石相比,載錳氧化物活性沸石中含有一定量Mn元素,且O、Si元素含量差別增大,表明部分O與Mn結(jié)合生成錳氧化物。載錳氧化物活性沸石表面新增Na元素,表明NaClO不僅起到氧化Mn2+作用,Na+還與沸石表面的Mg2+、Ca2+發(fā)生了離子交換[12],形成了Na型沸石,從而增大了沸石比表面積。
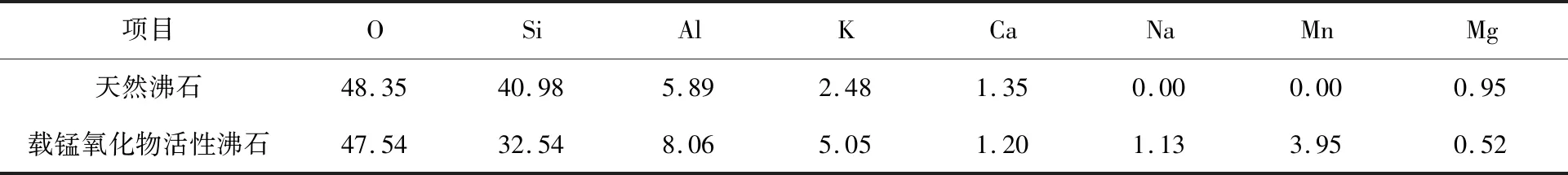
表3 天然沸石與載錳氧化物活性沸石的EDS分析結(jié)果 %
2.2.2 XPS表征
為進一步分析Mn、O元素的價態(tài),初步判斷負載的表面錳氧化物的分子式,對天然沸石與載錳氧化物活性沸石進行XPS分析,結(jié)果如圖5所示。
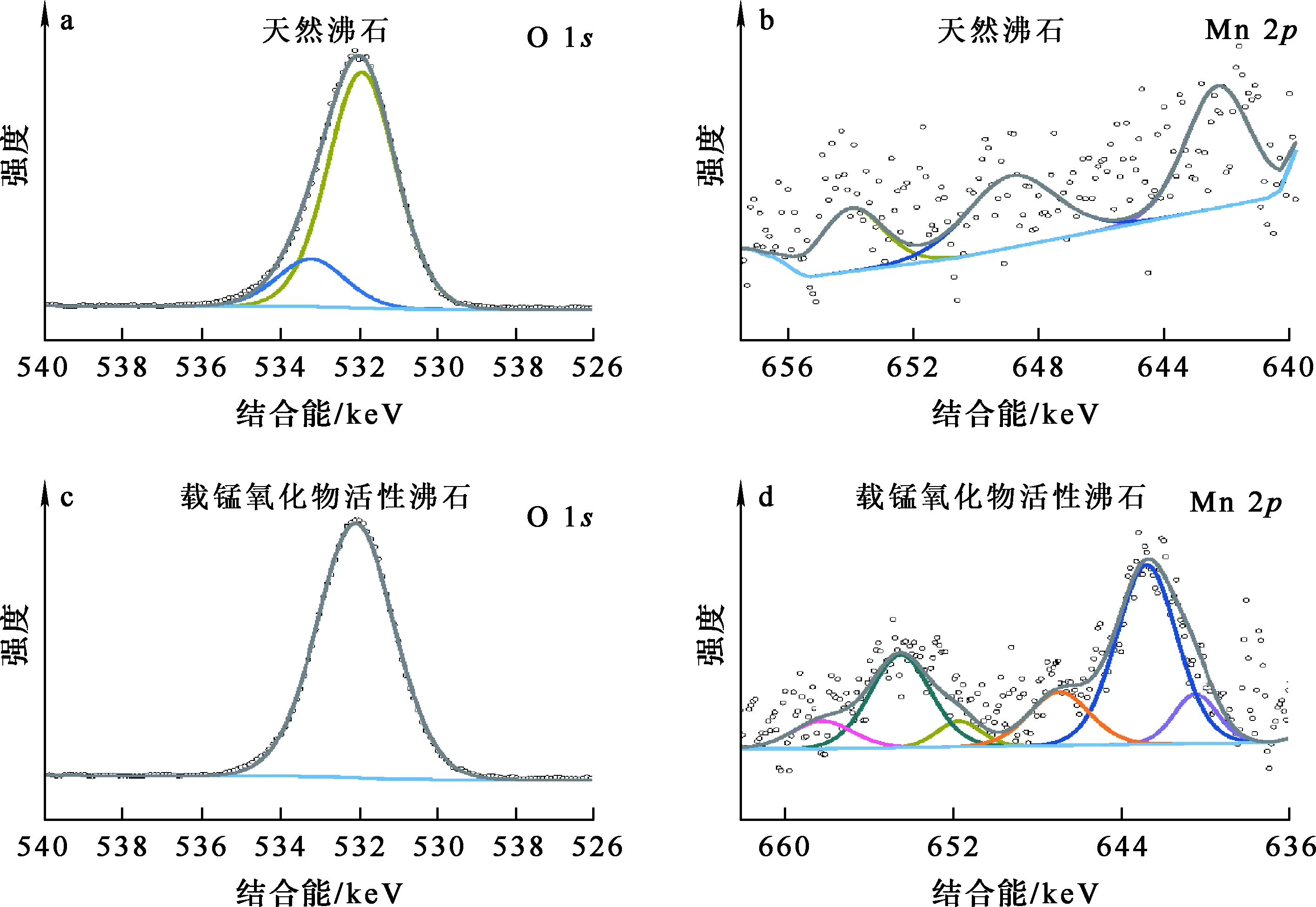
圖5 天然沸石與載錳氧化物活性沸石的XPS分峰擬合曲線

由天然沸石的Mn元素的分峰擬合曲線(圖5(b))看出:并未出現(xiàn)明顯的特征峰信號,且含有較多的雜峰,由此可初步判斷沸石中Mn元素含量較少,可以忽略不計。
由以NaClO為氧化劑,在中性條件下所制備的載錳氧化物活性沸石中O、Mn元素的分峰擬合曲線(圖5(c)、(d))看出:元素的擬合曲線對稱性較強,在結(jié)合能為531.9 eV處出現(xiàn)的特征峰為單峰,可近似認為O元素的存在形式全部為金屬氧化物;在結(jié)合能為640 eV附近對應(yīng)的Mn氧化物類型種類較多,分別為Mn2O3、MnO2、Mn3O4等[13-14]。
針對Mn元素的具體價態(tài)分別進行分峰擬合與半定量分析,并在對應(yīng)結(jié)合能處計算峰面積,結(jié)果見表4。
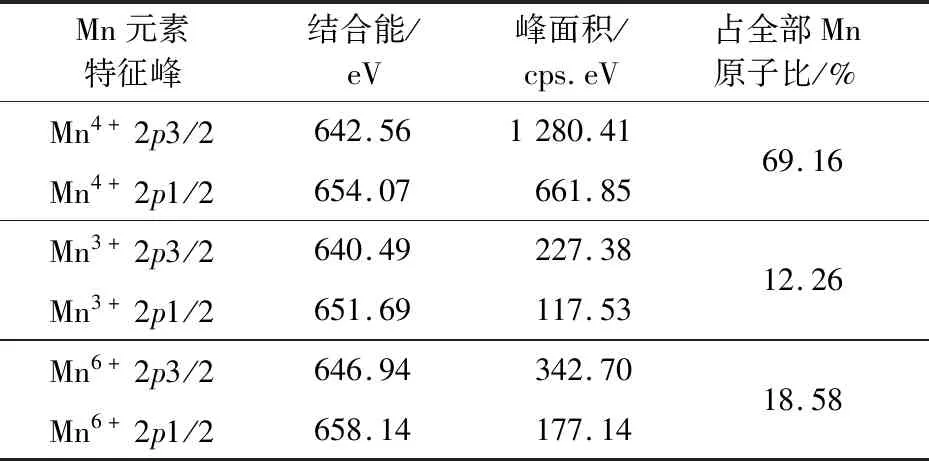
表4 Mn元素存在形式及對應(yīng)含量

2.2.3 XRD表征
根據(jù)XPS分析結(jié)果,可初步判斷,以NaClO為氧化劑、在中性條件下所制備的載錳氧化物活性沸石表面負載的氧化物是一種以MnO2為主、Mn2O3和含六價錳的物質(zhì)為輔的混合物。
天然沸石與載錳氧化物活性沸石的表面成分與對應(yīng)晶型的XRD分析結(jié)果如圖6所示。可以看出:在20.859°、26.639°、36.543°、40.299°、45.792°、50.138°、59.958°、67.742°和68.316°處出現(xiàn)了SiO2衍射峰;在11.191°、18.070°、19.429°、22.490°、23.040°、25.310°、27.039°、30.927°、31.577°和47.031°處出現(xiàn)Ca2Al(OH)6Cl2·2H2O的衍射峰;在217.204°、24.434°、27.334°、51.563°、54.303°、65.798°、71.361° 和79.585°處出現(xiàn)MnO2衍射峰。結(jié)果表明:天然沸石表面晶體形態(tài)主要為SiO2與Ca2Al(OH)6Cl2·2H2O,屬于常見的鈣型沸石[12];載錳氧化物沸石表面晶體形態(tài)主要為SiO2,且新增MnO2,未出現(xiàn)其他類型錳氧化物,表明錳氧化物成功負載于天然沸石表面,且主要成分為MnO2。
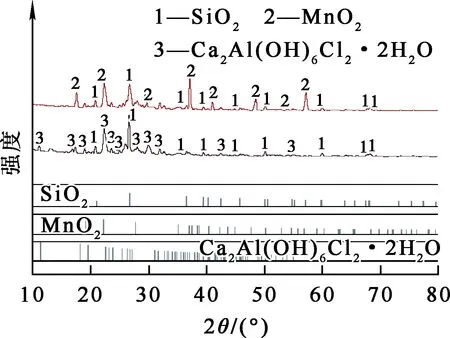
圖6 天然沸石與載錳氧化物活性沸石的XRD圖譜
2.3 沸石動態(tài)除錳
采用動態(tài)過濾柱模擬飲用水廠濾池實際運行過程,運行周期20 d,過濾周期10 d,反沖洗強度以濾料流態(tài)化臨界值為準,進水Mn2+質(zhì)量濃度1.0 mg/L左右,進水流速3 m/h。試驗結(jié)果如圖7所示。可以看出:天然沸石在運行至第3天時已達吸附飽和,喪失除錳能力;載錳氧化物活性沸石除錳效果較好,在運行第10天反沖洗后,出水錳離子濃度略有反彈,但隨后又呈現(xiàn)下降趨勢。根據(jù)表征結(jié)構(gòu)結(jié)果,沸石表面氧化膜由MnO2、Mn2O3和含六價錳物質(zhì)及Na型沸石共同組成,較大的比較面積增強了離子交換性,隨過濾時間延長,原水中的Mn2+被牢固地吸附于載錳氧化物活性沸石表面[17],同時氧化膜協(xié)同水中的溶解氧將原水中Mn2+進一步催化氧化為新的氧化膜,具備自催化氧化能力,進而將原水中Mn2+去除,Mn2+最高去除率達90.25%,平均去除率為83.71%,高于天然沸石、但略低于水廠成熟濾料的除錳能力。
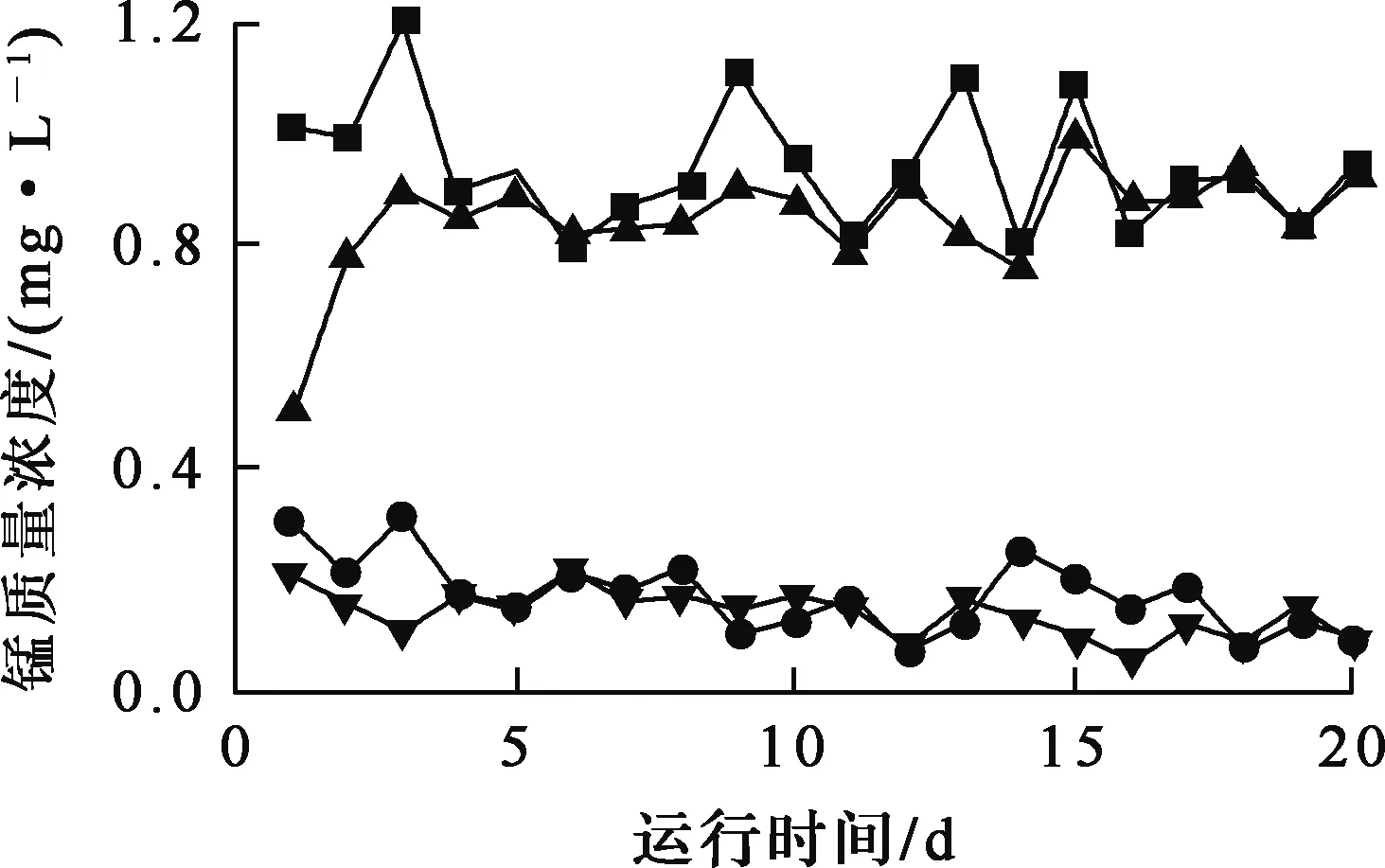
—■—進水Mn2+質(zhì)量濃度;—▲—天然沸石濾后水;—●—載錳氧化物活性沸石濾后水;—▼—水廠成熟濾料。
3 結(jié)論
沸石負載錳氧化物后可用作飲用水除錳材料,沸石載錳量可達7.068 6 mg/g。與天然沸石相比,MnSO4與NaClO交替浸漬所制備的載錳氧化物活性沸石表面Mn元素含量增加,負載一層疏松多孔的錳氧化物的同時生成鈉型沸石,有利于Mn2+在其表面孔道中傳輸,同時有利于沸石顆粒與錳氧化物結(jié)合。沸石表面負載的氧化物是一種以MnO2晶體為主、Mn2O3和含六價錳物質(zhì)為輔的混合物。
模擬試驗結(jié)果表明:對于錳離子質(zhì)量濃度1.0 mg/L 左右的飲用水,載錳氧化物活性沸石對Mn2+的去除率可達90.25%,平均83.71%,且無須再生,其自催化氧化過程能夠持續(xù)除錳。

