3004例烏靈膠囊上市后安全性醫院集中監測研究*
王嘉麟,周莉,王忠,邢佳,高翔,焉石,侯震,劉小北,曹利民,陸文惠,單利華0,呂瑩,常和生,郭蓉娟
(1.北京中醫藥大學東方醫院康復科,北京 100700;2.北京中醫藥大學東直門醫院腦病二科,北京 100700;3.中國中醫科學院中醫臨床基礎醫學研究所,北京 100700;4.寧波大學醫學院附屬醫院神經內一科,寧波 315000;5.中國醫科大學航空總醫院中醫科,北京 100012;6.北京市大興區人民醫院中醫科,北京 102600;7.平湖市第一人民醫院神經內科,平湖 314200;8.杭州市蕭山區中醫院神經內科,杭州 311201;9.西安交通大學第一附屬醫院神經內科,西安 710061;10.浙江省海寧市人民醫院神經內科,海寧 314400;11.清華大學附屬垂楊柳醫院神經內科,北京 100022;12.北京豐臺醫院精神科,北京 100071;13.北京中醫藥大學東方醫院黨院辦,北京 100700)
烏靈膠囊于1999年獲批生產并上市,是源于珍稀藥食兼用真菌黑柄炭角菌(別名烏靈參),經現代生物工程技術精制而成的純中藥制劑。其制備工藝和菌種為國內首創,是國家中藥一類新藥。其化學成分與天然烏靈參相似,含有腺苷、腺嘌呤、甘露醇、鳥苷、多糖、19種氨基酸(其中必需氨基酸9種)以及多種維生素和微量元素[1-2]。烏靈膠囊適用于心腎不交所致失眠、健忘、心悸心煩、神疲乏力、腰膝酸軟、頭暈耳鳴、少氣懶言、脈細或沉無力、神經衰弱見上述癥候者[3],具有補腎健腦、養心安神功效。藥理研究證實,烏靈膠囊能增加腦組織對興奮性神經遞質谷氨酸和抑制性神經遞質γ-氨基丁酸的通透性,保護和提高大腦生理功能,增強谷氨酸脫羧酶活性,從而使γ-氨基丁酸合成增加,同時可提高γ-氨基丁酸受體活性,最終發揮鎮靜安眠作用[2]。
目前,烏靈膠囊在臨床上已廣泛應用。但其相關藥物不良反應(adverse drug reaction,ADR)和不良事件(adverse drug event,ADE)筆者鮮見報道。筆者統計國家藥品不良反應監測系統全國數據庫,發現2009年至2013年僅收到烏靈膠囊相關一般ADR392例,其中皮疹瘙癢67例,惡心42例,腹瀉 31 例,嘔吐 31 例。ADR發生率每萬人0.33例。涉及烏靈膠囊相關的ADR文獻報道少。楊懷恩[4]報道2例患者在無明顯誘因情況下,服用常規劑量烏靈膠囊后出現水樣腹瀉,同時伴有惡心、嘔吐癥狀。陳文燕等[5]應用烏靈膠囊合用生脈注射液治療失眠癥40例,口服烏靈膠囊后l例患者出現大便稀,l例患者出現上腹部輕度不適,未作處理。但是受研究局限性以及缺乏大規模人群臨床研究,上述ADR證據級別較低。
藥品上市后安全性再評價,可以彌補藥品上市前研究不足,醫院集中監測是近年來藥物臨床安全性評價中主動監測方法之一,具有不干預臨床用藥、資料詳盡、數據準確可靠、能夠計算出ADR相對發生率,并可對其危險因素進行探討等特點[6-7]。根據《藥品不良反應報告和監測管理辦法》(衛生部令第81號)、《關于加強國家基本藥物目錄(2009版)藥品不良反應監測相關工作的通知》(監測與評價綜[2009]199號)等規范文件要求,筆者在本研究以烏靈膠囊為研究對象,采用醫院集中監測法,對在真實世界下使用烏靈膠囊的患者進行系統研究,明確烏靈膠囊上市后大規模人群使用時的臨床安全性,發現安全性信號,現報道如下。
1 資料與方法
1.1資料來源 選擇2013年6月15日—2015年12月31日12家醫療機構(北京中醫藥大學東方醫院、北京中醫藥大學東直門醫院、寧波大學醫學院附屬醫院、北京豐臺醫院、浙江省海寧市人民醫院、中國中醫科學院廣安門醫院南區、中國醫科大學航空總醫院、北京市大興區人民醫院、清華大學附屬垂楊柳醫院、杭州市蕭山區中醫院、西安交通大學第一附屬醫院、平湖市第一人民醫院所有使用烏靈膠囊(批準文號:國藥準字Z19990048)且符合倫理要求的患者為研究對象。參考2013年《中藥上市后安全性醫院集中監測技術規范》(征求意見稿)[7]中關于樣本量計算的“三例原則”,即“在現有X例研究中沒有觀察到特定事件的發生,則有95%可能性相信這類事件發生率≤3/X”,并按檢出罕見藥品ADR(1/10000—1/1000)估算,擬收集3000例。
1.2研究設計 本研究采用單臂、多中心、前瞻性醫院集中監測設計。
1.3醫學倫理與注冊 本研究監測方案通過北京中醫藥大學東方醫院臨床研究倫理委員會審查,倫理委員會批件文號:2013041702-2,方案在中國臨床試驗注冊中心網站(網址https://www.chictr.org)注冊,注冊號:ChiCTR-ONC-13003245。
1.4監測方法和流程 由經過統一培訓的、指定的醫生、護士或者藥學工作者根據監測醫療機構門診現場記錄或者醫院信息管理系統(hospital information system,HIS),無挑選、連續地納入使用烏靈膠囊的患者(即被監測者)。被監測者自用藥開始即進入患者監測階段,并記錄在《烏靈膠囊集中監測觀察表》中,選擇第0天、第7天、第30天及其后每隔30 d為一個隨訪點,直至患者停止使用烏靈膠囊。在用藥期間發生ADE,需研究者在獲知后24 h內填寫《烏靈膠囊不良事件觀察表》,并及時隨訪和電話追蹤患者ADE轉歸情況及采取措施,若發生任何嚴重ADE(包括需住院治療、延長住院時間、傷殘、影響工作能力、危及生命或死亡、導致先天畸形等事件),研究者除立即對受試者采取緊急的處理措施外,還必須立即(3 h內)報告本研究中心負責人或監查員,監查員應在12 h內到達現場了解并反饋處理結果。紙質觀察表格由填表者和觀察者簽名。
1.5安全性評價指標 本研究選取ADE/ADR發生率、ADE/ADR轉歸、ADR危險因素(如年齡、性別、既往史、劑量等)等為評價指標。其中ADE/ADR分類參照《WHO藥品ADR術語集》[8],并根據國際醫學科學組織委員會(CIOMS)推薦使用的標準[9]。將ADR發生率分級為:十分常見(≥10%)、常見(1%~<10%)、偶見(0.1%~<1%)、罕見(0.01%~<0.1%)、十分罕見(<0.01%)。并根據國家藥品不良反應監測中心現行6級評價標準(肯定、很可能、可能、可能無關、待評價、無法評價)[10]進行ADR關聯性評價。ADE/ADR依次經過監測者及臨床專家判讀,對確實難以判定或監測者與臨床專家判讀結果不一致時,由監測醫療機構專家委員會召開專家會議討論后確認。
1.6質量控制 本項目的研究過程進行嚴格的質量控制,分工明確,責任到人。
1.6.1研究中心與研究者 項目方案經論證后,由合同研究單位根據企業和品種的市場分布情況,聯系確定研究中心及研究者,明確工作流程、工作職責。研究者選擇具有實施能力的醫師、護士、藥學工作者。
1.6.2藥物安全監測委員會 本項目聘請或委任4名醫學(分別是神經內科、精神科、康復科、中醫科)、2名藥學(均為臨床藥師)、2名藥品監督管理、2名統計學方面的專家提供咨詢意見。這些專家可以從他們各自的專業角度提供專業意見。該委員會的主要任務為:在集中監測期間,定期對安全性數據進行階段性分析,這種分析主要著重于系統性分析,也就是經過對統計學處理過的數據進行分析,通過與歷史性數據進行對比,觀察ADR與ADE發生率、分布情況以及是否具有臨床意義。
1.6.3項目培訓 在牽頭單位及分中心召開方案實施啟動會,對各研究中心負責人、研究者、監查員、監查助理等涉及人員進行培訓,明確工作流程、工作職責,統一工作表格、在線系統的填寫規范。
1.6.4報表質量 統一制定觀察表,并附填表說明和研究者手冊。每份觀察表必須由指定的填表員親自填寫,監測人員在收集觀察表時,應確認該表填寫無誤,并簽名;組織單位對收集的報表按10%的比例進行抽查;對于嚴重病例,應定期隨訪,直至項目結束。
1.6.5觀察表失訪 每份觀察表事先制定唯一編碼,根據各地區項目負責人掌握的銷售情況,估計觀察例數,如有報表缺失,需注明原因。
1.6.6ADE失訪 項目組對未發生ADE的病例按照10%比例進行電話回訪。
1.7數據管理 本研究數據采集使用集中監測觀察表(紙質資料)和在線數據系統(電子數據庫)。紙質材料實行雙人雙份錄入、核對制度,原始報表由組織單位統一保管,查閱報表者需簽名登記。
在線系統的建立及研究期間的維護委托專業單位完成,組織單位、主辦單位等單位的相關人員具有不同的訪問權限,及時查看在線病例數據,及時處理疑問。研究結束后由中國中醫科學院中醫臨床基礎醫學研究所負責數據分析。數據分析完畢后交由組織單位和主辦單位保存。
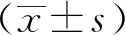
2 結果
2.1病例分布
2.1.1一般人口學資料 本研究共納入患者3004例,年齡12~102歲,平均(51.00±15.65)歲。其中男1000例,平均(51.03±16.76)歲,女1997例,平均(50.99±15.06)歲,7例患者未填寫一般人口學資料。本研究中首次使用烏靈膠囊患者2738例(91.15%)。
2.1.2用藥情況 按烏靈膠囊說明書所示,烏靈膠囊用法用量為一次3粒,一日3次。根據本研究納入3004例患者服用藥物劑量記錄:其中平時劑量為3粒2683例(89.31%),其他粒數321例(10.69%);根據用藥頻次,其中一日1次、一日2次、一日3次分別是301例(10.02%)、28例(0.93%)、2675例(89.05%)。本研究中有84例患者存在特殊劑量使用情況。其中一日3粒、4粒、6粒以及早3粒晚6粒患者分別是17例(0.57%)、10例(0.33%)、57例(1.90%)、2例(0.07%)。
2969例有停藥原因記錄,其中治愈1171例(38.98%),無效換藥277例(9.22%),其他1410例(46.94%),不詳111例(3.70%)。3004例患者均記錄是否存在間隔用藥,其中有間隔用藥者545例(18.14%),無間隔用藥者2459例(81.86%);均記錄是否依據中醫證型用藥,其中完全符合2068例(68.84%),基本符合926例(30.83%),不符合但接近10例(0.33%);均記錄是否存在合并用藥,其中有合并用藥1762例(58.66%),無合并用藥1242例(41.34%)。
2.2安全性分析
2.2.1ADE/ADR發生情況 研究結束時,3004例中發生ADE19例,包括食欲減退和腹瀉各4例,胃部不適3例,感冒和口干各2例,神倦乏力、惡心、心悸頭痛、頭暈各1例,發生率0.63%,無嚴重ADE發生。根據國家藥品不良反應監測中心現行6級評價標準,15例經專家判斷為ADR,ADR發生率0.50%,無新發現ADR。各中心監測病例數及發現的ADE/ADR明細見表1。

表1 烏靈膠囊監測中心分布情況
2.2.2ADE/ADR表現、處置及轉歸 19例ADE,治愈8例,好轉11例。2例停藥,其余17例均按原劑量繼續使用,見表2。

表2 ADE/ADR表現、轉歸及判定
2.2.3ADR累及系統 15例藥物ADR主要累及系統是胃腸系統損害(食欲減退、口干、惡心、腹瀉、胃部不適),交感-副交感神經系統損害(心悸),中樞及外周神經系統損害(頭暈、頭痛),即主要為消化系統和神經系統,見表3。

表3 烏靈膠囊ADR分布與表現
2.2.4ADR影響因素分析 治療中心、性別、年齡分段、既往病史、首次用藥、ADR史、家族ADR、首次劑量、平時劑量(粒·次-1,次·d-1)、特殊劑量(粒·次-1,次·d-1)、療程、停藥原因、辨證用藥、有無合并用藥對烏靈膠囊的ADR發生率影響差異無統計學意義,見表4。

表4 ADR影響因素分析

續表4 ADR影響因素分析
3 討論
3.1烏靈膠囊的安全性 烏靈參又稱烏靈菌、雞茯苓、雷震子等,具有鎮靜安神、補氣固腎、健脾除濕等功效。目前,其中藥制劑烏靈膠囊在神經、精神、消化系統疾病中應用廣泛,雖然烏靈參屬于藥食兩用中藥,但是在臨床應用時,仍偶見上腹不適、腹瀉等消化系統癥狀。筆者曾收集1989—2009年有關烏靈膠囊應用的文獻75篇[11],發現其ADR包括水樣便、惡心嘔吐、上腹不適、過敏性皮炎、心悸、頭暈頭痛等,停藥后可自行恢復正常。一項多中心、隨機、雙盲、雙模擬平行對照研究[12]發現,無伴隨精神用藥的群體中,單獨服用烏靈膠囊比單獨服用氟哌噻噸美利曲辛的ADR發生率更低。另一項多中心、隨機、雙盲研究[13]觀察到,受試者服用烏靈膠囊或者安慰藥,其ADR發生率無明顯差異。上述兩項多中心研究均證實服用烏靈膠囊具有較高安全性。但為更系統研究該藥ADR及ADE,本研究采用多中心醫院集中監測法,進行烏靈膠囊上市后安全性再評價,以期獲得更真實、客觀的臨床使用數據,從而更好指導臨床用藥。
本研究在2015年12月底共收集臨床病例3004例,隨后經過病例登記表數據復核等一系列審核及統計工作,直至 2019 年底獲得初步結論。數據整理期間,國家藥品不良反應系統新收到ADR704例,結合烏靈膠囊的用藥人群估算,推測其ADR發生率約為每萬人0.76例,且以皮疹瘙癢、惡心、腹瀉為主。雖然后期ADR發生率略高于早期每萬人 0.33 例,但仍低于本研究采用醫院集中監測觀察到的結果。因此,也客觀證明醫院集中監測研究在探討藥物安全性問題上具有一定優勢。在本研究中,所有患者均使用烏靈膠囊,研究結果顯示烏靈膠囊ADR癥狀包括食欲減退、腹瀉、胃部不適、口干、惡心、心悸、頭痛、頭暈等,其中以消化系統多見,屬偶見ADR,未見嚴重ADE。烏靈膠囊ADE/ADR發生率分別為0.63%及0.50%,同時未發現與ADR相關影響因素,包括中心效應、患者性別、年齡、既往史、首次用藥、ADR史、家族ADR、首次劑量、平時劑量、特殊劑量、療程、療程分段、停藥原因、辨證用藥、合并用藥等,因此該藥臨床應用安全性較高。
3.2本研究的優勢 藥物上市后安全性研究中,包括大樣本醫院集中監測研究、基于國家藥品不良反應監測中心數據的ADR信號發現、文獻分析等[14]。本研究采取大樣本、前瞻性醫院集中監測方法,其數據來源于真實世界,不僅能觀察到不良事件發生情況,而且已知使用藥物的基礎人群情況,因此能計算ADR發生率,得出的結論是藥物安全性研究中證據級別最高的[15],也是目前較好的藥物安全性研究方法。
3.3本研究的缺陷 在ADE和ADR觀察方面,本研究可能存在一定問題:①研究涉及的實驗室指標相對較少,有可能低估實驗室檢查異常值方面的ADE/ADR;②研究醫院的選擇主要集中在北京市、浙江省和陜西省。對于西部和南部等地區用藥情況欠缺,可能地域選擇存在偏倚;③部分醫學中心對ADR理解有偏差,如將“感冒”當成ADR上報;填表不仔細,缺失項目較多,提示培訓中表格填寫的統一性和填表質量的督導力度仍不夠,均予以剔除。
總之,通過本研究證實烏靈膠囊ADR屬偶見ADR,臨床應用安全性較高。但是后續仍需要重視新發現的ADR,并進行深入的研究闡明其發生機制,來修訂和完善藥品使用說明書,為臨床安全用藥提供依據。同時集中監測法是開展中成藥安全性研究的適宜方法。

