卵巢過度刺激綜合征的分子機制和治療研究進展
陳佳葉,方蘭蘭,孫瑩璞
(鄭州大學第一附屬醫院生殖與遺傳專科醫院,鄭州 450052)
卵巢過度刺激綜合征(OHSS)是輔助生殖技術(ART)的嚴重并發癥之一,OHSS以卵巢增大、雌激素水平升高、血管通透性增加、胸腹水及血栓形成等為主要特征;根據臨床癥狀分為輕、中、重度OHSS,其中輕度OHSS發生率可達20%~30%,中重度OHSS發生率為2%~3%[1]。臨床上OHSS的治療目前多為對癥治療,如靜脈補液擴容、改善血液高凝狀態、穿刺引流胸腹水等,必要時需終止妊娠;OHSS嚴重者可致孕婦死亡[2]。但OHSS的發病機制尚不明確,如何預測OHSS發生和早期防治仍是目前面臨的重大挑戰。本文將綜述近年來OHSS發生的分子機制和防治措施的研究進展,為OHSS早期防治和個性化精準治療提供參考。
一、OHSS發生的病理生理改變
人絨毛膜促性腺激素(HCG)是促進OHSS發生的關鍵因素,在ART助孕過程中外源性促性腺激素的基礎上,外源性給予HCG可觸發級聯反應,表現為血清中雌激素等激素水平上升,血管內皮生長因子(VEGF)、各類細胞因子、腎素等血管活性物質釋放,導致毛細血管通透性增加,體液大量外滲進入第三間隙,產生胸腹腔積液,導致有效循環血容量減少、血液濃縮、低血容量休克,發生卵巢增大、臟器功能衰竭等一系列OHSS病理生理改變。
二、OHSS分子機制研究進展
目前研究已證實OHSS的發病與大量生長因子、其他細胞因子以及卵巢腎素-血管緊張素-醛固酮系統(OVRAS)等相關。
(一)生長因子與OHSS
1.VEGF:VEGF是調節血管生成及毛細血管通透性的重要因子,在使用相同促排方案的患者中,與對照組相比,OHSS組的顆粒細胞和卵泡液中VEGF水平明顯升高[3]。動物模型的研究表明,靶向VEGF或其受體可以阻止OHSS的發展[4]。多巴胺激動劑卡麥角林可阻斷VEGF及其受體復合物的下游信號通路,給予患者卡麥角林后,可預防OHSS發生,降低發病風險[5]。此外,環氧合酶2(COX-2)和內質網應激可以通過調節VEGF表達參與OHSS發生發展。COX是花生四烯酸轉化為前列腺素和其他類花生酸的關鍵酶。在多項研究中發現,COX-2與血管生成相關,COX-2過表達使得大量促血管生成因子產生,包括VEGF等[6]。此外,免疫組織化學結果顯示COX-2和VEGF在卵巢中具有相似的空間分布,COX-2定位于卵巢顆粒細胞及卵巢血管中[7]。HCG注射可上調卵泡液內COX-2表達,進一步研究發現,COX-2基因在OHSS大鼠卵巢中的表達增加,給予COX-2選擇性抑制劑美洛昔康后抑制VEGF高表達,降低其卵巢重量的增加[8]。因此,COX-2調節VEGF表達可能是OHSS發病機制之一。內質網應激也上調人卵巢顆粒細胞中VEGF的表達;抑制內質網應激可降低OHSS大鼠VEGF的表達[9],提示內質網應激上調VEGF表達可能與OHSS相關。故VEGF被認為是促使OHSS發生發展的一個重要介質。
2.色素上皮衍生因子(PEDF):PEDF是一種天然、高效的新生血管抑制劑,在VEGF存在的情況下可以明顯抑制血管內皮細胞管腔形成和遷移,具有抗血管生成作用[10]。PEDF在人卵巢中表達,由顆粒細胞產生和分泌,HCG可下調PEDF的表達,并且PEDF的表達與VEGF的表達情況相反[11]。PEDF和VEGF之間的平衡可能參與維持卵巢的正常生理活動,這兩種因子之間的平衡部分受HCG或LH的調節。此外,PEDF通過抑制HCG上調的VEGF和炎癥介質表達,改善OHSS小鼠體重增加、卵巢增大、血管通透性增加等癥狀[12]。這些研究表明,PEDF通過調節VEGF與炎癥介質的表達參與OHSS發生發展。
3.雙調蛋白(AREG)及相關受體:AREG是人顆粒細胞和卵泡液中表皮生長因子受體(EGFR,又稱HER1/ErbB1)最主要的配體,EGFR和HER2(ErbB2)屬于酪氨酸激酶受體家族,是一種廣泛表達的跨膜酪氨酸激酶,AREG結合EGFR,激活細胞內信號級聯,調控多種生理活動[13]。OHSS患者顆粒細胞和卵泡液中AREG、EGFR和HER2高表達,卵泡液中AREG蛋白水平與竇卵泡數量、回收卵母細胞數、血清雌二醇水平等呈正相關。AREG作用于顆粒細胞可上調VEGF的表達和分泌,且這一促進作用在OHSS患者中更迅速、更顯著[3]。此外,研究表明,HCG誘導的AREG上調顆粒細胞中芳香化酶的表達,進而促進雌二醇的合成[14]。這些結果表明顆粒細胞分泌的AREG在OHSS的發生發展中起重要作用,提示EGFR/HER2介導的信號轉導通路可能是預防和治療OHSS新的藥物靶點。
4.轉化生長因子β1(TGF-β1):TGF-β1是TGF-β超家族成員之一,是一種功能多樣但結構保守的蛋白質[15]。其中,TGF-β1及TGF-β受體在顆粒細胞中均有表達,人卵泡液中也可檢測到TGF-β1蛋白。進一步研究發現,TGF-β1結合并活化TGF-β受體,通過SMAD、ERK1/2和p38 MAPK信號通路上調人顆粒細胞中VEGF和芳香化酶的表達以及雌二醇的生成[16]。在接受IVF助孕的患者中,OHSS患者卵泡液中TGF-β1、雌二醇和VEGF水平均升高且相關。此外,OHSS小鼠卵巢TGF-β1表達增加,阻斷TGF-β1信號通路可抑制VEGF高表達,使OHSS小鼠體重增加和卵巢增大癥狀得到改善[17]。因此,TGF-β1可能通過上調VEGF和雌二醇的表達參與OHSS的發生發展,靶向TGF-β1信號通路可作為預防OHSS發生的新型分子治療措施。
5.Sprouty2(SPRY2):SPRY2是EGFR介導的ERK1/2信號傳導通路中的重要調節因子[18]。研究表明,表皮生長因子(EGF)、成纖維細胞生長因子(FGF)等通過激活ERK1/2信號通路上調人顆粒細胞中SPRY2的表達[19]。接受IVF助孕的患者中,并發OHSS的患者顆粒細胞中SPRY2表達水平顯著升高,提示SPRY2的高表達可能與OHSS發生相關。進一步研究發現,HCG通過ERK1/2信號通路上調人顆粒細胞中SPRY2的表達,阻斷SPRY2內源性表達后,AREG上調的COX-2及PGE2表達受抑制[20]。此外,新近研究發現,在OHSS患者卵泡液中,外泌體miR-27通過靶向SPRY2下調活性氧的產生并促進顆粒細胞凋亡[21]。以上結果表明HCG誘導的SPRY2介導人顆粒細胞中AREG對COX-2/PGE2表達的上調可能是OHSS的發病機制之一。
(二)其他細胞因子在OHSS發生中的作用
1.白細胞介素(IL):卵巢自身合成和分泌的IL在OHSS發生發展中發揮一定的作用。研究發現,OHSS患者的腹腔積液中IL-1水平較高,而IL-1受體拮抗劑水平較低,IL-6和IL-8水平顯著升高[22]。在OHSS患者血清中IL-6水平也顯著升高,但隨著癥狀的改善,其水平逐漸下降至正常[23]。此外,OHSS患者外周血單核細胞中IL-2高表達[24]。IL參與炎癥反應,增加血管通透性導致OHSS發生[23]。
2.其他細胞因子:其他的一些細胞因子也與OHSS發病密切相關,如腫瘤壞死因子α(TNF-α)、一氧化氮(NO)等。卵巢自身合成TNF-α,在顆粒細胞中檢測出高親和力受體[25]。OHSS患者腹腔積液中TNF-α水平顯著升高[26]。此外,研究發現HCG抑制NO合成[23],且OHSS患者腹腔積液中NO最終代謝產物——亞硝酸鹽水平顯著降低[27],NO的降低可增加毛細血管通透性,故低水平NO可能與OHSS相關。
(三)OVRAS與OHSS
OVRAS受HCG調節,對卵泡發育、排卵和類固醇激素分泌有重要影響。血管緊張素及其受體廣泛分布于卵泡、排卵前卵泡膜細胞和顆粒細胞中,并調節類固醇生成[28]。使用促性腺激素促排卵患者血中及卵泡液中腎素原濃度大幅增加,而且濃度與排卵前卵泡數量呈正相關。OHSS患者的卵泡液和血漿中可檢測出高腎素活性[29]。進一步研究發現,卵泡內血管緊張素Ⅱ誘導前列腺素釋放,促進血管生成,增加血管通透性[30],是OHSS發生的重要機制。
(四)激素與OHSS
1.雌激素:OHSS患者血清高雌二醇水平與OHSS的發生顯著相關[31]。動物實驗中,與對照組小鼠相比,OHSS小鼠卵巢芳香化酶的表達和血清雌二醇水平上調[32]。有研究發現囊性纖維化跨膜傳導調節因子(CFTR)作為一種cAMP激活的氯離子通道,其在體液平衡調節中起重要作用;在OHSS大鼠中,雌二醇上調CFTR表達可能與OHSS體液滲漏相關[33]。提示升高的雌二醇可能通過上調CFTR表達參與OHSS的發生發展。
2.褪黑素及其受體:褪黑素是一種主要由松果體合成和分泌的神經內分泌激素,其他組織器官也可少量合成[34]。褪黑素通過結合并激活兩種膜結合的G蛋白偶聯受體MT1和MT2,從而發揮其生物學功能[35]。研究表明,褪黑素及其受體MT1參與顆粒細胞中LH的下游反應通路[36]。OHSS患者卵泡液中褪黑素、芳香化酶及雌激素水平高于非OHSS患者,且褪黑素水平與VEGF及雌激素水平呈正相關[37]。進一步研究發現褪黑素通過MT2和PI3K/AKT信號通路上調人顆粒細胞中VEGF的表達[38]。MT2選擇性拮抗劑4-P-PDOT阻斷OHSS組大鼠VEGF表達的上調,有利于改善卵巢增大和體重增加的癥狀。以上結果表明褪黑素對人顆粒細胞中VEGF的表達具有促進作用,提示卵巢局部褪黑素高表達和褪黑素上調的VEGF可能與OHSS的發病相關[32],卵泡液中的褪黑素可能是OHSS發生的有效預測因子。
小結,OHSS的發病機制涉及多種分子和信號通路。除傳統觀點中的VEGF、OVRAS等在OHSS的發病中起重要作用外,人顆粒細胞中某些因子或激素也參與OHSS的發生發展,如AEGR、TGF-β1、褪黑素等;與非OHSS患者相比,OHSS患者顆粒細胞內AEGR、TGF-β1、SPRY2等分子表達及褪黑素水平增加,進而通過下游信號通路,上調VEGF、COX-2和雌激素等OHSS相關因子和激素,參與OHSS發生發展,如圖1和圖2所示。
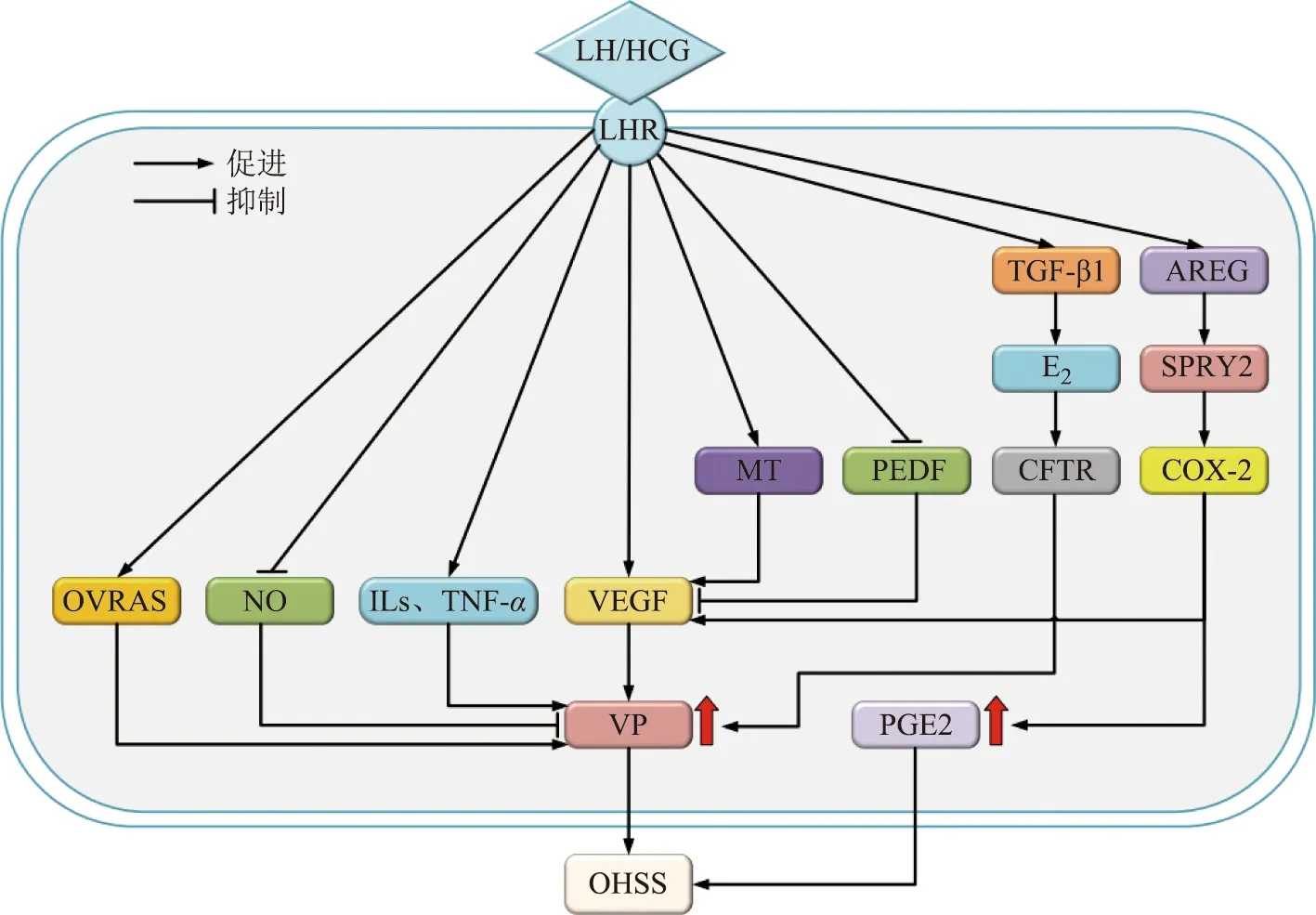
LHR:黃體生成素受體;TGF-β1:轉化生長因子1;AREG:雙調蛋白;E2:雌二醇;SPRY2:Sprouty2;MT:褪黑素;PEDF:色素上皮衍生因子;CFTR:囊性纖維化跨膜傳導調節因子;COX-2:環氧合酶2;OVRAS:卵巢腎素-血管緊張素-醛固酮系統;NO:一氧化氮;ILs:白細胞介素;TNF-α:腫瘤壞死因子α;VEGF:血管內皮生長因子;VP:血管通透性;PGE2:前列腺素E2;OHSS:卵巢過度刺激綜合征。圖1 多種分子及激素參與調節OHSS發生
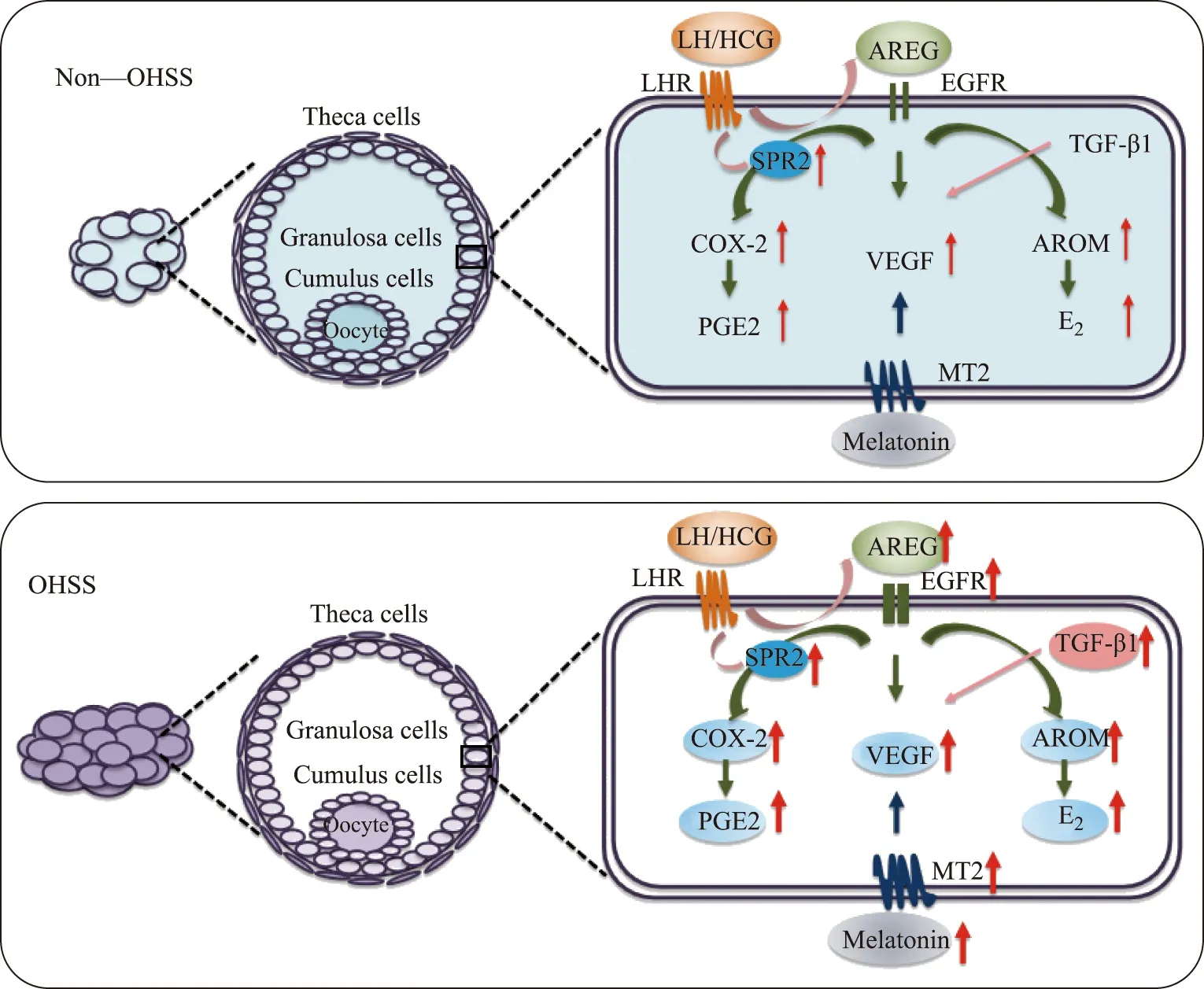
Theca cells:卵泡膜細胞;Granulosa cells:顆粒細胞;Cumulus cells:卵丘細胞;Oocyte:卵母細胞;LH:黃體生成素;HCG:人絨毛膜促性腺激素;LHR:黃體生成素受體;AREG:雙調蛋白;EGFR:表皮生長因子受體;SPR2:Sprouty2;TGF-β1:轉化生長因子1;COX-2:環氧合酶2;VEGF:血管內皮生長因子;AROM:芳香化酶;PGE2:前列腺素E2;Melatonin:褪黑素;MT2:褪黑素受體。圖2 非OHSS患者與OHSS患者顆粒細胞中分子標記物表達的比較
三、OHSS的治療
上述關于OHSS發病機制的研究為預防和治療OHSS提供了新思路。VEGF是OHSS發生發展的關鍵因子,使用藥物來阻斷VEGF和VEGF受體2(VEGFR-2)在卵巢中的過表達可阻止OHSS的發生。但VEGFR-2抑制劑SU5416抑制磷酸化的同時會產生的不良副作用使其不能用于臨床治療。研究表明,多巴胺激動劑卡麥角林可使VEGFR-2去磷酸化,是預防OHSS有效且安全的藥物[39]。但其預防OHSS的用量尚未達成共識,臨床應用受限,安全性以及對妊娠結局的影響尚不清楚。血管緊張素轉換酶抑制劑和血管緊張素轉換酶受體拮抗劑可以阻斷OVRAS,但其對OHSS的防治效果仍不明確[40]。
近年來關于OHSS相關分子及信號通路的研究中也提到了一些預防與治療的新思路。給予OHSS小鼠褪黑素受體拮抗劑盧吲哚[32]或TGF-β1抑制劑SB431542[17],其體重增加和卵巢增大的癥狀均有改善。給予OHSS大鼠MT2選擇性拮抗劑4-P-PDOT后可抑制VEGF高表達,進而改善體重增加和卵巢增大的癥狀[32]。這些動物實驗結果為之后的臨床研究和應用提供了新的方向和依據,在已有的研究基礎上,進一步闡明相關分子促使OHSS發生發展的具體調控機制,對涉及的信號通路或受體深入研究,以期發現OHSS的分子靶標和治療靶點。
四、結論與展望
隨著對OHSS的深入研究,多種分子及信號通路已被證實與OHSS發生發展密切相關,已證實VEGF、COX-2、雌激素等與OHSS病理生理改變息息相關,在HCG/LH的作用下,AREG、TGF-β1、SPRY2等分子標記物表達及褪黑素水平增加,導致上述OHSS相關分子水平升高,這些分子之間通過相應的信號通路構成信號網格共同參與OHSS的發生發展。這為OHSS的早期診斷和精準治療提供了新的方向,一些分子抑制劑及受體拮抗劑能改善OHSS動物的相關癥狀,但其臨床應用的安全性和有效性尚有待于進一步研究。這些研究為探究OHSS的發病機制提供了新的思路和靈感,在此基礎上進行深入研究,可為臨床個性化精準治療提供依據。

