超聲造影在神經內分泌腫瘤分化程度與肝轉移的關聯性中的價值
王渝洲
神經內分泌腫瘤主要來源于神經內分泌細胞,其具有異質性特點。神經內分泌細胞可分散于身體各部位,但臨床上以胰腺、胃、腸等消化系統較為常見[1]。同時,神經內分泌腫瘤多存在轉移情況,其中肝臟為體內常見轉移部位[2]。相關研究顯示,各部位的神經內分泌腫瘤的生物學行為與特點均存在明顯異質性,導致該疾病臨床診斷與治療難度較高,因此深入研究具有重要意義[3]。因超聲檢查具有快捷、方便等優勢,已在神經內分泌腫瘤檢測中得到廣泛應用。但常規超聲檢查神經內分泌腫瘤所得圖像的特異性相對較低,因此,在區別其他腫瘤方面具有一定難度,僅可按照彩色多普勒狀況進行綜合評估,常常會發生誤診、漏診等情況[4]。經注射造影劑后,造影劑可順暢通過腫瘤細胞,進而給予超聲檢查則可捕捉相關圖像,進而有利于區分神經內分泌腫瘤[5]。目前,超聲造影作為一種應用廣泛的影像學檢查方法,在神經內分泌腫瘤肝轉移檢查中可起到實時動態顯示的作用,有助于觀察肝臟內病灶的實際情況[6]。以往相關研究主要關注超聲表現與血管的關聯性,對于超聲造影表現與分化程度之間的關聯性研究較少。本次研究探討神經內分泌腫瘤肝轉移超聲造影表現與分化程度的相關性,現報道如下。
1 資料與方法
1.1 一般資料
回顧性分析2018年1月-2020年1月內江市第二人民醫院接收的神經內分泌腫瘤肝轉移患者54例的臨床資料。納入標準:均接受超聲檢查與免疫組化染色。排除標準:(1)超聲造影圖像質量不高,無法進行分析;(2)未在本院接受超聲檢查;(3)免疫組化染色結果存在缺失情況。所有患者均接受超聲檢查,均由穿刺或者手術病理診斷確診,均接受免疫組化染色(Ki-67指數與CgA染色)。其中男29例,女25例,年齡22~77歲,平均(57.18±10.32)歲。患者自愿參與且簽署檢查知情同意書;經本院倫理委員會批準。
1.2 方法
1.2.1 儀器與造影劑 本次研究所用儀器為超聲診斷儀(GE Logiq E9),探頭頻率為 2.0~4.0 MHz。本次研究所用造影劑為SonoVue(Bracco公司),微泡(磷脂微囊的六氟化硫),直徑與pH分別為2.5 μm與 4.5~7.5。以 5 ml 0.9% 氯化鈉注射液溶解后,每次使用1.5 ml進行造影,以5 mg/ml為濃度,注射方式為肘部靜脈注射。
1.2.2 超聲造影方法 經二維超聲檢查后觀察病灶相關情況(回聲、位置、大小及數目),通過彩超明確體內血供情況,以此做初步判斷;選取典型病灶做二維超聲切面掃查,根據實際情況對聲功率輸出進行適當調節,確保其達到低機械指數狀態(MI低于0.1)。在注射造影劑過程中使用內置計時器,對病灶回聲強度進行觀察;對觀察的病灶進行不同時相記錄,獲取存在診斷意義的時相后對肝臟進行掃查。如存在顯像不充分情況,則等待10 min再次造影。
1.2.3 圖像分析 觀察超聲造影不同時相情況,主要觀察動脈期(5~30 s)、門脈期(31~120 s);將超聲造影動脈期分為高增強、等/環狀/低增強記錄,門脈期增強模式分為高/等增強、低增強記錄,并記錄病灶廓清起始時間。
1.2.4 超聲造影與病理免疫組化指標 參照世界衛生組織對神經內分泌腫瘤的組織學分級標準,以此為依據判斷腫瘤侵襲強度與惡性程度[2]。分別以病理Ki-67為標準分為兩組(≤20%與>20%),以嗜鉻素A(CgA)為標準分為兩組(陰性與陽性),以G分期為標準分為兩組(G1+G2期與G3期),G1通常代表核分裂象數<2個 /10HPF或 Ki-67標記率 <2%;G2通常代表核分裂象數2~10個/10HPF或Ki-67標記率3%~20%;G3通常代表核分裂象數>20個/10HPF或Ki-67標記率>20%。比較各組超聲造影參數。
1.3 統計學處理
2 結果
2.1 病灶相關情況
所有患者均接受超聲檢查,均由穿刺或者手術病理診斷確診,其中手術病理確診33例,穿刺病理確診21例。病灶大小1.2~9.5 cm,平均(3.1±1.2)cm。病灶來源分布:腹膜后2例,消化管25例,肺3例,胰腺24例。病灶單發與多發:其中肝內單發病灶19例,多發病灶35例(2~5個病灶22例,6~10個病灶3例,超過10個病灶10例)。其中30例患者于超聲檢查前接受化療。
2.2 二維超聲表現
本次研究中54例患者總共有238個病灶,經二維超聲檢查后,其中低回聲占比29.8%(71/238),強回聲占比25.2%(60/238),等回聲占比10.9%(26/238),混合回聲占比34.1%(81/238),81個病灶表現為囊實性回聲,如存在肝內多發病灶,則可同時表現為囊實性回聲或實性回聲。
2.3 超聲造影結果
本次研究54例患者均接受超聲造影檢查,結果顯示:其中動脈期呈高增強36例,占比66.7%;呈等增強9例,占比16.7%;呈環狀增強6例,占比11.1%;呈低增強3例,占比5.6%。經統計,門脈期呈高增強或等增強8例,占比14.8%,低增強46例,占比85.2%。在廓清起始時間中,30 s內廓清病灶9例,占比16.7%;31~60 s廓清病灶27例,占比50.0%;61~120 s廓清病灶11例,占比20.4%;超過120 s廓清病灶7例,占比13.0%,見表1。
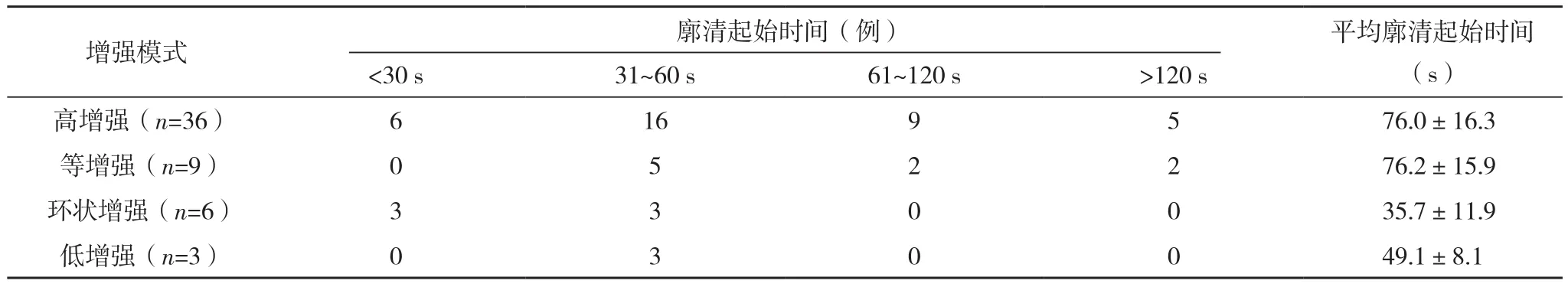
表1 超聲造影動脈期增強模式與廓清起始時間對比
2.4 各組超聲造影參數對比情況
以病理診斷結果為標準,其中Ki-67≤20% 35例,Ki-67>20% 19例;CgA陰性15例,CgA陽性39例;G1+G2期33例,G3期21例。相較于CgA陰性組,CgA陽性組平均廓清起始時間更早,差異有統計學意義(P<0.05);其余各組間病灶大小、單發/多發、平均廓清起始時間、動脈期及門脈期增強模式比較,差異無統計學有意義(P>0.05),見表2、表3、表4。

表2 不同Ki-67組超聲造影參數對比

表3 不同CgA組超聲造影參數對比
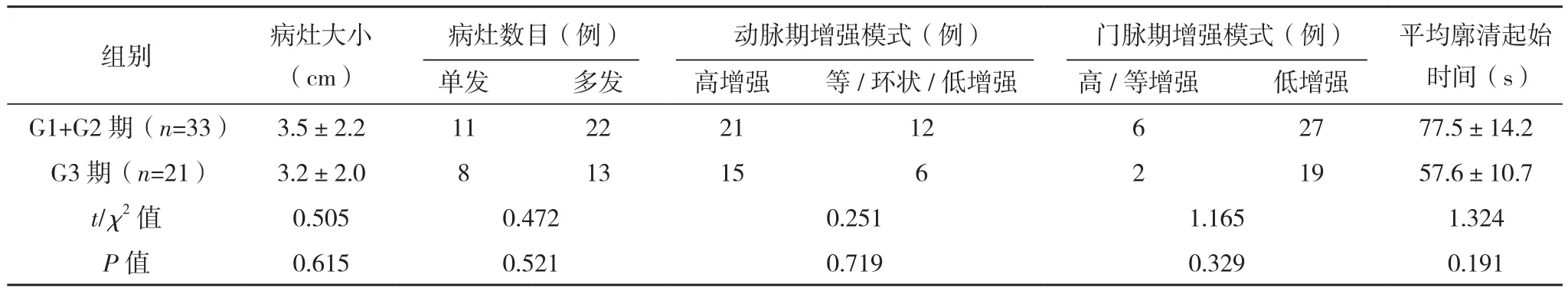
表4 不同G分期組超聲造影參數對比
3 討論
神經內分泌腫瘤臨床上可見于全身各部位,其中多見于消化系統,其占比可達到神經內分泌細胞腫瘤總數的65%左右,再加上近些年神經內分泌腫瘤發病率的升高,目前已經受到廣大醫學從業者的關注[7]。相關資料顯示,肝臟內神經內分泌腫瘤大部分存在轉移性,其占比可達到80%[8]。在超聲檢查中,相較于常規腺癌或者鱗狀上皮癌轉移灶,神經內分泌腫瘤肝轉移典型特征包括分界清晰、均質性回聲、邊緣光滑、囊性較少,可同時存在多種回聲[9-10]。本次研究中,經二維超聲檢查后也存在多樣性,其中,低回聲占比29.8%,強回聲占比25.2%,等回聲占比10.9%,混合回聲占比34.1%;在混合回聲病灶中81個病灶為囊實性回聲。
研究表明,神經內分泌腫瘤肝轉移的超聲造影存在典型性,主要包括動脈期高增強,大部分病灶廓清速度快,小部分病灶存在延遲期強化情況[11]。在以往研究中普遍認為神經內分泌腫瘤肝轉移超聲造影結果,以動脈期高增強為主,經分析可能與腫瘤富血供狀態相關[12]。相關研究結果顯示,肝轉移性神經內分泌癌存在明顯血供特征,同時該特征與原發腫瘤存在明確關聯性[13]。但本次研究受限于樣本量與原發病灶切除,因此無法判斷轉移灶與原發灶之間的關聯性。
研究表明,肝轉移癌超聲造影結果與多種因素存在明確關聯性,同時廓清時間與腫瘤分化程度具有關聯性[14]。在本次研究中,以病理Ki-67為標準分為兩組(≤20%與>20%),再以嗜鉻素A(CgA)為標準分為兩組(陰性與陽性),以G分期為標準分為兩組(G1+G2期與G3期)。相較于CgA陰性,CgA陽性平均廓清起始時間更早,差異有統計學意義(P<0.05)。其余各組間病灶大小、單發/多發、平均廓清起始時間、動脈期及門脈期增強模式比較,差異無統計學意義(P>0.05);上述結果與既往報道存在差異性[15]。經分析原因可能為:肝轉移癌與原發性肝癌血供有差異,其中肝轉移灶動脈血供豐富,可使微泡長期滯留于病灶內,并長期維持高濃度狀態,但對于神經內分泌腫瘤肝轉移分化程度與血供之間的關聯性需進一步探討[16]。總之,本次研究結果與部分文獻[17]報道結果相符,當然,本次研究受限于樣本量,且部分患者接受過化療,因此需適當增加樣本量且排除相關因素后方可證實該結果。
綜上所述,對神經內分泌腫瘤肝轉移實施超聲造影,其中增強模式以高增強為主,病灶廓清時間較晚,對于分化程度之間的關聯性需深入研究。

