穩定表達豬瘟病毒E2蛋白的BHK細胞系的構建
薛 霜,徐 松,鄭 成,徐丹丹,胡玉立,劉國興,李婷婷,石寶蘭,漆世華,謝紅玲
(國藥集團動物保健股份有限公司,武漢430075)
豬瘟是由豬瘟病毒(classical swine fever virus, CSFV)引起豬的一種急性、高度接觸性、致死性的傳染病。該病流行廣泛,發病與死亡率高,一年四季豬不分年齡均可發生,給養豬業造成了嚴重經濟損失。CSFV屬于黃病毒科瘟病毒屬成員,為有囊膜的單股正鏈RNA病毒,基因組長約12.3 kb,由中間一個大的開放閱讀框(open reading frame, ORF)和兩端非編碼區5’-UTR(untranslated region)及3’-UTR構成。ORF編碼一個由3898個氨基酸殘基組成的多聚蛋白,并在翻譯過程中或翻譯后被病毒自身編碼的蛋白酶和宿主細胞的蛋白水解酶加工切割成12種蛋白質[1-3]。其中E2蛋白是CSFV的主要結構蛋白,在CSFV中相對保守,是引起豬產生針對豬瘟保護性抗體的主要抗原,在豬瘟診斷和新型基因工程疫苗的研究上都起著重要作用[4-5]。
據報道,已有多種表達體系對CSFV E2蛋白進行了成功表達。其中原核表達系統具有表達周期快、表達量高、成本低等優勢,但該系統不具有完善的蛋白翻譯修飾功能,表達的E2蛋白與天然蛋白有差異,免疫原性較差,大部分只能用于抗體檢測。CSFV E2蛋白的真核表達系統目前主要有酵母、桿狀病毒及哺乳動物細胞表達系統。其中前兩種表達系統主要優點為蛋白表達量高,但存在表達量不穩定的問題,而且所表達的目的蛋白加工修飾與蛋白本身的天然結構存在差異,如糖基化水平和糖鏈結構的差異導致所表達蛋白的免疫原性及功能活性受到影響。而哺乳動物細胞表達系統的翻譯修飾體系是最為完善的,該系統表達的重組外源蛋白最接近天然構象。目前哺乳動物細胞表達系統大多為貼壁培養細胞,在培養過程中需要加入外源血清,不僅增加了生產成本而且對下游上清中目的蛋白的純化造成影響。本研究選用可無血清懸浮培養的BHK-21細胞,并利用慢病毒包裝系統,建立了能穩定表達CSFV E2蛋白的BHK細胞系,為E2蛋白功能研究及基因工程豬瘟疫苗的研制提供物質基礎。
1 材料與方法
1.1 實驗材料 BHK-21細胞、293T細胞、pCDH-CMV-IRES-EGFP-EF1-Puro質粒由國藥集團動物保健股份有限公司實驗室改造并保存;包裝質粒pMD2.G、psPAX2購自北京擎科生物科技有限公司;Trans-stb13化學感受態細胞購自北京全式金生物公司。
1.2 主要試劑 PrimeSTAR HS DNA聚合酶、DNA片段回收純化試劑盒、質粒小量快速提取試劑盒、CpoⅠ內切酶、NotⅠ內切酶、SolutionⅠ快速連接酶均購自寶生物工程(大連)有限公司;嘌呤霉素購自北京索萊寶科技有限公司;HRP-羊抗小鼠IgG、DAB顯色試劑盒購自武漢博士德生物工程有限公司;CSFV E2單抗由國藥集團動物保健股份有限公司實驗室制備和保存;Ni-IDA親和層析柱購自中科森輝微球技術(蘇州)有限公司。
1.3 重組慢病毒表達載體的構建及慢病毒包裝 參考豬瘟病毒(C株)基因序列,對E2蛋白核苷酸序列進行密碼子優化,同時去除C端跨膜區的34個氨基酸,并在5’和3’端分別引入CpoⅠ和NotⅠ限制性酶切位點,在3’端引入6×His標簽。優化后的CSFV E2基因由北京擎科生物科技有限公司合成。分別用CpoⅠ和NotⅠ限制性內切酶對慢病毒表達載體pCDH-CMV-IRES-EGFP-EF1-Puro和合成的截短E2基因進行雙酶切,膠回收約1061 bp大小的目的片段和8720 bp大小的載體片段,用SolutionⅠ連接酶進行連接,連接產物轉化Trans-stb13感受態細胞,之后挑取陽性菌提取質粒進行雙酶切和測序鑒定,獲得的陽性重組質粒命名為pCDH-E2。將構建的重組慢病毒表達質粒pCDH-E2與包裝質粒pMD2.G、psPAX2共轉染293T細胞進行慢病毒包裝。
1.4 穩定表達E2蛋白的細胞株篩選
1.4.1 細胞感染 準備一塊6孔細胞板,每孔接種1×105~4×105對數期生長的BHK-21貼壁細胞,分別設置空白孔、Control對照慢病毒孔和目的基因慢病毒孔,37 ℃培養過夜,當細胞密度在40%~60%時進行慢病毒感染;根據待感染細胞的 MOI值,分別往細胞中加入適量的Control對照慢病毒和目的慢病毒,混勻后,放入細胞培養箱中繼續培養過夜。
1.4.2 穩定細胞株篩選 12~24 h后,給細胞更換正常的完全培養基,繼續培養 48~72 h后加入終濃度為10 μg/mL的嘌呤霉素進行陽性細胞系的篩選。每2 d更換新的培養基(含10 μg/mL的嘌呤霉素),直到培養皿中不再出現細胞死亡,同時觀察綠色熒光。將藥物篩選后的混合穩定克隆株消化后進行細胞計數,吸取100個細胞接種于10 mL培養基(含10 μg/mL的嘌呤霉素)中,吸打混合均勻后加入96孔細胞板中,100 μL/孔。3~5 d后,在顯微鏡下標出只含有單個細胞克隆的有綠色熒光的細胞孔進行傳代擴增。擴增到合適的細胞量后,進行無血清懸浮培養及蛋白表達,將篩選后的穩定細胞株命名為BHK-LV-E2。
1.4.3 E2蛋白的表達及純化 將傳代至第10代懸浮培養狀態較好(活力>90%)的BHK-LV-E2細胞株按0.6×106/mL初始細胞密度,置于37 ℃恒溫搖床中進行蛋白表達,每天觀察細胞狀態并取樣,將CSFV E2單抗以1∶500倍稀釋作為一抗,辣根過氧化酶標記的山羊抗小鼠IgG抗體1∶1500倍稀釋作為二抗,Western Blot分析E2蛋白的表達情況。收獲第7天的表達樣品,離心取上清進行Ni柱純化,收集純化過程各階段樣品進行SDS-PAGE檢測分析。
2 結果與分析
2.1 重組慢病毒表達載體的鑒定 構建的重組慢病毒表達質粒pCDH-E2經CpoⅠ和NotⅠ雙酶切鑒定顯示,可酶切出一條約1061 bp大小的目的片段和一條約8720 bp大小的載體片段(圖1),同時測序結果也顯示合成的E2基因片段已正確插入表達載體中。
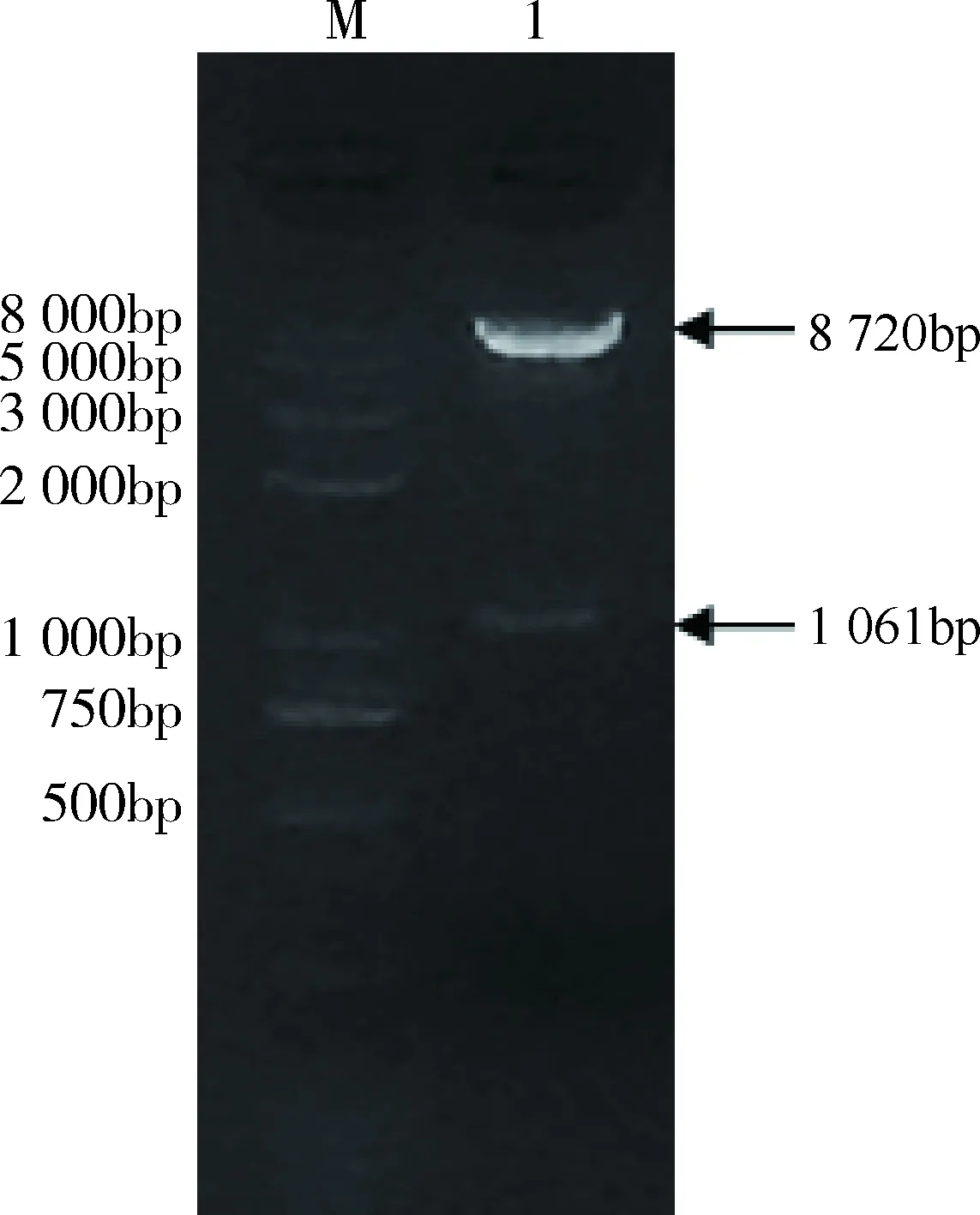
1:重組質粒pCDH-E2的CpoⅠ/NotⅠ雙酶切產物;M:DNA分子量標準1: Enzyme digestion products of pCDH-E2 plasmid by CpoⅠ/NotⅠ; M: DNA Marker
2.2 穩定表達CSFV E2蛋白的細胞株篩選 表達質粒與包裝質粒共轉染293T細胞后,獲得重組慢病毒LV-E2。LV-E2感染BHK-21細胞后采用嘌呤霉素抗性篩選結合有限稀釋法挑取單細胞克隆進行穩定細胞株的篩選。結果顯示,篩選后的細胞形態正常,由于pCDH-CMV-IRES-EGFP-EF1-Puro質粒攜帶綠色熒光蛋白基因EGFP,因此在倒置熒光顯微鏡下細胞顯示綠色熒光(圖2)。將篩選后獲得的陽性克隆進行懸浮擴大培養,取第10代懸浮培養的陽性細胞克隆株進行蛋白表達穩定性鑒定,Western blot分析結果顯示所構建的BHK-LV-E2細胞傳至第10代仍能穩定表達CSFV E2蛋白(圖3)。使用鎳離子親和層析柱對表達的E2蛋白進行純化,結果顯示當洗脫緩沖液中咪唑濃度為500 mmol/L時,可得到較為理想的純化蛋白條帶,且純化后的蛋白純度可達到90%以上(圖4)。
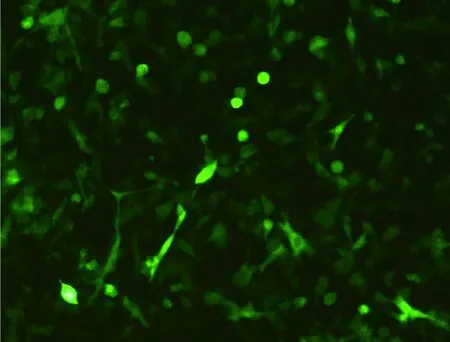
圖2 篩選后的陽性細胞熒光觀察結果(100×)Fig 2 Fluorescence observation results of positive cells(100×)
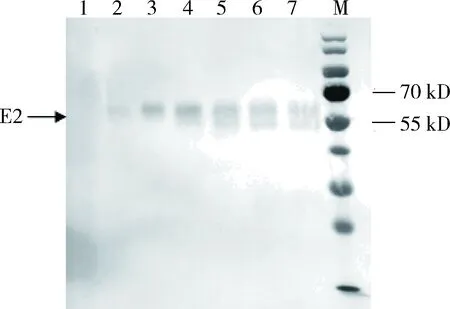
1~7:分別為BHK-LV-E2細胞表達1~7 d樣品;M:蛋白質分子量標準1~7: Samples of BHK-LV-E2 cells expressed for 1~7 days; M: Protein Marker
1:表達樣品原液;2:流穿液;3~5:洗雜液;6~11:目的蛋白洗脫液;M:蛋白質分子量標準1: Original liquid of expression sample; 2: Flow through liquid;3~5: Wash liquid; 6~11: Purified E2 proteins; M: Protein Marker
3 討論與結論
近年來各種病原變異新毒株層出不窮,豬場所使用的疫苗毒株也種類繁多,減毒疫苗和滅活疫苗混用,造成豬場的疫病防控現狀非常復雜。特別是某些已經感染其他病原的豬場免疫減毒活疫苗的時候可能出現多種病原相互協同、相互促進的現象,反而造成豬場疫病的爆發。對于CSFV,傳統的豬瘟減毒活疫苗C株的保護效果有目共睹,但是基于目前豬場復雜的防疫現狀,更為安全的豬瘟滅活疫苗將能更好地滿足目前的疫病防控需求。亞單位疫苗是病毒粒子的一部分,不含有核酸,具有安全性好、穩定性強和無需滅活的優點。E2蛋白是CSFV上最主要的抗原蛋白,能夠誘導中和抗體的產生,具有良好的免疫原性,可制成標記性疫苗通過抗體檢測區分疫苗免疫豬及野毒感染豬,用于豬場凈化評估。因此E2蛋白是研制CSFV新型重組疫苗和抗體檢出方法的重要候選抗原[6-7]。獲得高純度的E2蛋白是研制E2亞單位疫苗的重要基礎。相對于原核表達系統而言,哺乳動物細胞具有翻譯后加工與修飾表達蛋白的能力,表達出的蛋白更接近于病毒天然抗原蛋白結構,且通常可分泌于細胞上清中,有利于目的蛋白的純化[8]。目前,構建穩定表達外源蛋白的細胞系的方法常用的有慢病毒感染與真核表達質粒的轉染。相較于質粒轉染目的細胞的方法,慢病毒表達系統具有構建周期短和高效的表達特性[9-10]。
CSFV E2蛋白屬于跨膜蛋白,為使E2蛋白能夠可溶性的表達于細胞上清中并利于蛋白的進一步純化,本研究將編碼E2蛋白跨膜區的基因刪除后引入了His純化標簽。并且本研究使用的pCDH-CMV-IRES-EGFP-EF1-Puro質粒是經本實驗室改造優化后的一種慢病毒載體質粒,可實現目的基因和篩選標記基因共用一個啟動子高效表達,提高多基因穩定共表達細胞株的篩選效率。因此,通過對綠色熒光的觀察即可評估細胞的抗性篩選效果,并且可以使用流式細胞分選儀將綠色熒光強的細胞分選富集起來,這樣大大加快了篩選高表達目的蛋白單克隆細胞的速度。此外,構建的重組慢病毒表達質粒pCDH-E2含有經真核細胞偏嗜性密碼子優化的編碼CSFV E2蛋白的基因,且在E2基因上游加入了信號肽促進E2蛋白的分泌表達。研究結果顯示,經抗性篩選結合有限稀釋法挑取單細胞克隆進行多輪篩選后,在熒光顯微鏡下觀察,所有細胞都顯示綠色熒光,表明成功篩選出陽性單克隆細胞。本研究選用了適合無血清懸浮培養的BHK-21細胞作為表達細胞,該細胞生長繁殖速度較快,特別適合大規模工業化生產,且表達的E2蛋白是分泌在細胞上清中的,均為加工成熟的蛋白,免疫原性更好。使用無血清的培養基進行懸浮培養,在能夠大批量獲得E2蛋白的同時可避免蛋白純化時的血清干擾,從而提高蛋白純度,節約生產成本。Western bolt檢測第10代細胞的表達,結果顯示E2基因已經整合到宿主細胞的基因組中。應用鎳離子親和層析柱對表達的E2重組蛋白進行了純化,純度可達90%以上。本研究成功構建了可穩定表達CSFV E2蛋白的BHK-LV-E2細胞系,該細胞系表達的E2抗原易于純化,為深入探討 CSFV E2蛋白的生物學特性和CSFV基因工程疫苗研制提供了物質基礎。

