沉默lncRNA RNF185-AS1通過靶向miR-637/HMGA1抑制膠質瘤細胞增殖和侵襲
徐 源,楊 杰,姜健楠,嚴章煒,劉 健,向 欣
作者單位:貴州醫科大學附屬醫院神經外科,貴陽 550004
膠質瘤是發病率最高的中樞神經系統惡性腫瘤,起源于神經外胚層的腦神經膠質細胞[1]。膠質瘤呈現多灶發展,對放療和化療不敏感,且較易復發,因而膠質瘤患者的平均生存期較短,預后很差[2]。探究膠質瘤細胞增殖、侵襲的分子機制對臨床的分子靶向診療可能具有重要價值。長鏈非編碼RNA(lncRNA)是一類沒有蛋白編碼潛能的單鏈RNA,長度通常大于200個核苷酸[3]。研究[4]顯示,lncRNA在膠質瘤組織中高表達或表達缺失,能夠促進或抑制膠質瘤細胞生長、侵襲,發揮癌基因或抑癌基因作用。RNF185-AS1定位于染色體22,是近年來新明確的一個lncRNA,RNF185-AS1在肝細胞癌中表現為癌基因作用,沉默RNF185-AS1能夠抑制肝細胞癌的生長、轉移[5]。RNF185-AS1在膠質瘤中的表達和作用并無相關報道。miR-637是一種抑癌基因,過表達miR-637能夠抑制骨肉瘤、肝癌、卵巢癌等腫瘤細胞的增殖、侵襲[6]。該研究采用小干擾RNA沉默膠質瘤細胞中RNF185-AS1表達,明確其對膠質瘤細胞生長和侵襲的調控功能,探討miR-637在此過程中的作用。
1 材料與方法
1.1 實驗材料人腦星型膠質正常細胞系HEB和人膠質瘤細胞系(SNB-19、LN382、U87MG、U251)購自美國ATCC公司。LipofectamineTM 3000和qRT-PCR試劑盒購自美國Invitrogen公司。DMEM/F12培養基、胎牛血清、RPMI 1640培養基購自美國Gibco公司。pcDNA-sh-Con對照質粒、miR-637 mimic、pcDNA-sh-RNF185-AS1質粒(AACAAGTCAATAATGACGGAGCCTCGAGGTTTAGGGTGGT)、miR-Con mimic、雙熒光素酶報告基因載體(野生型pGL3-WT-RNF185-AS1和突變型pGL3-MUT-RNF185-AS1)購自上海生工生物工程有限公司。Transwell小室、基質膠、MTT試劑盒購自美國Corning公司。雙熒光素酶報告基因試劑盒購自美國Promega公司。一抗兔源HMGA1、β-Tubulin、CDK3、Vimentin、N-Cadherin購自美國BD公司,二抗羊抗兔抗體購自上海碧云天生物科技有限公司。
1.2 生物信息學方法通過GEPIA數據庫在線分析膠質瘤組織和癌旁組織中RNF185-AS1的表達水平。通過linc2GO數據庫在線預測RNF185-AS1的靶基因,RNF185-AS1和miR-637存在互補核苷酸序列。
1.3 細胞培養及轉染采用DMEM/F12培養基分別培養HEB、U87MG、U251細胞,采用RPMI 1640培養基分別培養SNB-19、LN382細胞,均含10%胎牛血清,培養在37 ℃恒溫培養箱。本研究選取對數生長期U251細胞隨機分為:sh-Con組(轉染sh-Con對照質粒)和sh-RNF185-AS1組(sh-RNF185-AS1質粒),根據LipofectamineTM 3000轉染試劑使用說明書進行轉染。
1.4 qRT-PCR檢測RNF185-AS1、miR-637和HMGA1 mRNA表達采用TRIzol法提取腦星型膠質正常細胞系和膠質瘤細胞系總RNA,以逆轉錄后的cDNA為模版進行qRT-PCR反應。引物如下,RNF185-AS1上游引物為5′- GTCACATGTGGGTTT CCCCT-3′,下游引物為5′- AACTGAACAAGCAGCC CTGT-3′;U6上游引物為5′-CTCGCTTCGGCAGCA CA-3′,下游引物為5′-AACGCTTCACGAATTTGCGT-3′;miR-637上游引物為5′-ACUGGGGGCUUUCG GGCUCUGCGU-3′,下游引物為5′-GCAGAGCCCG AAAGCCCCCAGU-3′;GAPDH上游引物為5′- GGATTTGGTCGTATTGGGCG-3′,下游引物為5′- CGGTGCCATGGAATTTGCC-3′;HMGA1上游引物為5′-AGCGAAGTGCCAACACCTAAG-3′,下游引物為5′-GCCCCTTGGTTTCCTTCCT-3′。以2-ΔΔCt法計算RNF185-AS1、miR-637和HMGA1 mRNA相對表達水平,HMGA1 mRNA和RNF185-AS1以GAPDH為內參,miR-637以U6為內參。
1.5 MTT法檢測U251細胞的活力分別將sh-Con組和sh-RNF185-AS1組U251細胞按照150 μl/孔(3×103個)接種到96孔板。分別于接種1、2、3、4、5 d,每孔加入5 g/L的MTT試劑15 μl。培養3.5 h后終止培養,吸去上清液,加入140 μl/孔的二甲基亞砜,震蕩25 min,保證結晶物溶解。酶聯免疫檢測儀波長設定為490 nm,分別測定各孔的吸光度(A)值。
1.6 Transwell侵襲實驗檢測U251細胞侵襲能力分別將sh-Con組和sh-RNF185-AS1組U251細胞采用不含血清的DMEM/F12培養基重懸,將200 μl細胞懸液(3×104個)接種到鋪有基質膠的Transwell上室,加入600 μl含血清的DMEM/F12培養基至Transwell下室,常規培養細胞。24 h后用甲醇固定上室40 min,用0.8%的結晶紫染色40 min,棉簽拭去未穿過基質膠和上室膜上層的U251細胞。倒置顯微鏡下隨機選7個視野,記錄侵襲細胞數。
1.7 雙熒光素酶報告基因檢測將構建的熒光素酶報告基因質粒(野生型WT-RNF185-AS1和突變型MUT-RNF185-AS1)分別與miR-Con或miR-637共轉染至U251細胞,常規培養48 h。按照雙熒光素酶報告基因檢測試劑盒的使用說明書,檢測每個共轉染組U251細胞的相對熒光素酶活性。
1.8 Western blot實驗檢測HMGA1蛋白及相關表型蛋白表達RIPA裂解液提取sh-Con組和sh-RNF185-AS1組蛋白樣品,配制SDS-PAGE凝膠,蛋白上樣電泳。濕式轉膜法轉至硝酸纖維素膜,用封閉液搖床孵育3 h。加入一抗HMGA1(1 ∶1 000)、CDK3(1 ∶2 000)、Vimentin(1 ∶3 000)、N-Cadherin(1 ∶2 000)、β-Tubulin(1 ∶2 000),4 ℃孵育15 h。封閉液洗膜3次,加入二抗(1 ∶5 000),室溫孵育3 h。封閉液洗膜3次,加入電化學顯色試劑,通過凝膠成像儀顯色和拍照。
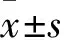
2 結果
2.1 膠質瘤組織和細胞系中RNF185-AS1的表達水平GEPIA數據庫在線分析顯示(圖1),RNF185-AS1在膠質瘤組織中相對表達顯著高于癌旁組織(P<0.01)。qRT-PCR結果顯示(圖2),與HEB細胞相比,膠質瘤細胞中RNF185-AS1表達水平均明顯增加(P<0.01),選取RNF185-AS1表達水平最高的U251進行后續實驗。
2.2 sh-RNF185-AS1質粒的沉默效率qRT-PCR結果顯示,sh-RNF185-AS1組和sh-Con組U251細胞中RNF185-AS1表達分別為(1.17±0.34)和(6.89±0.29),表明沉默RNF185-AS1的膠質瘤細胞系構建成功(P<0.01)。
2.3 沉默RNF185-AS1對U251細胞增殖的影響MTT法檢測顯示(圖3),在接種細胞后2、3、4、5 d,sh-RNF185-AS1組U251細胞增殖活力均顯著低于sh-Con組(P<0.05),提示沉默RNF185-AS1抑制U251細胞的增殖活力。
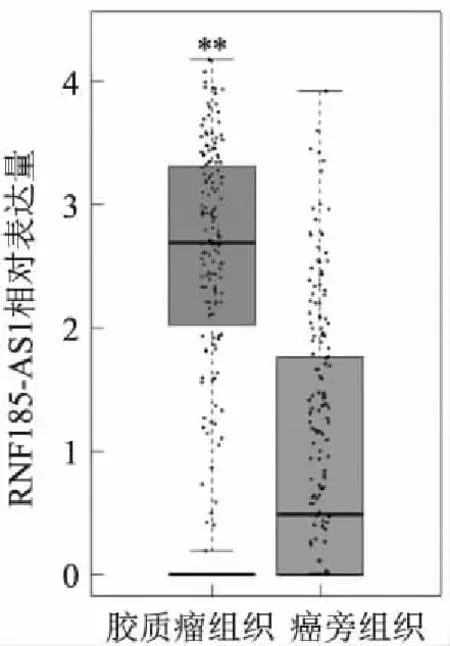
圖1 膠質瘤組織和癌旁組織中RNF185-AS1的相對表達
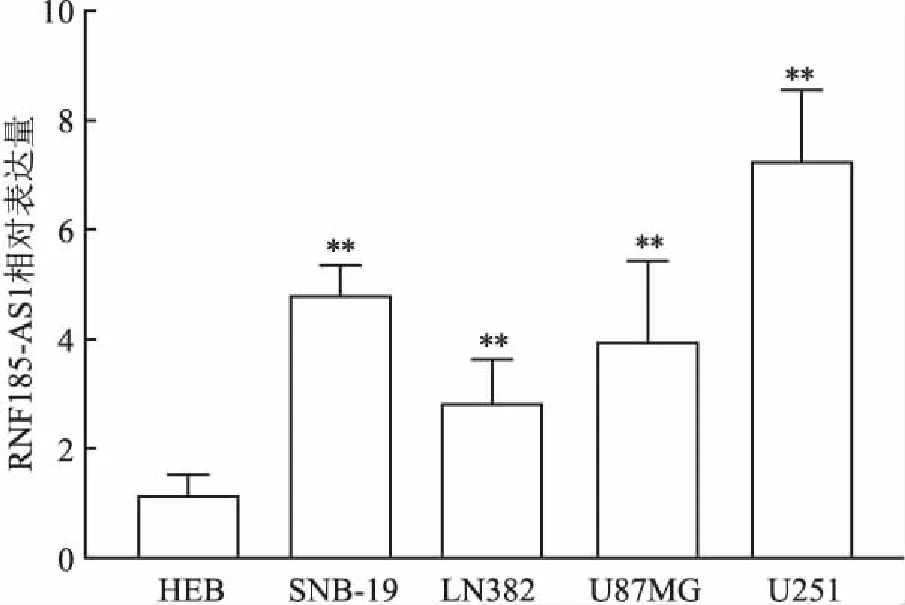
圖2 膠質瘤細胞系和人腦星型膠質正常細胞中RNF185-AS1的相對表達
圖3 沉默RNF185-AS1對U251細胞增殖活力的影響
2.4 沉默RNF185-AS1對U251細胞侵襲的影響Transwell侵襲實驗顯示(圖4),sh-RNF185-AS1組和sh-Con組侵襲細胞數分別為(48.78±12.83)個和(172.81±18.95)個,與sh-Con組相比,sh-RNF185-AS1組侵襲細胞數目顯著減少(P<0.01),提示沉默RNF185-AS1抑制U251細胞的侵襲能力。
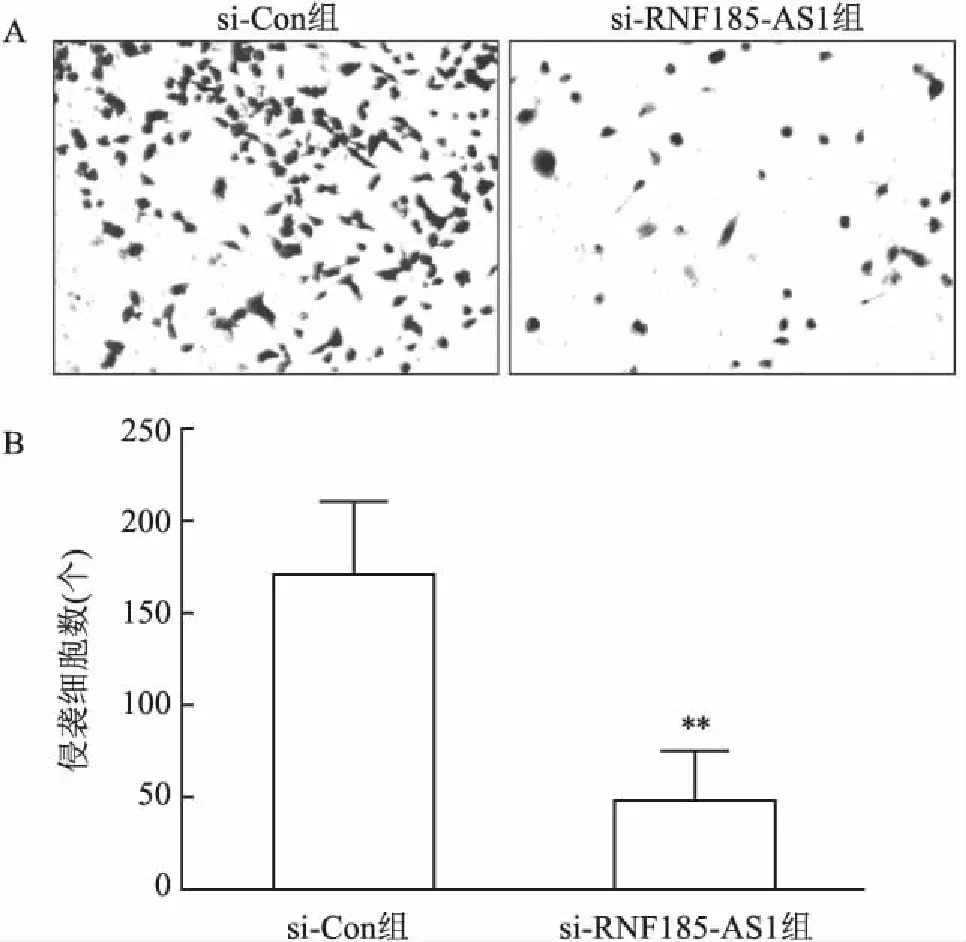
圖4 沉默RNF185-AS1對U251細胞侵襲能力的影響 結晶紫×100
2.5 RNF185-AS1與miR-637的靶向結合作用linc2GO數據庫預測顯示(圖5),RNF185-AS1與miR-637存在部分連續互補的核苷酸序列。雙熒光素酶報告基因檢測顯示(圖6),轉染野生型WT-RNF185-AS1后,miR-637組的相對熒光素酶活性顯著低于miR-Con組(P<0.01),表明RNF185-AS1的靶基因是miR-637。
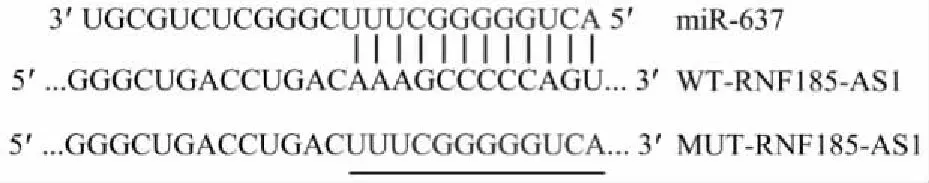
圖5 RNF185-AS1與miR-637特異性互補的核苷酸序列
2.6 沉默RNF185-AS1表達對miR-637和HMGA1 mRNA表達的調控作用qRT-PCR檢測顯示,sh-RNF185-AS1組和sh-Con組U251細胞中miR-637表達分別為(4.73±0.47)和(1.07±0.29),sh-RNF185-AS1組明顯高于sh-Con組(P<0.01)。sh-RNF185-AS1組和sh-Con組U251細胞中HMGA1 mRNA表達分別為(0.99±0.18)和(4.51±0.73),sh-RNF185-AS1組明顯低于sh-Con組(P<0.01),表明沉默RNF185-AS1能夠靶向正調控miR-637表達,抑制HMGA1 mRNA表達。
2.7 沉默RNF185-AS1表達對HMGA1蛋白及相關表型表達的影響Western blot檢測顯示(圖7),沉默RNF185-AS1表達后,HMGA1蛋白表達顯著降低,細胞增殖表型蛋白CDK3表達降低,細胞侵襲表型蛋白Vimentin、N-Cadherin信號通路表達降低,表明U251細胞增殖能力和侵襲能力均降低。
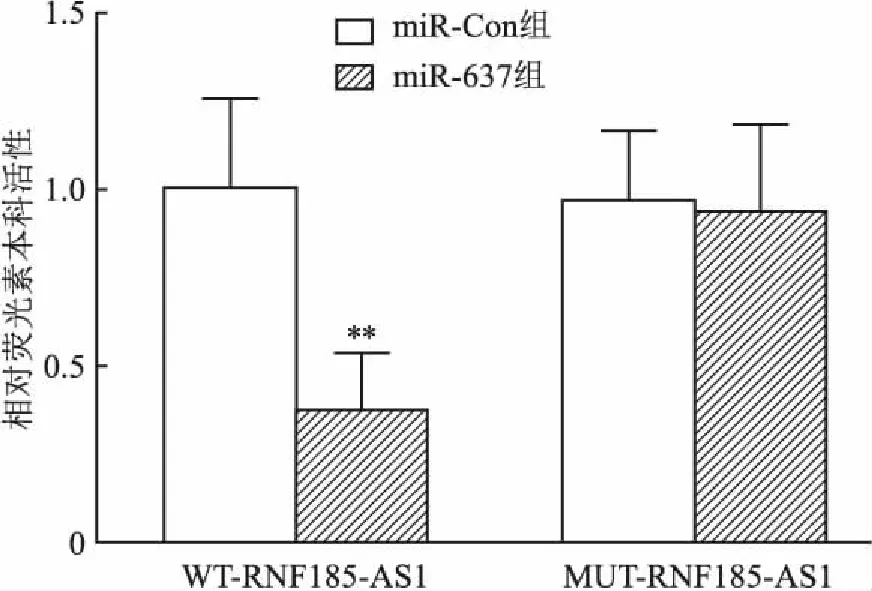
圖6 雙熒光素酶報告基因實驗驗證RNF185-AS1與miR-637的靶向結合
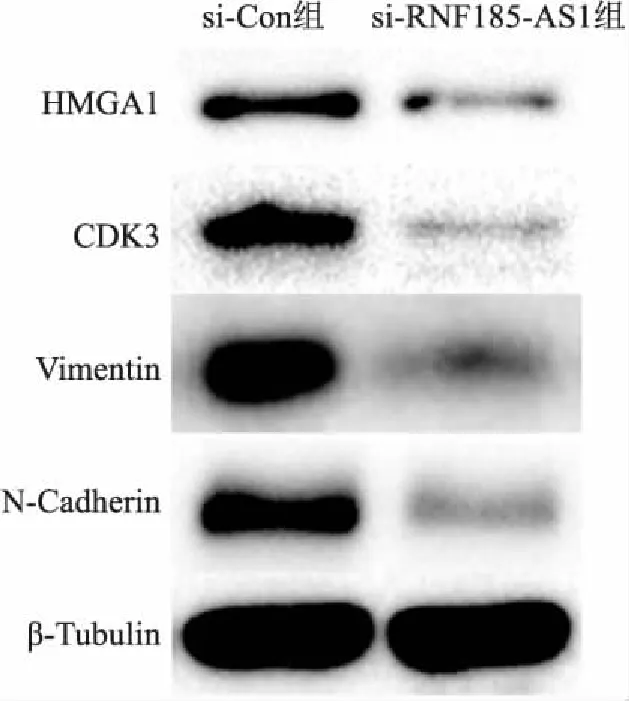
圖7 沉默RNF185-AS1表達對U251細胞HMGA1蛋白及相關表型表達的影響
3 討論
大量研究[7]表明,lncRNA的表達異常與膠質瘤的發生存在顯著相關性,是膠質瘤血管生成、放療抵抗、化療抵抗的標志物。lncRNA參與調節膠質瘤細胞的免疫反應、增殖活性、炎癥反應、鐵死亡等關鍵細胞過程,在膠質瘤中發揮細胞調節因子作用[8]。lncRNA如NFIA-AS2在膠質瘤組織中過度表達,其高表達與膠質瘤患者的不良預后密切相關,可能是無病生存期和總生存期的獨立預后因素[9]。如TTN-AS1在膠質瘤組織和細胞系中表達上調,沉默TTN-AS1表達能夠抑制膠質瘤細胞的增殖、遷移、侵襲并加速細胞的凋亡[10]。RNF185-AS1是一個新型致癌作用的lncRNA,Huang et al[5]研究顯示,RNF185-AS1在肝細胞癌組織和細胞系中高度表達,高水平RNF185-AS1與晚期TNM分期、遠處轉移和較差的總生存率相關,敲低RNF185-AS1通過結合并抑制miR-221-5p,抑制肝細胞癌細胞增殖、遷移和侵襲。本研究顯示,RNF185-AS1在膠質瘤組織和細胞系中高度表達,沉默RNF185-AS1能夠顯著抑制膠質瘤U251細胞的增殖活力和侵襲,表明RNF185-AS1在膠質瘤中發揮致癌基因的作用。
大量研究[11]顯示,lncRNA能夠阻斷微小RNA(miRNA)在膠質瘤發生中的作用,恢復miRNA靶基因功能,從而調控膠質瘤的進展。如lncRNA XIST通過靶向miR-133a促進膠質瘤U251細胞的增殖、遷移、侵襲[12]。如lncRNA GAS5-AS1通過靶向miR-106b-5p抑制膠質瘤U87MG和U251細胞的增殖、遷移、侵襲[13]。本研究通過生物信息學分析顯示,RNF185-AS1可能在膠質瘤細胞中與miR-637互補結合。雙熒光素酶報告基因實驗進一步證實RNF185-AS1能夠互補結合miR-637。研究[14]顯示,miR-637在膠質瘤組織中表達顯著下調,過表達miR-637能夠抑制膠質瘤細胞的增殖和侵襲。本研究通過qRT-PCR結果顯示,沉默RNF185-AS1表達可上調膠質瘤U251細胞中miR-637的表達。以上結果表明,RNF185-AS1直接靶向miR-637抑制膠質瘤的發生發展。高遷移率族蛋白A1(high mobility group A1,HMGA1)是miR-637在膠質瘤細胞中的直接靶基因,miR-637通過抑制HMGA1表達發揮抑癌基因作用[15]。本研究顯示,沉默RNF185-AS1表達后,HMGA1基因表達降低,間接證明RNF185-AS1通過靶向miR-637調節HMGA1基因的表達。

