lncRNA在豬流產相關病毒感染中的作用研究進展
余 鵬,牛曉玉,董 翎,陸夢琪,陳燕虹,李 凡,宋 卉
(華中農業大學動物科技學院/動物醫學院,武漢 430070)
自1989年第一個真核生物調控性lncRNA H19被發現和命名后,便開啟了調控性長鏈非編碼RNA(long noncoding RNA,lncRNA)的相關研究[1]。lncRNA在某些發育階段、組織或疾病狀態中具有非常特異性的表達,因此可作為生物標記物[2]。一些針對與疾病相關的lncRNA的研究表明,與疾病相關的lncRNA可以作為新興的治療靶標來進行藥物的設計和開發。然而,由于在人和實驗動物模型中lncRNA序列之間缺乏保守性以及對lncRNA的功能和機制研究尚處于初期階段,可能會使相關治療方法的開發復雜化[3]。lncRNA是利用多種機制調控哺乳動物穩態和發育的關鍵調控因子,隨著高通量測序技術的發展,越來越多的新lncRNA被發現[4]。隨著畜牧業和生物醫學的發展,對生豬及模型豬的需求越來越大,而豬的繁殖力決定其生產效率,其中與流產相關的病毒感染對于母豬的繁殖效率產生很大影響,如豬繁殖與呼吸綜合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、豬細小病毒(Porcine parvovirus,PPV)、豬瘟病毒(Classical swine fever virus,CSFV)、豬圓環病毒2型(Porcine circovirus type 2,PCV2)等,給養殖業帶來巨大的經濟損失[5]。病毒感染宿主會觸發一系列反應,其中強大的免疫反應對病毒的清除至關重要[6]。以往研究病毒與宿主相互作用的機制主要從宿主或病毒的蛋白質或基因組DNA的角度著手[7],但近十年,隨著lncRNA研究的興起,越來越多的研究數據表明,病毒感染宿主后lncRNA發生了差異性變化并發揮了重要的調控作用[8]。作者主要總結了lncRNA及其與豬流產相關病毒之間的關系、宿主lncRNA與病毒的互作及調控通路、目前存在的問題及應用前景,強調了lncRNA在豬流產相關病毒感染中的重要性,以期為豬的抗病育種、豬流產藥物的開發及相關疾病的靶點治療等提供理論依據。
1 lncRNA概述
1.1 lncRNA的定義和定位
lncRNA是一類轉錄本長度>200 nt、無特異完整的開放閱讀框且無蛋白質編碼能力的RNA分子[9]。隨著測序技術的發展,已經揭示了一些lncRNA能翻譯穩定的功能性小肽(也稱為微肽),且一些lncRNA確實具有小的開放閱讀框(sORF,長度<300 nt),可以編碼具有關鍵生物學功能的短肽[10]。
近年來,RNA的亞細胞定位因為影響許多細胞過程而備受關注,lncRNA作為功能單元,使得其亞細胞定位對其功能影響至關重要[11]。lncRNA在細胞核、細胞質中都有定位,在細胞核中又分為定位在核質其他地方的lncRNA和聚集到特定核體的lncRNA(圖1)。研究表明,lncRNA在細胞內的定位和分布受多種因素決定,包括核糖核酸的核保留元件、核內蛋白因子、高階染色體結構以及RNA-蛋白質與lncRNA轉錄的耦合,但細胞內不同的lncRNA如何轉運到特定的亞細胞區室并執行對基因的調控至今仍不清楚[12]。

圖1 lncRNA在細胞內的定位和分布[12]
1.2 lncRNA的功能機制
lncRNA具有多種重要的功能,它可以局部調節染色質或基因表達,構成細胞核結構域的組成部分[13],對細胞增殖、周期、遷移、侵襲、自噬和凋亡等都有影響[14]。此外,許多疾病與lncRNA有關,如前列腺癌、結腸癌、阿爾茨海默病、心血管疾病和肺癌[15]。lncRNA主要通過與DNA、RNA、染色質、蛋白質互作發揮功能,如編碼功能肽的lncRNA可通過許多不同的方式來調控基因表達和蛋白合成,參與染色質重塑、直接的轉錄調控及轉錄后的調控[16]。
lncRNA功能機制是多種多樣的,包括作為腳手架、誘餌、向導和信號,可以正向或反向調節自身基因的表達,或靶向其他基因,通過與染色質復合物的相互作用來調節染色質的表觀遺傳景觀[17]。作為腳手架時,lncRNA可以對相關的蛋白質或RNA進行識別和結合,使蛋白質或RNA募集到lncRNA上形成相關的復合物,從而調控靶基因[18](圖2A);作為誘餌時,lncRNA可以誘導轉錄因子和其他蛋白質離開染色質或誘導蛋白質因子進入核亞域,從而對靶基因進行調控,此外,lncRNA還會誘使miRNA與其結合,從而影響mRNA的翻譯(圖2B);作為向導分子時,lncRNA可以指導蛋白復合物定位到特定調控位點,對靶基因進行調節(圖2C);作為信號分子時,lncRNA的表達可以忠實地反映轉錄因子或信號通路的組合作用,指示基因在空間和時間上的調控(圖2D)[19]。

A,lncRNA作為腳手架,結合多種蛋白質并且穩定信號復合物,對靶基因進行調控;B,lncRNA作為誘餌,誘導轉錄因子、其他蛋白質和miRNA與其結合,參與轉錄和轉錄后調控,影響靶基因的表達;C,lncRNA作為向導,招募染色質修飾酶到靶基因,進行順式和反式調控靶基因;D,lncRNA作為信號,指示基因在時間和空間上的調控
1.3 lncRNA的研究工具
破譯lncRNA的功能和機制需要相應的研究工具,常用工具見表1。RNA-Seq在過去幾十年發展迅速,能夠生成高質量的深度測序,并在短時間內提供大量信息,能夠對基因表達、可變剪切事件、大規模發現新的轉錄本、單核苷酸變異(single nucleotide variation,SNV)進行預測和功能注釋[20],研究lncRNA的各種微擾策略包括CRISPR干擾(CRISPR interference,CRISPRi)、反義寡核苷酸(antisense oligonucleotides,ASOs)和RNA干擾(RNA interference,RNAi)。dCas9融合到KRAB抑制域,可以定向到特定的基因組位點以阻止轉錄,稱為CRISPRi。CRISPRi允許在不編輯基因組的情況下抑制目標位點,從而避免主動調控元件的無意刪除[21];ASOs是一種反義寡核苷酸,能夠高效消耗細胞核中的lncRNA,已成功用于功能喪失的研究,如lncRNA MALAT1通過此方法提出了抑制乳腺癌進展的潛在療法[22];RNAi是使用小的干擾RNA分子通過觸發其降解來消耗靶轉錄本,在肝癌的研究中發現,牛磺酸上調基因1(taurine upregulated gene 1,TUG1)在肝癌細胞中表達上調,siRNA誘導的TUG1敲低不僅可降低免疫抑制,而且在體內外抑制了腫瘤的進展[23]。

表1 研究lncRNA的常用工具
使用ChIRP-MS和RAP-MS可以鑒定與lncRNA互作的蛋白質。ChIRP-MS是研究內源性核糖核蛋白復合物的一項新技術,它可以用來研究與lncRNA直接結合的蛋白質和擴展的蛋白質網絡[24],而RAP-MS鑒定的蛋白質可能代表與lncRNA直接相互作用的蛋白質[25]。利用交聯和免疫沉淀測序(CLIP-Seq)方法可以鑒定蛋白質與lncRNA結合部位的序列。CLIP-Seq首先用光反應或化學反應交聯RNA和蛋白質;然后在體內捕獲發生相互作用的RNA-蛋白質復合物;最后通過測序鑒定出蛋白質與RNA結合部位的序列,是一種蛋白質對應多種RNA的策略[26]。
lncRNA的功能與其在細胞內的分布有關,但相關的計算預測方法有限,主要包括lncLocator、Loc-lncRNA、Deep lncRNA和新開發的lncLocation[27]。對lncRNA進行定位可以采用熒光原位雜交(fluorescenceinsituhybridization,FISH),FISH已被證明是研究lncRNA定位的一種強大而通用的方法。在這種方法中,熒光反義探針與嵌入細胞的RNA靶雜交,并用熒光顯微鏡觀察。利用此方法,lncRNA MEG3已被證明定位在細胞核中,而一種新型lncRNA CRNG定位在細胞質中[28-29]。
2 lncRNA與幾種豬流產相關病毒的關系
病毒可經母豬的胎盤感染胎兒,幾種豬流產相關的病毒均能夠越過胎盤屏障,然而這些病毒通過胎盤的機制尚不明確[30]。雖然lncRNA與豬流產相關病毒的研究取得一定的進展,但相關的研究仍然處于初期階段。
2.1 lncRNA與PRRSV
PRRSV是一種有包膜的正鏈RNA病毒,屬于動脈病毒科,病毒粒子大致呈球形或橢圓形,直徑為50~60 nm,外觀相對光滑[31]。2017年,Zhang等[32]最早通過RNA測序對PRRSV感染豬肺泡巨噬細胞的lncRNA圖譜進行了全基因組分析,共發現299種lncRNAs在病毒感染后差異表達,且在與病毒感染和免疫反應相關的途徑中富集。Zhang等[33]研究發現,感染PRRSV后的豬子宮內膜上皮細胞的凋亡率明顯高于對照細胞,差異表達的基因和lncRNA譜的整合分析表明,LTCONS_00010766和LTCONS_00045988的靶基因與細胞凋亡信號通路有關。lncRNA與炎癥反應以及病毒誘導的干擾素產生高度相關。Gao等[34]對PRRSV感染豬肺泡巨噬細胞的lncRNA庫分析發現,差異表達的lncRNA在炎癥和病原體感染誘導的途徑中富集,上調的lncRNA主要與NF-κB、Jak-STAT、TNF等信號通路相關,而下調的lncRNA主要在PI3K-Akt、MAPK和趨化因子信號通路中富集。為了探究lncRNA在PRRSV感染增殖中的作用,吳俊靜等[35]基于構建的豬lnc-00649超表達載體和實時熒光定量PCR技術發現,lncRNA能夠抑制PRRSV的復制。進一步探究抑制PRRSV復制的機制,王京煜等[36]研究表明,Marc-145細胞內Wnt/β-catenin信號通路的活性與lncRNA NEAT1中的C4段區域有關,C4段區域增強了信號通路有關轉錄因子的活性,從而使PRRSV的復制下降。此外,Zhang等[37]研究發現,豬肺泡巨噬細胞中的lnc_000397被PRRSV感染后發生了明顯的上調,并通過上調干擾素刺激基因(IFN-stimulated gene,ISG)表達而抑制PRRSV復制。
2.2 lncRNA與PRV
PRV也稱為Aujeszky病病毒(Aujeszky disease virus,ADV),是一種有包膜的雙鏈線性DNA病毒,屬于皰疹病毒科,是一種豬的病原體,但可以感染各種哺乳動物,在全球范圍內造成毀滅性疾病和經濟損失[38]。2018年,Guan等[39]最早開展了PRV的lncRNA研究,PRV不僅可以產生病毒編碼的lncRNA,還可以誘導宿主lncRNA的差異表達,基于高通量測序、Northern blotting和實時熒光定量PCR技術鑒定和驗證了3種病毒lncRNAs和幾種宿主lncRNAs,其中病毒lncRNA LDI可能調節IE180的表達,而IE180是病毒基因的有效轉錄激活劑,此外,病毒lncRNA不僅可以在上皮細胞中表達,而且還可以在受感染的原代雞背根神經節(dorsal root ganglion,DRG)培養物中表達。2020年,Jin等[40]基于RNA-Seq、實時熒光定量PCR、Western blotting技術首次揭示了病毒和gE-TK-PRV-Ⅱ感染細胞中宿主lncRNA的表達譜,將lncA02830進行沉默后發現,干擾素調節因子3(interferon regulatory factor 3,IRF3)、干擾素β(interferon β,IFN-β)和黏液病毒抗性蛋白1(Myxovirus 1,MX1)的轉錄水平均顯著上調,PRV-Ⅱ的復制發生了抑制,這一研究首次從lncRNA的角度對宿主與PRV-Ⅱ相互作用的機制進行了探索。2021年,Fang等[41]基于RNA-Seq、實時熒光定量PCR、間接免疫熒光試驗、敲低和過表達技術發現,lnc_000641是由PRV感染顯著誘導的,對PRV體外復制有深遠影響,通過抑制JAK/STAT1途徑下調IFN-α的產生來抑制對PRV感染的先天免疫應答,從而增加PRV的復制。CTO-S是位于PRV基因組的lncRNA,蘇樂等[42]根據CTO-S的全長序列設計了相關引物并成功構建了CTO-S的缺失株和回復突變株,感染PK-15細胞后發現CTO-S誘導了細胞的凋亡;進一步利用RNA pulldown聯合質譜方法分析發現,病毒的lncRNA-CTO-S與泛醇細胞色素C還原酶的組成部分互作。
2.3 lncRNA與腦心肌炎病毒
腦心肌炎病毒(Encephalomyocarditis virus,EMCV)是一種非包膜單鏈RNA病毒,具有直徑為30 nm的二十面體衣殼。EMCV不僅會引起心肌炎,而且會對許多哺乳動物的神經系統造成破壞,導致母豬在受到病毒感染后發生流產現象[43]。對于EMCV相關的lncRNA,目前只有Nishitsuji等[44]于2016年做過相關研究,結果發現,lncRNA#32的沉默顯著降低了ISG的表達水平,導致細胞對EMCV感染具有敏感性。基于RNA pulldown聯合質譜和RNA免疫沉淀發現,lncRNA#32與核內不均一核糖核蛋白U(heterogeneous nuclear ribonucleoprotein U,hnRNP U)直接結合;使用生物素化的lncRNA#32進行pulldown測定發現,hnRNP U和激活轉錄因子2(activating transcription factor 2,ATF2)是相互作用的蛋白質。lncRNA#32在先天免疫反應中很重要,且在抗病毒免疫中具有重要作用。EMCV是一種對人畜都有危害的重要的病原體,但目前通過lncRNA來研究EMCV和宿主關系的報道很少,還需要進行深入的探索。
2.4 lncRNA與日本腦炎病毒
日本腦炎病毒(Japanese encephalitis virus,JEV)是一種經蚊子傳播的嗜神經性黃病毒,歸類為黃病毒科黃病毒屬,由1個長約10 kb的正義RNA基因組組成。JEV感染對豬的影響最為明顯,易導致豬的流產、死產和出生缺陷等重大生殖問題[45]。2017年,Li等[46]利用微陣列平臺、實時熒光定量PCR、GO功能及KEGG通路分析、lncRNA-mRNA共表達網絡分析的整合進行了基因組學和生物信息學研究,揭示了與JEV感染相關的宿主lncRNA表達模式,表明已鑒定的lncRNA可用作JEV的潛在治療靶點。為了探究JEV介導的炎癥反應,李運川[47]用JEV感染了小鼠的腦組織,對熱圖和火山圖的數據進行分析,并利用實時熒光定量PCR驗證了相關差異表達的lncRNA,其中對lncRNA E52329和N54010進行了干擾,通過Western blotting試驗證明了lncRNA E52329和N54010調控MKK4/7-JNK信號通路中相關轉錄因子的活性。2021年,Zhou等[48]以豬lncRNA-SUSAJ1作為研究目標,實時熒光定量PCR結果顯示,lncRNA-SUSAJ1在感染后36 h顯著增加,但在感染后48 h顯著降低,過表達或敲低lncRNA-SUSAJ1后的數據證實lncRNA-SUSAJ1會使JEV的增殖受到抑制;進一步基于抑制劑的篩選、lncRNA-SUSAJ1啟動子區域的數據庫分析和Western blotting分析證實,CCR1下調SP1的mRNA水平并減少了SP1在lncRNA-SUSAJ1啟動子區域的募集,從而實現對lncRNA-SUSAJ1表達的調控。為了獲得PK-15細胞在受到JEV感染后lncRNA差異表達的數據,朱靜靜等[49]首先利用測序技術獲得了所有發生上調與下調的lncRNA,并通過實時熒光定量PCR驗證了測序結果;隨后通過GO功能及KEGG通路分析發現,先天性免疫反應的相關基因是lncRNA的主要靶基因,這些靶基因富集于100多條信號通路,但主要富集于炎癥和免疫相關的信號通路,為進一步研究lncRNA和JEV的關系提供了理論依據。
2.5 lncRNA與CSFV
CSFV是一種對豬的繁殖有重大危害的病毒,它是一種ssRNA病毒且具有包膜,屬于黃病毒科瘟病毒屬。研究發現,CSFV可以感染多種細胞,包括樹突狀細胞和巨噬細胞,導致養豬業的重大經濟損失。但在CSFV感染的細胞中沒有明顯的細胞病變效應,相反持續的感染會導致宿主免疫抑制[50]。孟星宇[51]利用豬的外周血單個核細胞,通過CSFV感染細胞后獲得的測序結果發現4萬多個新的lncRNAs分子;基于GO功能及KEGG通路分析、敲低或過表達試驗成功篩選出1個新的功能性lncRNAs_2522,當1ncRNAs_2522在細胞內過表達后,它會使2′,5′-寡腺苷酸合成酶2(2′,5′-oligoadenylate synthase 2,OAS2)在細胞內的轉錄水平下降,而OAS2是一種通過干擾素誘導的抗病毒蛋白,它具有抑制CSFV復制的作用[52]。目前關于CSFV復制的研究報道較多,但其發病機制尚不明確,且CSFV相關的lncRNA研究報道較少,lncRNA與CSFV的關系仍有待進一步的研究。
3 宿主lncRNA與病毒的互作及相關調控通路
lncRNA對先天免疫和病毒復制既具有積極影響,又具有消極的影響。有的lncRNA參與抗病毒反應,而有的lncRNA可能對病毒有益[53]。針對病毒的感染,lncRNA參與先天免疫反應和特異性免疫,許多功能性的lncRNA通過調節轉錄因子(transcription factor,TFs)的活性、細胞因子的轉錄或ISG的表達參與抗病毒先天免疫反應[54](圖3)。NF-κB是經過深入研究的促炎轉錄因子之一,其活性失調會導致炎癥及癌癥等許多疾病的發生[55]。
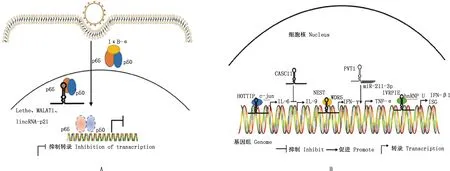
A,Lethe、MALAT1和lincRNA-p21通過與p65直接結合調節促炎轉錄因子NF-κB的活性。B,HOTTIP通過與c-jun結合來促進IL-6的表達;CASC11過表達抑制IL-9的表達;lncRNA NeST反式招募WDR5促使IFN-γ的表達;PVT1通過海綿化miR-211-3p上調TNF-α;IVRPIE通過與hnRNP U的相互作用,調控IFN-β1和幾個ISGs的轉錄
宿主lncRNA作為腳手架、誘餌或翻譯后修飾調節轉錄因子的活性,如Lethe、MALAT1和lincRNA-p21主要位于細胞核,與p65直接結合并阻止p65/p50異源二聚體與靶啟動子結合[56]。lncRNA調控產生的細胞因子包括白介素(interleukin,IL)、IFN-γ和腫瘤壞死因子α(tumor necrosis factor α,TNF-α)[57]。lncRNACASC11是幾種癌癥的癌基因,CASC11基因的過表達導致了血管平滑肌細胞的凋亡率增加和IL-9的下調,而IL-9的激活可能導致大量下游lncRNA的表達改變[58]。lncRNA HOTTIP是評估多種癌癥預后的重要生物標志物,在卵巢癌細胞中,HOTTIP通過與c-jun結合來促進卵巢癌細胞IL-6的表達和分泌,分泌的IL-6通過與癌細胞周圍嗜中性粒細胞表面的IL-6受體結合來刺激PD-L1的表達,從而進一步促進細胞凋亡,導致卵巢癌細胞的免疫逃逸[59]。lncRNA NeST位于小鼠和人的IFN-γ編碼基因附近,核lncRNA NeST主要進行反式作用的調控,它招募WDR5(H3K4甲基轉移酶復合物的組分)以增加IFN-γ編碼DNA的組蛋白3甲基化,然后促進其鄰近基因的轉錄[60]。PVT1是一種促進腫瘤的lncRNA,在調節炎癥方面發揮作用,通過海綿化miR-211-3p上調滑膜細胞中的TNF-α,并誘導軟骨細胞凋亡[61]。甲型流感病毒(Influenza A virus,IAV)感染患者血液免疫細胞后,鑒定出一種新型的lncRNA IVRPIE,參與抗病毒先天免疫。IVRPIE對hnRNP U進行了識別與結合,形成的復合物對IFN-β1和幾個ISG啟動子區的組蛋白進行了修飾,從而調控了IFN-β1和幾個ISG的轉錄[62]。
4 小 結
lncRNA在生物體內發揮著重要的調節功能,在某些發育階段、組織和疾病狀態中發生特異性表達,可以作為生物標記物和新興的治療靶點。研究表明,一些豬流產相關病毒可經胎盤感染胎兒,但機制尚不明確,對lncRNA與豬流產相關病毒關系的研究有望從新的視角揭示病毒經胎盤感染胎兒的作用方式及機制。目前,關于lncRNA與豬流產相關病毒感染的關系已取得了一定進展,但僅有作者介紹的這些豬流產相關病毒涉及lncRNA的研究,且相關研究處于早期階段,通過試驗驗證的功能性lncRNA有限,豬的lncRNA數據庫尚不完整,豬流產病毒感染期間lncRNA介導的抗病毒調節網絡尚不清晰。今后應深入研究lncRNA與豬流產相關病毒的關系,挖掘更多的功能性lncRNA,完善豬的lncRNA數據庫,并詳細闡明豬流產相關病毒感染期間lncRNA介導的抗病毒調節網絡。相信隨著越來越多的功能性lncRNA被挖掘,以及lncRNA介導的抗病毒調節網絡被闡明,lncRNA作為流產相關疾病的診斷標記分子和作為靶點治療的作用將會越來越凸顯。

