基于生物信息學分析CST1基因表達與食管癌的關系
王文逸,史振國,馮俊成,毛旭華
(1.蘇州大學附屬獨墅湖醫院腫瘤內科,江蘇 蘇州 215000;2.江蘇大學附屬宜興醫院心胸外科,江蘇 無錫 214200;3.江蘇大學附屬宜興醫院檢驗科,江蘇 無錫 214200)
食管癌是全球最常見的消化道惡性腫瘤之一[1],我國是食管癌高發地區,其發病率位居惡性腫瘤的第三位,死亡率位居第四位[2],雖然近年來食管癌治療取得了很大進展,但由于大多數食管癌患者確診時已進展至晚期,故其5年生存率,僅有 19%[3-5]。因此,進一步研究食管癌的發病機制并尋找相關標志物顯得尤為重要。CST1基因定位于20p11.21染色體,其編碼一種半胱氨酸蛋白酶抑制劑Cystatin SN,屬于半胱氨酸蛋白酶抑制劑超家族中的2型亞家族[6]。近年來,國內外有大量研究顯示CST1基因與腫瘤發生和發展密切相關[6-8]。但是鮮見CST1基因在食管癌中的研究報道。本研究利用腫瘤基因組圖譜(TCGA)等數據庫,采用生物信息學技術對食管癌組織中CST1基因進行大數據分析,以期為食管癌的發病機制和早期診斷提供進一步的科學依據。
1 資料與方法
1.1資料來源與數據處理:基因分析中常用的數據庫:TCGA(網址:https://portal.gdc.cancer.gov/),癌癥數據在線分析和挖掘數據庫(UALCAN,網址http://ualcan.path.uab.edu)。正常人基因型-組織表達數據庫(Genotype-Tissue Expression,GTEx,網址:https://commonfund.nih.gov/GTex),基因表達譜數據動態分析數據庫(GEPIA,網址:http://gepia.cancer-pku.cn/),人類蛋白質圖譜圖像分類數據庫(HPA,網址:https://www.proteinatlas.org)。
利用GEPIA和 UALCAN數據庫比較不同腫瘤類型TCGA數據庫和GTEx數據庫中腫瘤組織和正常組織數據。采用方差分析,選擇log2(TPM+1)參數對基因表達數據進行轉換。利用HPA數據庫分析CST1蛋白在正常食管鱗狀上皮細胞中的表達。利用UALCAN數據庫對CST1在食管癌不同人種中及在食管癌患者不同臨床病理特征下的表達數據進行分析。利用UALCAN數據庫分析CST1表達對食管癌患者生存期的影響。
1.2細胞系、試劑及儀器:TE-1和 KYSE520人食管癌細胞系購自美國菌種保藏中心(ATCC)。CST1 siRNA兩條序列(按照參考文獻合成[8])及其陰性對照(NC)由廣州銳博公司合成和提供。RPMI-1640、Opti-MEM培養基、胎牛血清和胰蛋白酶(美國Gibco公司)。CCK-8(日本同仁化學研究所)。Lipofectamine3000 轉染試劑、Trizol試劑和10%Bis-Tris預制膠套裝(美國Invitrogen 公司)。Primescript逆轉錄試劑盒(大連寶生物公司)。SYBR?Select Master Mix試劑盒(美國 ABI 公司)。兔抗人CST1多克隆抗體(批號:16025-1-AP,武漢三鷹生物技術有限公司)、兔抗人Cyclin D1多克隆抗體(批號:2978)以及辣根過氧化物酶(HRP)標記的山羊抗兔二抗(批號:7074,美國Cell Signaling公司),兔抗人β-actin多克隆抗體(批號:AP0060,美國Bioword公司)。細胞周期和凋亡檢測試劑盒、RIPA裂解液、BCA蛋白定量試劑盒和ECL發光試劑盒(上海碧云天公司)。酶聯儀(美國Biotek 公司),BD FACSCalibur 流式細胞儀(美國BD公司),NanoDrop 2000 超微量分光光度計(美國Thermo Scientific 公司),ABI 7300 熒光定量PCR儀(美國ABI 公司),Western印跡電泳設備及化學發光成像系統(美國Bio-Rad公司)。
1.3細胞培養:TE-1和 KYSE520細胞系分別給予含10%胎牛血清(FBS)的RPMI-1640培養基,置于37℃、5%CO2、100%飽和濕度的CO2培養箱中常規培養,每3~4天傳代1次,后續實驗取對數生長期細胞。
1.4siRNA細胞轉染:取對數生長期的TE-1和 KYSE520細胞,6孔細胞培養板中每孔接種約2×105個細胞,常規培養24 h后按照Lipofectamine3000說明書進行轉染,實驗分為siNC組(NC siRNA轉染組)、siCST1-1組(CST1 siRNA序列1轉染組) 和siCST1-2組(CST1 siRNA序列2轉染組),每組設4個復孔,其中1復孔轉染24 h 后用于CCK-8檢測;1復孔轉染48 h驗證mRNA 表達;其余復孔轉染72 h分別用于檢測蛋白表達和細胞周期分析。實驗均重復3次。
1.5CCK-8法檢測細胞的增殖活力:取上述1.4中轉染24 h細胞經2.5 g/L胰蛋白酶消化制備成單細胞懸液,96孔細胞培養板中每孔接種2 000個細胞,每組設6個復孔,同時設立空白調零組(僅加培養液)。常規培養0 d、1 d、2 d、3 d、4 d后,按照 CCK-8 試劑盒說明書加入CCK-8,繼續培養1 h后在酶聯儀上測450 nm波長處的吸光度值(A值),OD值=A(細胞組)-A(空白組)。
1.6實時熒光定量RT-PCR檢測mRNA表達:根據 Trizol 試劑說明書提取上述1.4中轉染48 h 細胞(約106個)總RNA,NanoDrop 2000 超微量分光光度計測定總RNA濃度和比值(A260/A280均在1.8~2.0之間),取1 μg RNA,按照逆轉錄試劑盒說明書將RNA逆轉錄為cDNA。按照參考文獻,采用實時熒光定量 PCR 檢測CST1 mRNA表達水平,結果以2-ΔΔCt法計算,公式:ΔΔCt = [(實驗組Ct目的基因/實驗組Ct內參基因) -(對照組Ct目的基因- 對照組Ct內參基因)]。實驗均重復3次。
1.7流式細胞術檢測細胞周期:取1.4中轉染72 h后細胞用2.5 g/L胰蛋白酶消化收集所有細胞,1 000 r/min,5 min;冰浴預冷磷酸鹽緩沖液(PBS)洗1遍后加入1 ml冰浴預冷70%乙醇,輕輕吹打混勻,-20℃固定。固定24 h后按照細胞周期和凋亡試劑盒說明書進行操作上機收集熒光信號并分析。實驗均重復3次。
1.8Western印跡檢測蛋白表達:取上述1.4中轉染72 h細胞(約2×106個),預冷PBS洗2遍加入預冷的RIPA蛋白裂解液冰浴裂解抽提蛋白,4℃,12 000 r/min,15 min;取上清按試劑盒說明書BCA 法測定蛋白濃度,按照預制膠套裝說明書蛋白變性后取15 μl(30 μg)加入10%Bis-Tris預制膠中,200 V電泳40 min,電泳結束后在400 V 恒壓條件下2 h將蛋白質轉至PVDF膜上,5%BSA封閉1 h。分別加入兔抗人CST1抗體(1∶1 000稀釋)、兔抗人Cyclin D1抗體(1∶1 000稀釋)以及兔抗人β-actin 抗體(1∶5 000稀釋),4℃孵育過夜。TBST洗膜3次,加入HRP標記的羊抗兔IgG(1∶5 000稀釋)后室溫下孵育1 h,TBST洗膜5次后ECL化學發光法顯影后經化學發光成像系統曝光檢測目的條帶。實驗均重復3次。
1.9統計學分析:采用GraphPad Prism5.01統計學軟件進行t檢驗及單因素方差分析。
2 結果
2.1CST1在不同腫瘤中的表達:GEPIA數據庫分析結果表明,在33種不同腫瘤類型中,CST1 mRNA在食管癌,膀胱尿路上皮癌,乳腺浸潤癌,結腸腺癌,頭頸部鱗狀細胞癌,肺腺癌,肺鱗癌,卵巢漿液性囊腺癌,胰腺癌,直腸腺癌,胃癌,睪丸癌,子宮內膜癌等13種腫瘤中表達上調。見圖1。GEPIA數據庫和TCGA數據庫分析結果表明CST1在食管癌中顯著高表達(P<0.05)。見圖2。
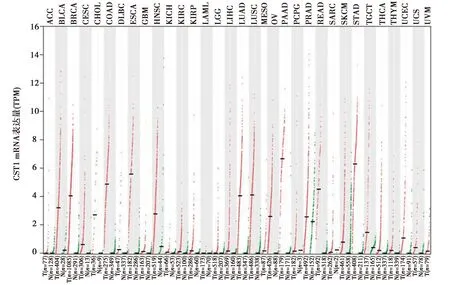
ACC:腎上腺皮質癌;BLCA:膀胱尿路上皮癌;BRCA:乳腺浸潤癌;CESC:宮頸鱗癌和腺癌;CHOL:膽管癌;COAD:結腸腺癌;DLBC:彌漫性大B細胞淋巴瘤;ESCA:食管癌;GBM:多形性膠質母細胞瘤;HNSC:頭頸部鱗狀細胞癌;KICH:腎嫌色細胞癌;KIRC:腎透明細胞癌;KIRP:腎乳頭狀細胞癌;LAML:急性髓細胞樣白血病;LGG:腦低級別膠質瘤;LIHC:肝細胞肝癌;LUAD:肺腺癌;LUSC:肺鱗癌;MESO:間皮瘤;OV:卵巢漿液性囊腺癌;PAAD:胰腺癌;PCPG:嗜鉻細胞瘤和副神經節瘤;PRAD:前列腺癌;READ:直腸腺癌;SARC:肉瘤;SKCM:皮膚黑色素瘤;STAD:胃癌;TGCT:睪丸癌;THCA:甲狀腺癌;THYM:胸腺癌;UCEC:子宮內膜癌;UCS:子宮肉瘤;UVM:葡萄膜黑色素瘤。圖中紅色代表腫瘤組織,綠色代表正常組織對照。T:腫瘤組織,N:正常組織,n:數量。X軸:腫瘤組織和正常組織數量,Y軸:每千個堿基的轉錄每百萬映射讀取的轉錄本log2(TPM+1)圖1 GEPIA數據庫中CST1在不同腫瘤中的表達
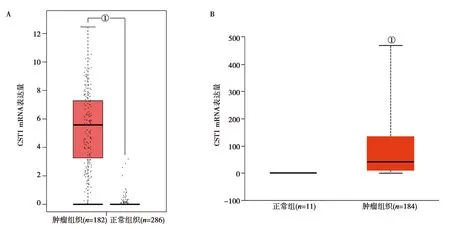
A:GEPIA數據庫中CST1在食管癌中的表達,B:TCGA數據庫中CST1在食管癌中的表達;圖中紅色代表腫瘤組織,黑色代表正常組織對照。X軸:腫瘤組織和正常對照組織數量,Y軸:A圖每千個堿基的轉錄每百萬映射讀取的轉錄本log2(TPM+1);B圖每千個堿基的轉錄每百萬映射讀取的轉錄本,①P<0.05圖2 CST1 mRNA在食管癌中的表達
2.2CST1蛋白在正常食管鱗狀上皮細胞中的表達:HPA數據庫中三種不同抗體(三家不同公司生產的CST1抗體)免疫組化分析結果均顯示,CST1蛋白在正常食管鱗狀上皮細胞中不表達。見圖3。
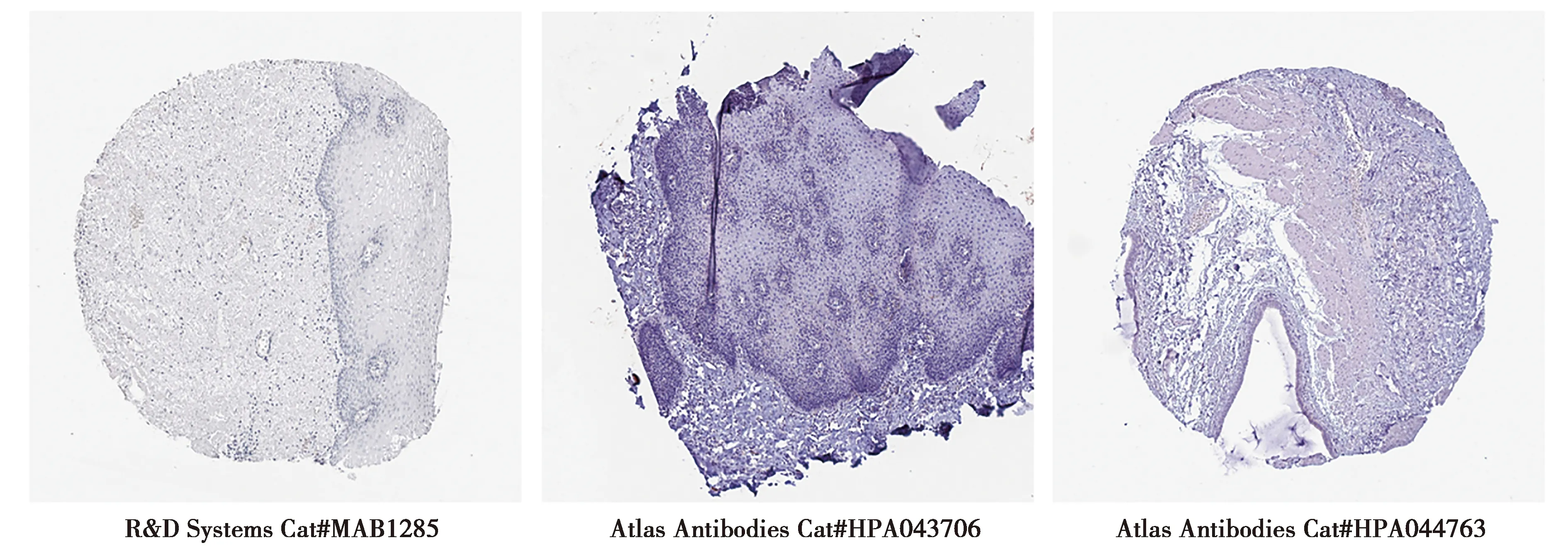
圖3 三家不同公司生產CST1抗體檢測CST1蛋白在正常食管鱗狀上皮細胞中的陰性表達
2.3CST1在不同人種食管癌患者中的表達:UALCAN數據庫分析表明,東亞人群中CST1在食管癌患者腫瘤組織中顯著高表達(P<10-7)。見圖4。
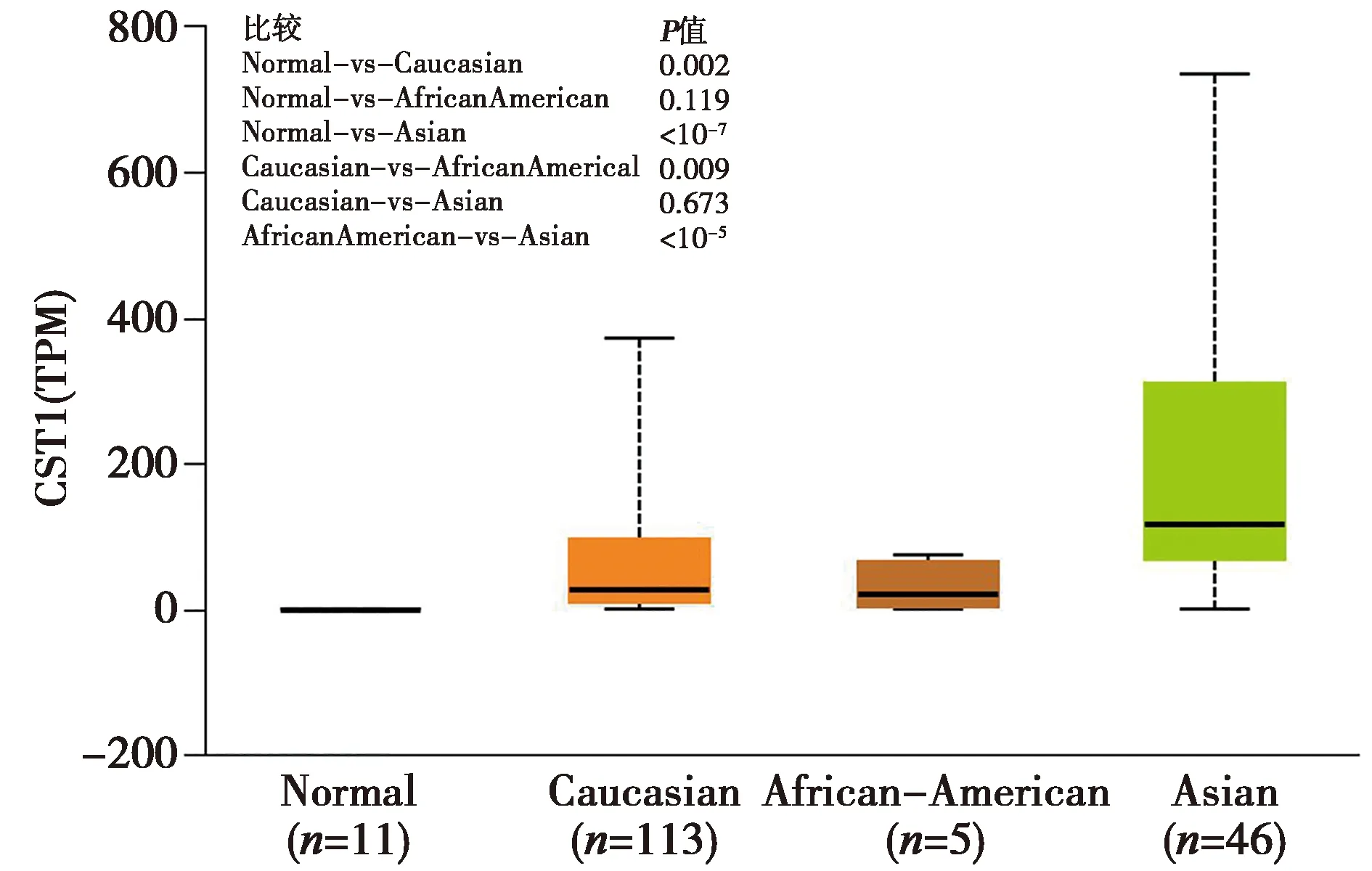
X軸:Normal(正常對照),Caucasian(高加索人),African-American(非洲裔美國人),Asian(亞洲人);Y軸:TPM(每千個堿基的轉錄每百萬映射讀取的轉錄本)圖4 CST1在不同人種食管癌患者中的表達
2.4CST1表達與食管癌患者臨床病理特征的關系:UALCAN數據庫分析表明,CST1在食管腫瘤鱗狀細胞癌和腺癌組織中的表達差異無統計學意義(P>0.05)。見圖5A。食管癌腫瘤分期Ⅱ期,Ⅲ期,Ⅳ期腫瘤組織中CST1與正常組織相比高表達(P<0.05)。見圖5B。腫瘤分級Ⅰ級、Ⅱ級腫瘤組織中CST1與正常組織相比高表達(P<0.05)。見圖5C。淋巴結轉移狀態N1,N2和N3腫瘤組織中CST1與正常組織相比高表達(P<0.05)。見圖5D。

圖5 CST1表達與食管癌患者臨床病理特征的關系
2.5CST1表達對食管癌預后的影響:UALCAN數據庫分析結果表明,CST1高表達的食管癌患者生存期與CST1中低表達的食管癌患者相比,差異無統計學意義(P=0.95)。見圖6A。CST1表達結合腫瘤分級表明,生存期差異有統計學意義(P=0.034)。見圖6B。
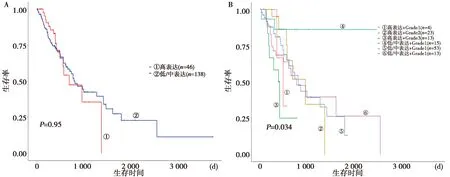
A:CST1表達對食管癌患者生存的影響;B:CST1表達結合腫瘤分級對食管癌患者生存的影響圖6 CST1表達對食管癌預后的影響
2.6siRNA敲低CST1后對食管癌細胞株細胞增殖能力的影響:兩條CST1 siRNA轉染TE-1和 KYSE520細胞后,實時定量PCR檢測結果表明,與siNC組相比siCST1組CST1的表達水平均顯著下調。見圖7A;CCK-8結果顯示在兩株細胞中siCST1-1和siCST1-2組細胞在培養2 d后OD值均低于siNC組,差異均有統計學意義(P<0.01),敲低CST1抑制了細胞的增殖能力。見圖7B,圖7C。

A:實時定量PCR檢測結果;B,C:CCK-8試驗檢測細胞增殖能力;與siNC組相比,①P<0.01圖7 siRNA敲低CST1后對TE-1和 KYSE520細胞增殖能力的影響
2.7siRNA敲低CST1后對食管癌細胞株細胞周期的影響:兩條CST1 siRNA轉染TE-1和 KYSE520細胞后,細胞周期檢測結果表明,與siNC組相比,siCST1-1和siCST1-2組G1期細胞增加,而G2和S期細胞減少。見圖8A、圖8B;Western印跡結果表明,兩株細胞中siCST1-1和siCST1-2組CST1和cyclin D1蛋白表達水平均顯著低于siNC組。見圖8C。以上結果表明siRNA敲低CST1后細胞周期阻滯。
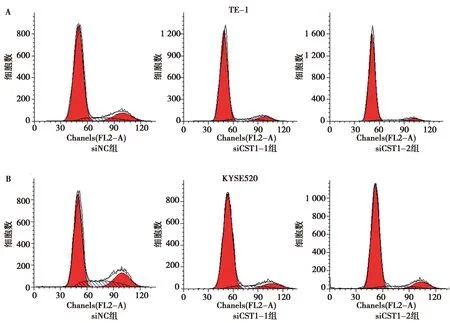
A、B:流式細胞術檢測siRNA轉染后對細胞周期的影響;C:Western印跡檢測CST1、Cyclin D1蛋白結果圖8 siRNA敲低CST1后對TE-1和 KYSE520細胞周期的影響
3 討論
近年來,隨著生物信息學的發展,生物醫學已進入大數據時代。基于數據的獲取積累、匯聚共享及挖掘利用的大數據分析技術在生物醫學的基礎研究和臨床診治中發揮了重大作用。研究者們可以通過TCGA數據庫等平臺高效處理和分析海量基因測序數據,從中獲取高質量的個性化腫瘤基因信息,并測試他們的研究假設[9]。
惡性腫瘤的發生和發展與基因突變、基因異常表達有著密切的關系。研究顯示CST1表達與腫瘤發生和發展以及侵襲轉移密切相關[10]。馮莉等研究[7]指出,CST1在結直腸癌中高表達,且高表達患者生存期縮短,過表達CST1能夠促進結直腸癌細胞增殖、遷移和侵襲。Dai等學者的研究[8]表明,CST1在膀胱癌中高表達,且CST1表達上調的患者復發率高。Choi等學者指出,胃癌中CST1基因高表達,RNA干擾其表達后可降低細胞增殖[11-12]。Dai等學者的研究[8]表明,CST1在乳腺癌組織中高表達,且與乳腺癌患者生存期負相關,CST1過表達可促進乳腺癌細胞的增殖,克隆形成,遷移及侵襲能力。而Chen等學者在食管癌中的研究[13]卻得出不同的結論,CST1在食管癌組織中低表達,而在正常組織中高表達,CST1表達與食管癌患者生存期呈正相關。
本研究從生物信息學角度,利用TCGA等數據庫分析表明CST1在結直腸癌,膀胱癌,胃癌,乳腺癌等腫瘤組織中高表達,這一結果與前述學者的研究一致。但數據庫分析表明CST1在食管癌組織中高表達,東亞人群中CST1在食管癌患者腫瘤組織中顯著高表達。且HPA數據庫中免疫組化分析結果顯示,CST1在正常食管鱗狀上皮細胞中不表達。這些結果均與Chen等學者CST1在食管癌組織中低表達的研究[13]結果相悖,推測可能是樣本選擇偏倚的原因,具體原因需進一步研究。本研究進一步通過細胞生物學實驗證實,敲低CST1抑制了細胞的增殖能力且細胞周期阻滯。
Choi等的研究[11]首次將CST1表達情況與患者pTNM分期結合分析,結果表明胃癌患者的pTNM分期越晚,腫瘤組織內CST1表達越高。同時 CST1 的表達與淋巴結轉移相關。本研究生物信息學分析結果也得到相似結果,同時食管癌患者CST1表達結合腫瘤分級分析,生存期差異有統計學意義。
CST1表達與腫瘤發生和發展以及侵襲轉移之間的機制目前尚不明確。Kim等學者的研究[14]認為CST1可與Cathepsin B競爭性結合CST3,該競爭性結合作用可以抵消CST3對組織蛋白酶的抑制活性,使細胞中組織蛋白酶活性恢復,進而促進腫瘤的發展。而徐湖波等學者的研究[12]認為抑制CST1表達可降低p-STAT3,PCNA,MMP-2和MMP-9的表達,提示CST1基因對結直腸癌細胞生長的影響與下調STAT3信號通路有關。本研究尚未對其機制開展進一步研究。
綜上所述,本研究通過生物信息學技術,對TCGA等數據庫中食管癌患者CST1基因進行分析,表明CST1在食管癌患者中高表達。其表達與臨床病理特征及生存期相關。同時從細胞生物學的角度驗證了敲低CST1抑制了細胞的增殖能力且細胞周期阻滯。CST1表達與食管癌發生和發展以及侵襲轉移之間的機制值得進一步的研究。CST1基因可能是食管癌治療和預后的潛在靶標。

