限制性肝段切除手術的局部治療模式改善結直腸癌術后肝臟寡轉移的預后評價
候玉龍
(佳木斯市中心醫院腫瘤外一科,黑龍江 佳木斯 154002)
結直腸癌屬于消化道惡性腫瘤,具有較高的發病率、致死率,多發生于直腸與乙狀結腸的交界部位,多見于45~80歲的中老年人群[1-2]。大部分結直腸癌患者早期臨床癥狀缺乏特異性,僅表現為大便潛血、消化不良等,疾病確診時基本都發展到了晚期[3-4]。據調查顯示:將近50%的結直腸癌患者在根治性切除術治療后會發生肝轉移(CRLM)[5]。結直腸癌術后肝臟寡轉移極大地降低了患者生存率,縮短了有限生存時間。傳統經肝動脈化療栓塞術(TACE)肝癌治療中取得了一定成效,但不能有效延緩結直腸癌術后肝臟寡轉移患者疾病進展,整體療效不理想。而關于限制性肝段切除手術在結直腸癌患者CRLM治療中的報道較少,臨床療效仍舊存在爭議。本文旨在探究結直腸癌術后肝臟寡轉移治療中限制性肝段切除手術的效果。
1 資料與方法
1.1一般資料:選取本院2018年5月~2021年4月收治的83例結直腸癌術后肝臟寡轉移患者為研究對象,隨機分為對照組(n=42)與觀察組(n=41),對照組男24例,女18例;年齡53~78歲,平均(65.59±6.24)歲;病程7~18個月,平均(12.57±2.67)個月;TNM分期:18例I期、18例II期、6例Ⅲ期;腫瘤直徑2.58~5.42 cm,平均(3.95±1.37)cm;ASA分級:24例I級、18例Ⅱ級;Child分級:20例A級、22例B級;BMI20~29 kg/m2,平均(24.66±1.51)kg/m2;疾病類型:17例結腸癌、25例直腸癌。觀察組男25例,16例;年齡51~79歲,平均(65.52±6.34)歲;病程在5~19個月,平均(12.62±2.74)個月;TNM分期:15例Ⅰ期、20例Ⅱ期、6例Ⅲ期;腫瘤直徑2.62~5.34 cm,平均(3.92±1.42)cm;ASA(美國麻醉醫師協會)分級:25例Ⅰ級、16例Ⅱ級;Child分級:22例A級、19例B級;體重指數(BMI)19~29 kg/m2,平均(24.62±1.54)kg/m2;疾病類型:15例結腸癌、26例直腸癌。兩組一般資料比較,差異無統計學意義(P>0.05)。具有可比性。本研究經醫院倫理委員會批準同意。
診斷標準:均滿足《中國結直腸癌肝轉移診斷和綜合治療指南》[6]中對結直腸癌的診斷標準,均經病理活檢穿刺診斷為結直腸癌。
納入標準:①年齡>18周歲,男、女不限。②ASA分級在Ⅰ級~Ⅱ級。③臨床資料齊全、完整。④Child分級在A級~B級。⑤對答切題、意識清醒。⑥預計生存期在3個月以上。⑦臨床資料齊全、完整。⑧KPS(卡氏評分)≥80分。⑨均簽署知情同意書。
排除標準:①合并貧血、免疫功能低下者。②中途轉院、退出者。③合并急、慢性感染性疾病者。④合并腸梗阻、消化道出血等疾病者。⑤既往存在腹部手術史者。⑥重大臟器衰竭、功能障礙者。⑦入組前1個月服用過胃腸激素、胃腸動力藥物者。⑧合并艾滋病、梅毒等疾病者。
1.2方法:對照組:在超聲或者CT引導下,經皮將射頻針刺入,消融病灶5~10 mm,經肝動脈化療栓塞術(TACE)通過經股動脈置管,結合病灶分布情況確定肝動脈分支,通過造影劑定位之后,將40~60 mg吡喃阿霉素、6~12 mg絲裂霉素經導管灌注注入后,以淀粉微球或者碘油栓塞。
觀察組:全身麻醉,常規消毒術區,對于病灶直徑在3 cm的患者,切除該部位肝段,如果跨越相鄰肝段,則切除相應段以及亞段。如果病灶之間的距離在2 cm以下,則將相應肝段切除即可,如果是單個病灶,病灶與包膜之間的距離在2 cm以下,則楔形切除局部組織。腹腔鏡或者開腹手術開展之前,均應通過超聲定位肝靜脈、腫瘤位置,確定切肝平面,對于擬切除Ⅷ段或者Ⅴ段的患者,應緊貼肝中靜脈劈離肝實質,在下方尋找、結扎Glisson鞘,對于擬切除Ⅶ段、Ⅵ段的患者,則沿著肝右靜脈走行劈離肝實質,在下方尋找、結扎Glisson鞘,對于擬切除Ⅳa以及Ⅳb的患者,則沿著鐮狀韌帶的右側,將相應肝段Glisson鞘逐漸切斷,對于擬切除Ⅱ段、Ⅲ段的患者,則沿著肝圓韌帶左側結扎相應肝段Glisson鞘,在結扎Glisson鞘的同時,仔細觀察,切除范圍必須包括整個腫瘤范圍,沿著缺血線切斷,對于腫瘤推擠或者相鄰血管壁的患者,則沿著血管壁進行剝離,將病灶楔形切除之后,進行超聲定位,切除范圍必須超出腫瘤1 mm以上,切除病灶之后,再次進行超聲檢查,對殘余肝臟進行掃描,確認無殘留病灶。
1.3觀察指標及評價標準:兩組均在治療1周后比較以下指標:①臨床總有效率:病灶全部消失,連續4周以上未出現新病灶為完全緩解(CR);病灶最長徑總和比治療前縮小50%以上(包括50%),連續4周以上沒有出現新病灶為部分緩解(PR);病灶最長徑總和比治療前縮小25%~50%,連續4周以上未出現新病灶為穩定(SD);病灶最長徑總和比治療前增大25%(包括25%)為進展(PD)[7]。總有效率=(CR例數+PR例數)/總例數×100%。②血清腫瘤標志物:抽取患者5 ml空腹靜脈血,通過2 800 r/min離心速率、10 cm離心半徑,進行10 min離心處理,以ELISA法檢測糖類抗原242(CA242)、糖類抗原199(CA199)、癌胚抗原(CEA),試劑盒均由上海透景生命科技股份有限公司提供,一切操作謹遵相關說明書完成。③6個月內生存率:對所有患者隨訪6個月,統計生存率。④WHOQOL-BREF(世界衛生組織生存質量測定量表簡表)評分:包括個人信仰/宗教/精神世界、環境、社會、心理、獨立、生理6部分,生活質量越高,最終計分越高[8]。
1.4統計學方法:采用SPSS26.0統計學軟件進行t檢驗與χ2檢驗,若單元格期望頻數<5,采用連續校正檢驗。
2 結果
2.1兩組臨床總有效率比較:觀察組臨床總有效率高于對照組,差異有統計學意義(P<0.05)。見表1。

表1 兩組臨床總有效率比較[n(%)]
2.2兩組血清腫瘤標志物比較:觀察組治療前血清CA242、CA199、CEA與對照組比較,差異無統計學意義(P>0.05);觀察組治療后均低于對照組,差異有統計學意義(P<0.05)。見表2。
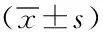
表2 兩組血清腫瘤標志物比較
2.3兩組6個月內生存率比較:觀察組6個月內生存率高于對照組,差異有統計學意義(P<0.05)。見表3。

表3 兩組6個月內生存率比較[n(%)]
2.4兩組WHOQOL-BREF評分比較:觀察組治療前WHOQOL-BREF評分與對照組比較,差異無統計學意義(P>0.05);觀察組治療后均高于對照組,差異有統計學意義(P<0.05)。見表4。
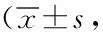
表4 兩組WHOQOL-BREF評分比較分)
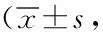
續表4 兩組WHOQOL-BREF評分比較分)
3 討論
臨床研究表明:血吸蟲病、消化系統疾病、亞硝胺等致癌物質、家族遺傳、飲食不當、環境污染、缺乏運動、吸煙嗜酒等均為誘發結直腸癌的危險因素[9]。結直腸癌患者普遍存在直腸腫塊、腹部腫塊、腹痛、排便性狀、習慣改變等,隨著疾病的進展、加重,患者會發生腸穿孔、腫瘤阻塞、貧血等并發癥,嚴重影響了患者身心健康狀況[10-11]。目前,臨床對于結直腸癌主要采取根治性切除術治療,該術式具有創傷性小、疼痛輕、恢復快、并發癥少等優點,已逐漸取代了開腹手術[12-13]。據調查顯示:結直腸癌的切除率高,預后普遍較好,但根治性切除術后將近50%的患者會出現CRLM,CRLM的發生是導致結直腸癌患者死亡的重要原因之一[14-15]。因此,積極治療結直腸癌患者術后CRLM成為延長患者生存期,降低死亡率的關鍵。
結直腸癌在癌細胞增殖過程中,會產生、釋放出大量的生化物質,即血清腫瘤標志物[16]。CA242與CA199、CEA相比較,在結直腸癌臨床診斷、療效評估、預后觀察中具有更高的特異度、靈敏度[17]。CA199屬于低聚糖類抗原,在胃癌、宮頸癌、肺癌等多種惡性腫瘤中血清濃度較高,結直腸癌患者機體血清CA199濃度顯著高于健康人群[18]。CEA是結直腸癌患者機體中存在的一種酸性糖蛋白,隨著病情的進展,血清CEA濃度會顯著增高[19-20]。結直腸癌患者機體血清CA242、CA199、CEA濃度會隨著TNM分期的升高而升高,與患者病情嚴重程度呈正相關。本研究表明限制性肝段切除手術在結直腸癌術后肝臟寡轉移治療中應用效果顯著。原因可能為傳統非手術治療以TACE為主,雖然具有抑制腫瘤病灶生長的作用,但并不能有效降低患者生存率,整體治療效果存在一定的局限性。限制性肝段切除手術結合患者病灶分布、位置以及大小情況,設計個性化的手術治療方案,逐級切除病灶相應部位以及亞段Glisson鞘,切除的同時仔細觀察病灶范圍與肝缺血線之間的吻合情況,確定最終肝臟切除平面,即便是病灶較大并且位于左外葉,只需要擴大切除部分即可,盡可能地切除肝左外葉,這樣不僅提高了病灶切除的精準率,確保無瘤肝臟,還可以最大限度地保證切除范圍的血供,因此限制性肝段切除手術與非手術治療方案相比,極大地提高了結直腸癌術后肝臟寡轉移患者近期臨床總有效率以及遠期存活率。
綜上所述,結直腸癌術后肝臟寡轉移患者采納限制性肝段切除手術治療,可有效縮小病灶,降低血清腫瘤標志物水平,提高生存率及生存質量。
本研究存在一定不足,如研究時限較短、樣本容量較小,影響了結果的普遍性、一般性,因此仍需臨床延長研究時限、擴大樣本容量,為評估結直腸癌術后肝臟寡轉移患者限制性肝段切除手術治療中的有效性、安全性提供更多參考依據。

