高遷移率族蛋白B1 在重型創傷性顱腦損傷患者腸黏膜屏障功能損傷發生機制中的作用研究
孫旭日 趙彥萍 劉霞 吳玲 唐恩波 杜春紅
創傷性顱腦損傷(traumatic brain injury,TBI)患者常合并腸黏膜屏障功能損傷,使得腸源性毒素和細菌易位,導致腸源性感染,誘發全身炎癥反應,甚至導致多器官功能障礙[1-3],但TBI 出現腸黏膜屏障功能損傷的機制并未完全闡明。近年來研究發現[4-6],高遷移率族蛋白B1(high mobility group box-1 protein,HMGB1)在炎癥反應中扮演著重要角色,其與腸黏膜屏障功能損傷的相關研究也逐漸引起關注。為此,本實驗通過測定重型TBI 患者不同時間血HMGB1 水平及相關炎癥反應指標、腸黏膜屏障功能指標,分析重型TBI 血HMGB1 水平與炎癥反應指標及腸黏膜屏障功能指標的相關性,初步探討HMGB1 在重型TBI 患者腸道黏膜屏障功能損傷發生機制中的作用。
1 資料與方法
1.1 一般資料 選取昌吉州中醫醫院2017 年9 月~2018 年8 月收治的30 例重型TBI 患者作為觀察組,另選取同期30 例健康體檢者作為對照組。觀察組男17 例,女13 例;年齡28~77 歲,平均年齡(55.03±13.98)歲;格拉斯哥昏迷量表(GCS)評分3~8 分,平均GCS 評分(6.17±1.53)分。對照組男18 例,女12 例;年齡27~77 歲,平均年齡(53.67±15.23)歲。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。所有研究對象臨床資料完整。觀察組納入標準[7]:①經顱腦CT 證實為創傷性顱腦損傷;②年齡>20 歲;③入院前無感染征象;④單純顱腦外傷(GCS 評分<9 分)。排除標準[8]:①嚴重復合傷患者;②入院前存在其他臟器衰竭;③有免疫缺陷疾病;④兒童和80 歲以上的老年患者。對照組納入標準:年齡20~80 歲,無基礎疾病。本項目經昌吉州中醫醫院倫理委員會同意,并征得患者家屬及健康體檢者知情同意。
1.2 方法 觀察組在給予脫水降顱壓、維持水電解質平衡等綜合治療期間采用GCS 評價昏迷嚴重程度,分別在傷后6、24、48 h 抽取外周靜脈血標本3 ml。對照組于健康體檢時抽血留取外周靜脈血標本3 ml。血樣標本分別轉入生化管及去熱源肝素化處理的內毒素專用試管,離心機3000 r/min 離心分離上清液,留取上清液-70℃保存備用,集中行ELISA 檢測HMGB1、TNF-α、IL-1β、IL-6、DAO、D-Lac 及LPS 水平。主要試劑與儀器:人HMGB1、TNF-α、IL-1β、IL-6、DAO、D-Lac 及LPS 的ELISA 檢測試劑盒(上海康朗生物公司提供)、酶聯免疫反應加速儀(NY/MMJ)、MB580 酶標儀(Heales)、恒溫水箱(WSZ-261-71)、離心機。根據上海康朗公司提供的ELISA 試劑盒說明書實驗步驟進行,MB580 酶標儀(Heales)自動分析,讀取檢測結果。
1.3 觀察指標 ①比較觀察組傷后6 h 與對照組腸黏膜屏障功能指標(DAO、D-Lac 及LPS)及血清炎癥反應指標(HMGB1、TNF-α、IL-1β、IL-6)。②比較觀察組傷后6、24、48 h 腸黏膜屏障功能指標和血清炎癥反應指標。③分析重型TBI 患者傷后6 h 血清HMGB1 與TNF-α、IL-1β 及IL-6 的相關性 。④分析重型TBI 患者傷后6 h 血清HMGB1 與DAO、D-Lac及LPS 的相關性。
1.4 統計學方法 采用SPSS22.0 統計學軟件進行數據統計分析。計量資料以均數±標準差 ()表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗;相關性采用Pearson 相關檢驗。P<0.05 表示差異具有統計學意義。
2 結果
2.1 觀察組傷后6 h 與對照組腸黏膜屏障功能指標比較 觀察組傷后6 h DAO、D-Lac 及LPS 水平均高于對照組,差異具有統計學意義(P<0.05)。見表1。
表1 觀察組傷后6 h 與對照組腸黏膜屏障功能指標比較()

表1 觀察組傷后6 h 與對照組腸黏膜屏障功能指標比較()
注:與對照組比較,aP<0.05
2.2 觀察組傷后6、24、48 h 腸黏膜屏障功能指標比較 觀察組傷后24 及48 h DAO、D-Lac、LPS 水平均高于傷后6 h,差異具有統計學意義(P<0.05);觀察組傷后24 h 與48 h DAO、D-Lac、LPS 水平比較,差異無統計學意義(P>0.05)。見表2。
表2 觀察組傷后6、24、48 h 腸黏膜屏障功能指標比較(,n=30)

表2 觀察組傷后6、24、48 h 腸黏膜屏障功能指標比較(,n=30)
注:與傷后6 h 比較,aP<0.05
2.3 觀察組傷后6 h 與對照組血清炎癥反應指標比較觀察組傷后6 h HMGB1、TNF-α、IL-1β 及IL-6 水平均高于對照組,差異具有統計學意義(P<0.05)。見表3。
表3 觀察組傷后6 h 與對照組血清炎癥反應指標比較()

表3 觀察組傷后6 h 與對照組血清炎癥反應指標比較()
注:與對照組比較,aP<0.05
2.4 觀察組傷后6、24、48 h 血清炎癥反應指標比較觀察組傷后24 及48 h HMGB1、TNF-α、IL-1β、IL-6水平均高于傷后6 h,差異具有統計學意義(P<0.05);觀察組傷后24 h 與48 h HMGB1、TNF-α、IL-1β、IL-6水平比較,差異無統計學意義(P>0.05)。見表4。
表4 觀察組傷后6、24、48 h 血清炎癥反應指標比較(,n=30)
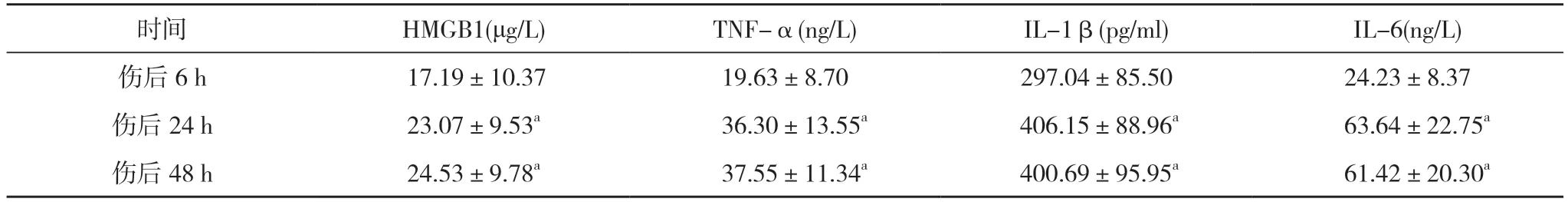
表4 觀察組傷后6、24、48 h 血清炎癥反應指標比較(,n=30)
注:與傷后6 h 比較,aP<0.05
2.5 重型TBI 患者傷后6 h 血清HMGB1 與TNF-α、IL-1β 及IL-6 的相關性分析 重型TBI 患者傷后6 h血清HMGB1 與TNF-α 呈正相關(r=0.597,P<0.05)(見圖1),與IL-1β 無相關性(r=0.210,P>0.05)(見圖2),與IL-6 呈正相關(r=0.651,P<0.05)(見圖3)。
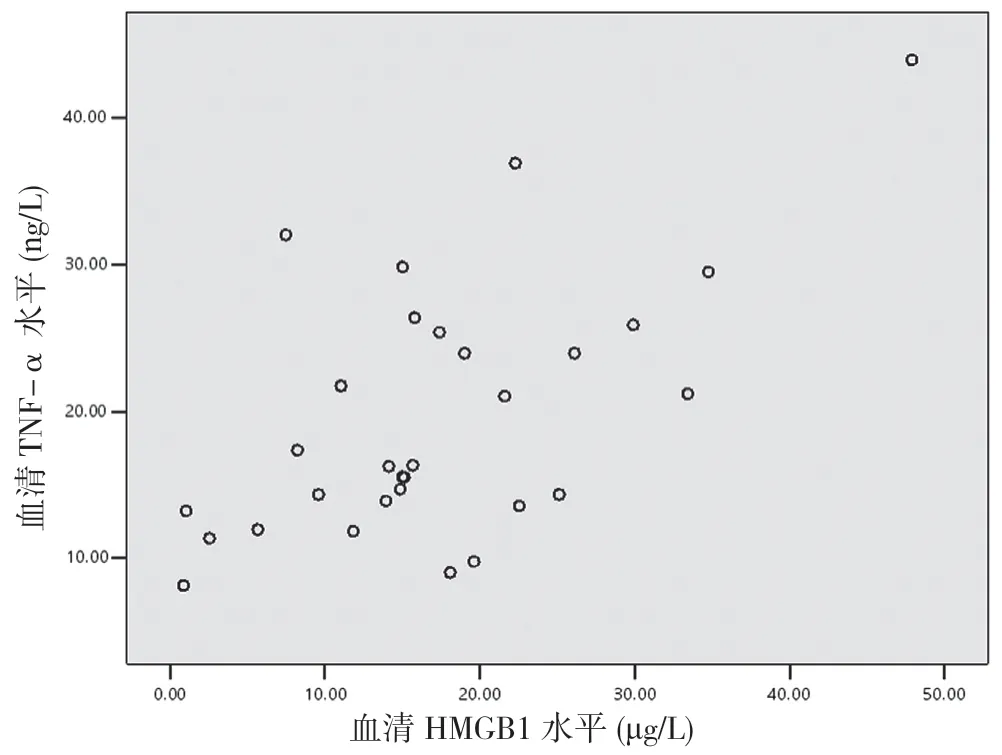
圖1 重型TBI 患者血清HMGB1 水平與TNF-α 相關性分析
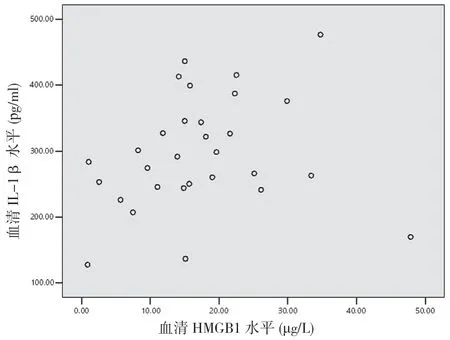
圖2 重型TBI 患者血清HMGB1 水平與IL-1β 相關性分析
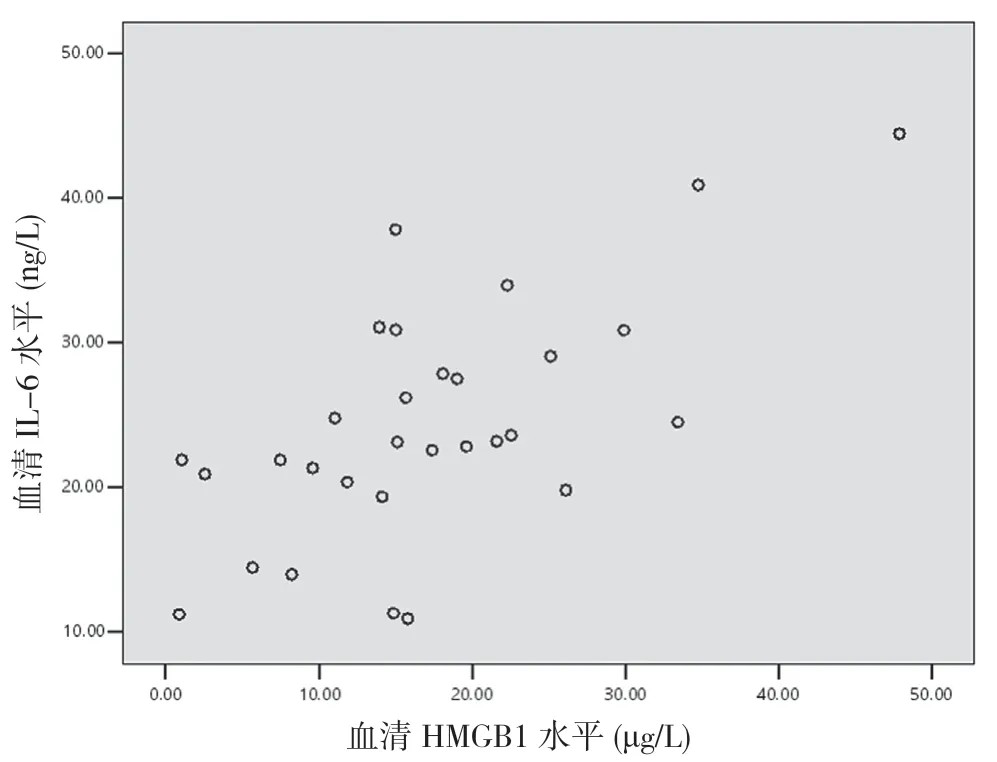
圖3 重型TBI 患者血清HMGB1 水平與IL-6 相關性分析
2.6 重型TBI 患者傷后6 h 血清HMGB1 與DAO、D-Lac 及LPS 的相關性分析 重型TBI 患者傷后6 h血清HMGB1與DAO呈正相關(r=0.488,P<0.05)(見圖4),與D-Lac 呈正相關(r=0.407,P<0.05)(見圖5),與LPS呈正相關(r=0.466,P<0.05)(見圖6)。
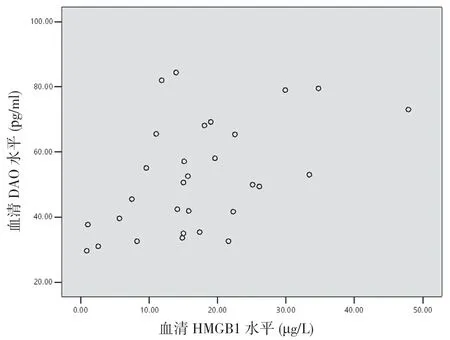
圖4 重型TBI 患者血清HMGB1 水平與DAO 相關性分析
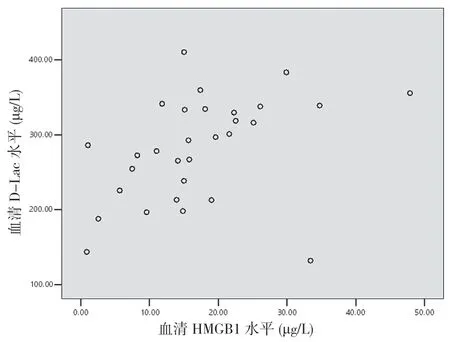
圖5 重型TBI 患者血清HMGB1 水平與D-Lac 相關性分析
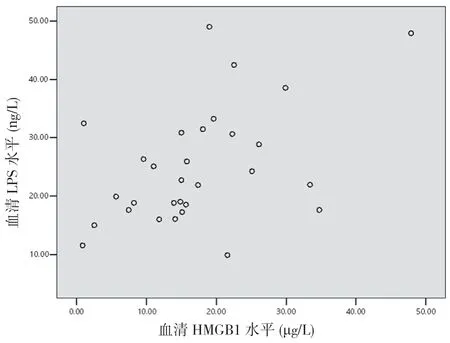
圖6 重型TBI 患者血清HMGB1 水平與LPS 相關性分析
3 討論
TBI 患者常合并腸黏膜屏障功能損傷,其損傷機制尚未完全闡明,因此TBI 合并腸黏膜屏障功能損傷的發病機制成為當今的研究熱點[9]。腸黏膜屏障功能損傷可以從腸道組織形態學檢查進行反應,但臨床上獲取腸道黏膜組織標本存在較大困難,因此更多的是從血清學上評價腸黏膜屏障功能完整性,常采用DAO、D-Lac 和LPS 間接評估腸道黏膜屏障功能的損傷嚴重程度[10-13]。本研究結果顯示,重型TBI 患者在傷后6 h即出現血清DAO、D-Lac、LPS持續升高,在24 h達峰值,維持至傷后48 h 仍無明顯下降趨勢,該現象說明重型TBI 患者在傷后早期即可出現腸黏膜屏障功能損傷,而且能持續較長時間。
近年研究發現,HMGB1 具有強大的促炎作用,是器官損傷的關鍵介質之一[14]。在本實驗中,重型TBI患者在傷后6 h 的炎癥反應指標中HMGB1、TNF-α、IL-1β 及IL-6 較健康體檢者均有不同程度的升高,差異有統計學意義(P<0.05)。由此說明重型TBI 患者傷后即出現炎癥反應。分析這些炎癥反應指標在傷后6、24 及48 h 時間點的變化,發現重型TBI 患者炎癥反應早期即出現逐漸加重,在傷后24 h 可以達峰值,而且持續至傷后48 h 仍無下降趨勢。重型TBI 患者傷后炎癥反應指標的變化與腸道黏膜屏障功能損傷指標的變化具有一致性,因此推測炎癥反應可能介導了重型TBI患者腸道黏膜屏障功能的損傷[15,16]。這與國內龐永斌等[17]報道,一組106 例急性重度閉合性顱腦損傷患者中存在血清HMGB1、TNF-α 和IL-6 高表達水平的情況相一致。
HMGB1 作為炎癥反應的核心因子,其與腸黏膜屏障損傷的相關研究方面也逐漸引起關注。研究[18]發現,HMGB1 在急性重癥胰腺炎患者中的表達水平明顯高于健康對照組,而且與腸道黏膜通透性指標DAO、LPS 呈正相關,該研究發現循環HMGB1 與腸屏障功能障礙的嚴重程度相關,為HMGB1 可能是引起小腸黏膜屏障損傷的關鍵因素提供了直接證據。在本次實驗中,重型TBI 患者傷后6 h 血清HMGB1 水平與腸道黏膜屏障功能指標DAO、D-Lac、LPS 呈正相關,說明HMGB1 可能與重型TBI 患者腸道黏膜屏障功能損傷具有緊密聯系。進而本課題組分析了重型TBI 患者傷后6 h 血清HMGB1 與血清TNF-α、IL-1β 及IL-6 的相關性,相關性檢驗發現HMGB1 與血清TNF-α、IL-6呈正相關。研究結果也說明了HMGB1參與了炎癥反應,可能是非常重要的炎癥介質,觸發炎癥反應,最終導致腸黏膜屏障功能損傷。文獻報道[19]能解釋本課題組的結果,在機體損傷時應激反應所產生的致炎因子與細胞膜表面相應受體結合,觸發細胞內HMGB1 的合成和釋放,HMGB1 可與晚期糖基化終產物受體(RAGE)和Toll 樣受體4 相結合激活核因子-kB 信號轉導途徑,并產生大量炎癥因子,包含IL-1β、TNF-α 和IL-6 等,導致炎癥反應,炎癥因子又反過來促進HMGB1的分泌,其形成了一個正反饋,啟動炎癥級聯反應。
綜上所述,重型TBI 患者在傷后早期即出現炎癥反應和腸黏膜屏障功能損傷,炎癥反應可能參與了腸黏膜屏障功能損傷的發生機制,而HMGB1 可能在炎癥反應介導的腸黏膜屏障功能損傷發生過程中發揮著重要作用。當然,HMGB1 如何介導炎癥反應參與重型TBI 患者腸道黏膜屏障功能還需要動物實驗及臨床實驗來進一步闡明。

