山柰酚對腦缺血/再灌注損傷的體內外保護作用機制研究Δ
徐芳琴,郭超,王婧雯(空軍軍醫大學第一附屬醫院藥劑科,西安 710032)
腦缺血/再灌注(cerebral ischemia/reperfusion,CI/R)損傷是指大腦缺血缺氧一定時間后,恢復血液供應時造成的嚴重腦機能障礙[1]。目前,CI/R損傷引起的嚴重腦損傷和功能障礙是臨床治療中一個具有挑戰性的問題,其發病機制可能與炎癥反應、氧化應激等生物過程有關,且尚未開發出可用于治療CI/R損傷的安全可靠的靶向藥物。山柰酚(kaempferol,KAE)主要來源于姜科植物山柰的根莖,屬于黃酮類化合物,亦廣泛存在于茶葉、蔬菜及水果中。藥理研究表明,KAE具有抗炎[2]、抗氧化[3]、抗癌[4-6]、改善脂質代謝[7]、保護大腦[8]等作用。然而,KAE治療CI/R損傷的蛋白靶標與生物過程仍不明確。網絡藥理學研究和分子對接可以同時研究多種化學物質和作用靶點,從而為中藥提供可能的研究途徑[9-10]。基于此,本研究首先利用網絡藥理學研究篩選KAE治療CI/R損傷的作用靶點,分析其治療CI/R損傷的可能作用機制,然后利用分子對接技術明確KAE與核心靶點的結合位點,最后利用體內外實驗驗證KAE發揮腦保護作用的可能機制,為KAE治療CI/R損傷提供實驗研究基礎。
1 材料
1.1 主要儀器
本研究所用主要儀器包括Multiskan Sky型酶標儀、371型CO2培養箱(美國Thermo Fisher Scientific公司),YQX-Ⅱ型厭氧培養箱(上海躍進醫療器械有限公司),CKX53型生物顯微鏡(日本Olympus公司),BSC-1100ⅡA2-X型生物安全柜(山東博科生物產業有限公司),TD4型臺式離心機(湖南湘儀實驗室儀器開發有限公司),BSA124S型分析天平[賽多利斯科學儀器(北京)有限公司],QL-901型渦旋儀(海門市其林貝爾儀器制造有限公司),Mini-TBC型轉移槽、Mini-TBC型轉移芯(北京凱元信瑞儀器有限公司),Mini chemi 500型凝膠成像系統(北京賽智創業科技有限公司)等。
1.2 主要藥品與試劑
本研究所用主要藥品與試劑包括KAE對照品(上海源葉生物科技有限公司,高效液相色譜法測得其含量≥98%),BCA蛋白定量試劑盒、RIPA裂解液(陜西中暉赫彩生物醫藥科技有限公司,批號分別為PQ003、BBO222),蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(p-Akt)、Src、磷酸化 Src(p-Src)、甘油醛-3-磷酸脫氫酶(GAPDH)抗體(武漢賽維爾生物科技有限公司,批號分別為 180947、175108、LS194236、AC2102017D、GB11002),磷酸鹽緩沖液(PBS)、DMEM高糖培養基(美國Corning公司),DMEM無糖培養基(大連美侖生物技術有限公司),聚偏二氟乙烯(PVDF)膜(美國Merck Millipore公司,批號IPVH00010),HRP標記的山羊抗兔IgG抗體(美國Abbkine公司),ECL化學發光超敏顯色試劑盒(上海翊圣生物科技有限公司,批號32106)等。
1.3 細胞和動物
小鼠海馬神經元HT22細胞系由空軍軍醫大學西京醫院新藥研發中心培養和保存。實驗用動物為清潔級雄性SD大鼠,共18只,體質量200~220 g,購自空軍軍醫大學實驗動物中心,動物生產許可證號為SCXK(陜)-2019-001。大鼠在動物房內適應性喂養1周后進行后續實驗。
2 方法
2.1 KAE-靶點-CI/R網絡構建
2.1.1 KAE靶點的預測 從TCMSP數據庫(https://old.tcmsp-e.com/tcmsp.php)獲得KAE分子結構和結構式的“canonical smiles”格式信息;從PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)獲得KAE分子結構和結構式的“sdf”格式信息。選擇物種為“Homo sapiens”,通過SwissTargetPrediction數據庫(http://www.swisstargetprediction.ch/)預測靶點;利用UniProtKB數據庫(https://www.uniprot.org/)使靶點名稱標準化,并刪除重復數據。
2.1.2 CI/R靶點的收集 在GeneCards數據庫(https://www.genecards.org/)和 NCBI數據庫(https://www.ncbi.nlm.nih.gov/gene/)中檢索,關鍵詞為“cerebral ischemia/reperfusion”;在 Drugbank數據庫(https://go.drugbank.com/)中檢索,關鍵詞為“cerebral ischemic stroke”。收集3個數據庫的CI/R靶點檢索結果,刪除重復數據。
2.1.3 共同靶點網絡構建 將KAE、CI/R的靶點輸入Venny在線繪圖工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html),篩選KAE與CI/R的共同靶點,并利用Cytoscape 3.7.1軟件(http://www.cytoscape.org)構建共同靶點網絡。
2.2 核心靶點網絡構建
2.2.1 蛋白質-蛋白質相互作用網絡構建 蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡可闡明預測目標與其他蛋白質之間的關系。STRING數據庫(https://string-db.org/)可提供蛋白質間相互作用的信息,通過STRING數據庫構建CI/R與KAE共同靶點的PPI網絡,利用Cytoscape 3.7.1軟件實現PPI網絡的可視化展示。
2.2.2 核心靶點預測 對PPI網絡進行拓撲學分析,利用Cytoscape 3.7.1軟件中的CytoHubba插件篩選出結構親和力排名前10位的核心靶點。節點顏色越趨近紅色表示其連接的靶點越多,在CI/R損傷發生、發展中的作用越重要。
2.3 分子對接
分子對接是研究藥物分子作用機制的一種方法。從RSCB PDB數據庫(https://www.rcsb.org/)下載蛋白質結構,并使用PyMOL軟件去除每個蛋白質結構的結晶水和其他小分子,然后將其保存為“PDB”格式。將結構文件導入AutoDock Vina軟件中的Autodock Tool 1.5.6程序,在化合物結構上添加原子電荷及氫,保存為“pdbq”格式。將化合物KAE的“mol2”格式文件導入Autodock Tool 1.5.6程序,在化合物結構上添加原子電荷,保存為“pdbqt”格式,作為對接配體。采用AutoDock Vina軟件模擬分子對接,確定核心靶點與KAE的結合親和力。以KAE與核心靶點的對接結合能來評價結合親和力,若分子對接的結合能<-7 kcal/mol(1 kcal=4.186 kJ),說明具有親和力,且結合能的數值越低,說明結合親和力越低,結合越穩定[11]。
2.4 細胞體外實驗驗證
2.4.1 細胞培養 將HT22細胞接種于含10%胎牛血清、1%青鏈霉素雙抗的DMEM高糖培養基(即完全培養基)中,置于37℃、5% CO2培養箱中培養。每2天更換1次培養基,待細胞融合度為90%左右時,用0.25%胰酶消化并進行傳代培養。本研究選用第7代細胞進行后續研究。
2.4.2 氧糖剝奪/再灌注細胞損傷模型的制備、分組與給藥 實驗分為對照組、氧糖剝奪/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)組和KAE低、中、高劑量組。對照組細胞用完全培養基常規培養24 h。OGD/R組細胞用DMEM無糖培養基在37℃恒溫、厭氧培養箱(95%N2、5% CO2)中培養3 h,再用完全培養基代替DMEM無糖培養基常規培養24 h,構建OGD/R細胞損傷模型。KAE低、中、高劑量組細胞先參照OGD/R組厭氧培養3 h后,再分別加入含8、16、32 μmol/L KAE的DMEM無糖培養基常規培養24 h。KAE給藥劑量參考文獻[12]和課題組前期預實驗結果設置。
2.4.3 細胞活力檢測 采用CCK-8法進行檢測。將HT22細胞以5×104個/孔接種于96孔板中,待細胞貼壁后,按“2.4.2”項下分組處理(每組設置3個復孔),同時設置不含細胞和藥物的空白對照組。培養結束后,更換為含CCK-8的培養基,在37℃、5%CO2培養箱中孵育4 h。使用酶標儀在450 nm波長處檢測各孔的光密度(OD),并計算細胞存活率:細胞存活率(%)=(實驗組OD-空白對照組OD)/(對照組OD-空白對照組OD)×100%。實驗重復3次。
2.4.4 HT22 細胞中 Akt、p-Akt、Src、p-Src蛋白表達檢測 采用Western blot法檢測Akt、p-Akt、Src、p-Src蛋白的表達,驗證KAE對HT22細胞中上述蛋白的調控作用。將HT22細胞以2×106個/孔接種于25 cm2細胞瓶中,待細胞貼壁后,按“2.4.2”項下分組處理,用含1%蛋白酶抑制劑的4℃預冷的RIPA裂解液裂解細胞,細胞裂解液在12 000×g、4℃下離心10 min,收集上清液,保存待用。以BCA法測定總蛋白濃度,將蛋白高溫變性后,取等量蛋白質(20 μg)上樣電泳,并轉移至PVDF膜上。用5%脫脂牛奶于室溫下封閉2 h,并在4℃下與Akt、p-Akt、Src、p-Src、GAPDH一抗(稀釋度均為1∶1 000)孵育過夜,再將膜與HRP標記的山羊抗兔IgG二抗(稀釋度為1∶5 000)在37℃下孵育2 h。用ECL化學發光超敏顯色試劑盒進行顯影,采用凝膠成像系統Lane 1D軟件對條帶進行掃描以分析條帶灰度值,以Akt、p-Akt、Src、p-Src與內參蛋白(GAPDH)條帶灰色值的比值表示蛋白的表達水平,以磷酸化蛋白與對應未磷酸化蛋白的灰度值比值反映該蛋白的磷酸化水平,并以對照組為參照。實驗重復3次。
2.5 動物體內實驗驗證
2.5.1 大鼠大腦中動脈阻塞模型的制備、分組與給藥 采用隨機數字表法將18只大鼠隨機分為假手術組(Sham組)、大腦中動脈阻塞(middle cerebral artery occlusion,MCAO)組、KAE組(劑量20 mg/kg),每組6只。除Sham組不造模外,其余2組均造模。采用線栓法建立大鼠MCAO模型:首先大鼠腹腔注射4%戊巴比妥鈉麻醉,仰臥固定,常規消毒,于頸部正中縱切口,分離出右側頸總動脈、頸外動脈、頸內動脈,結扎頸外動脈,動脈夾暫時夾畢頸總動脈和頸內動脈;在頸外動脈結扎處遠心端剪一斜口,經此斜口插入頂端賴氨酸包被的線栓(直徑0.18 mm),經頸內動脈進入大腦前動脈的起始部位,遇輕微阻力即停止;栓塞2 h后,拔出線栓,再灌注24 h,構建MCAO模型以模擬急性腦梗死[13]。Sham組僅鈍性分離大鼠頸部正中切口。于再灌注同時,Sham組及MCAO組腹腔注射生理鹽水,KAE組腹腔注射20 mg/kg KAE。KAE給藥劑量參考文獻[14]和課題組前期預實驗結果設置。
2.5.2 大鼠神經功能評價 參照改良的Longa評分法對大鼠神經功能進行評分,按照0~4分進行評價。0分:無明顯神經功能缺損;1分:提尾時,對側前肢不能前伸;2分:向缺血對側轉圈;3分:不能承受對側自身重量;4分:意識障礙或無自主運動。評分越高,表明大鼠行為障礙越嚴重[14]。
2.5.3 大鼠腦組織病理觀察 采用TTC染色法進行觀察。給藥后,各組大鼠腹腔注射4%戊巴比妥鈉麻醉猝死后立即摘除全腦,用預冷的1×PBS洗凈,濾紙吸干,分為2份。其中一份腦組織置于-20℃冰箱速凍30 min,取出后在冰上切成5片(厚度2 mm)。將切片置于2%TTC染液中,用錫箔紙蓋住后,置于37℃恒溫箱中放置30 min,翻動腦組織切片,使其均勻接觸到染液。取出切片用PBS洗滌3~5 min,立即拍照,采用Image J 1.8.0軟件計算每一片腦組織的梗死區面積,分層計算面積,每一層的梗死面積之和稱為梗死體積。TTC染色為紅色表示正常組織,白色表示梗死區。
2.5.4 大鼠腦組織中Akt、p-Akt、Src、p-Src蛋白表達檢測 采用Western blot法進行檢測。將“2.5.3”項下另一份大鼠腦組織用預冷的1×PBS洗凈后剪碎,稱取20 mg,用含1%蛋白酶抑制劑的4℃預冷的RIPA裂解液裂解,組織裂解液在12 000×g、4℃下離心10 min,收集上清液,保存待用。其余步驟同“2.4.4”項。
2.6 統計學方法
使用SPSS 20.0軟件進行統計分析。計量資料以±s表示,多組間比較采用方差分析,組間兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
3 結果
3.1 KAE-靶點-CI/R網絡構建結果
通過SwissTargetPrediction數據庫預測得到KAE靶點,并使用UniProtKB數據庫使靶點名稱標準化后,共獲得148個KAE靶點。從GeneCards、NCBI和Drugbank 3個數據庫中分別篩選出1 065、73和78個CI/R靶點,刪除重復靶點,共收集到1 124個CI/R靶點。利用Venny在線繪圖工具,將148個KAE靶點和1 124個CI/R靶點進行比對,最后得到61個共同靶點(圖1A)。利用Cytoscape 3.7.1軟件獲得基于KAE-靶點-CI/R之間相互作用的由63個節點和122條邊線組成的復雜網絡(圖1B)。
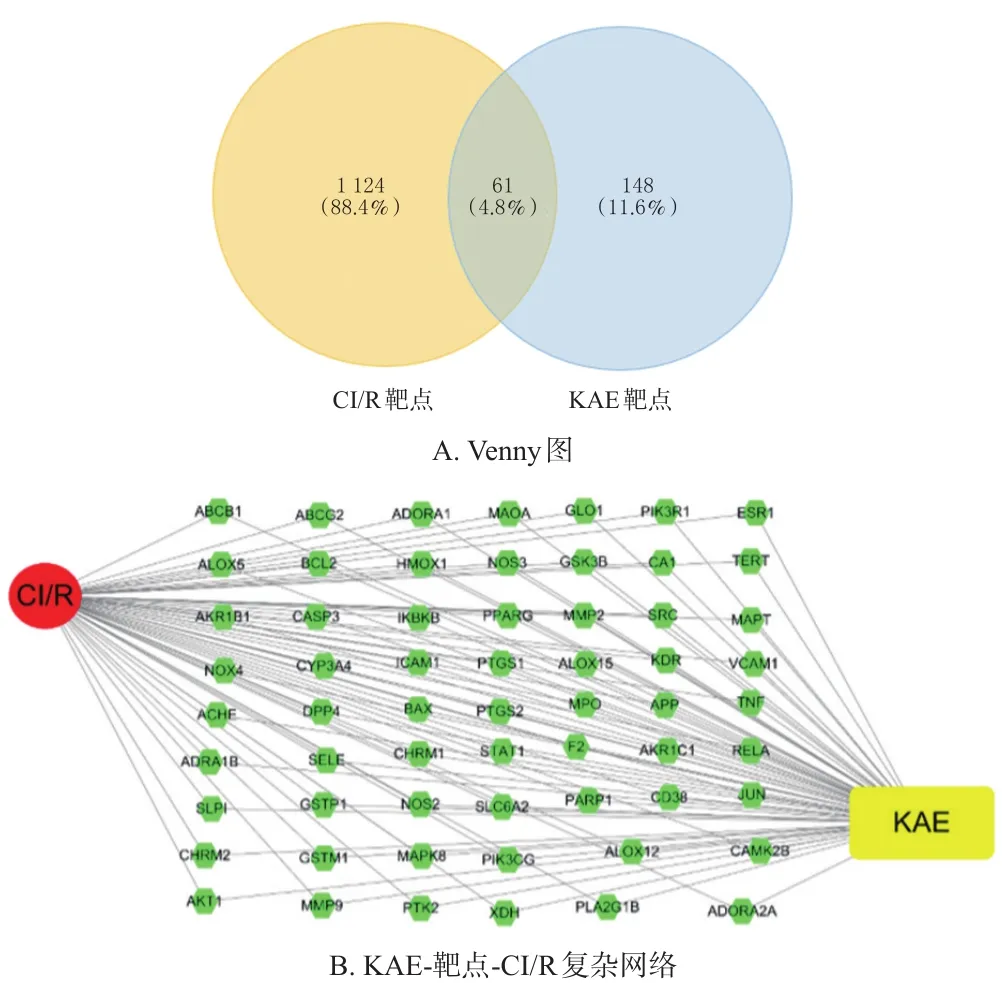
圖1 共同靶點的Venny圖和KAE-靶點-CI/R復雜網絡
3.2 核心靶點網絡構建結果
使用STRING數據庫構建61個共同靶點的PPI網絡。以綜合得分>0.4和“Homo sapines”作為選擇標準,獲得由141個節點和1 152條邊線組成的PPI網絡(圖2A)。通過CytoHubba插件獲得PPI網絡中排名前10位的核心靶點,依次為前列腺素內過氧化物合成酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、基質金屬蛋白酶9(matrix metalloproteinase,MMP9)、JUN、Akt1、腫瘤壞死因子(tumor necrosis factor,TNF)、胱天蛋白酶3(caspase-3,CASP3)、絲裂原激活蛋白激酶8(mitogenactivated protein kinase 8,MAPK8)、細胞間黏附分子1(intercellular cell adhesion molecule 1,ICAM1)、血管細胞黏附分子1(vascular cell adhesion molecule 1,VCAM1)、Src(圖2B)。

圖2 共同靶點和核心靶點的PPI網絡
3.3 分子對接實驗結果
為進一步篩選KAE治療CI/R的關鍵靶點,將KAE分別與排名前10位的核心靶點——PTGS2、MMP9、JUN、Akt1、TNF、CASP3、MAPK8、ICAM1、VCAM1、Src進行分子對接。結果表明,KAE與上述10個核心靶點的結合位點依次為5、4、4、2、3、5、4、5、5、4個(表1),主要包括丙氨酸(alanine,ALA)、絲氨酸(serine,SER)、酪氨酸(tyrosine,TYR)、甲硫氨酸(methionine,MET)、賴氨酸(lysine,LYS)等。分子對接后的配體-蛋白質相互作用分析結果顯示,每個小分子與目標蛋白的結合主要依賴于氫鍵。其中,KAE與核心靶點Akt、Src的結合能均不高于-9.0 kcal/mol,說明結合較穩定,提示KAE可能通過作用于Akt、Src發揮治療作用。因此,本研究以Akt、Src為靶點進行后續實驗驗證。
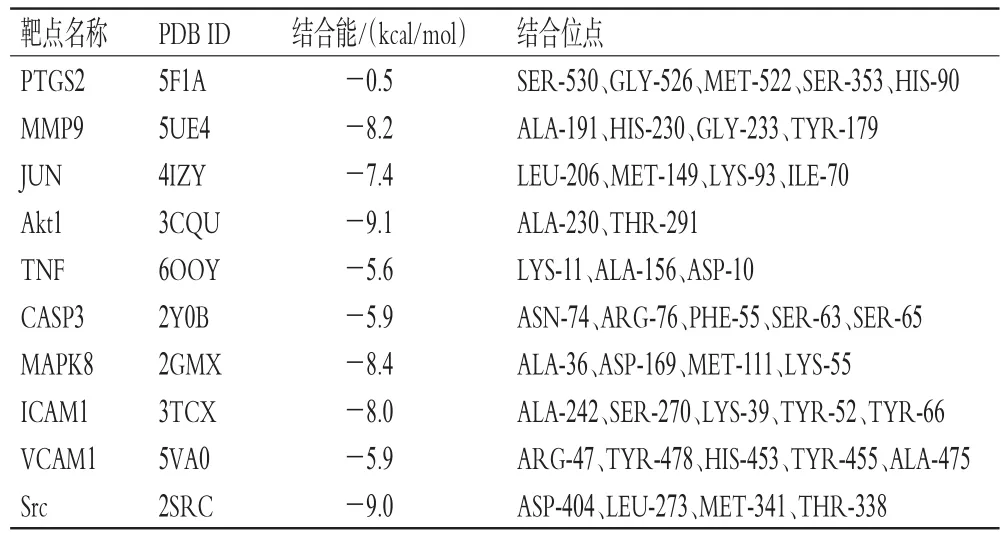
表1 KAE和排名前10位核心靶點的分子對接結果
3.4 體外細胞實驗驗證結果
3.4.1 KAE對OGD/R致HT22細胞損傷的影響 細胞活力檢測結果顯示,與對照組比較,OGD/R組細胞存活率顯著降低(P<0.05),提示OGD/R導致HT22細胞損傷;與OGD/R組比較,KAE低、中、高劑量組細胞存活率均顯著升高(P<0.05),提示KAE可明顯促進HT22細胞存活,并呈劑量依賴趨勢。結果見圖3。

圖3 KAE對HT22細胞存活率的影響
3.4.2 KAE對OGD/R損傷HT22細胞中Akt、Src蛋白磷酸化的影響 Western blot法檢測結果顯示,與對照組比較,OGD/R組細胞中Akt、Src蛋白的磷酸化水平均顯著降低(P<0.05);與OGD/R組比較,KAE中、高劑量組細胞中Akt蛋白的磷酸化水平和KAE高劑量組細胞中Src蛋白的磷酸化水平均顯著升高(P<0.05),且呈劑量依賴趨勢。結果見圖4。
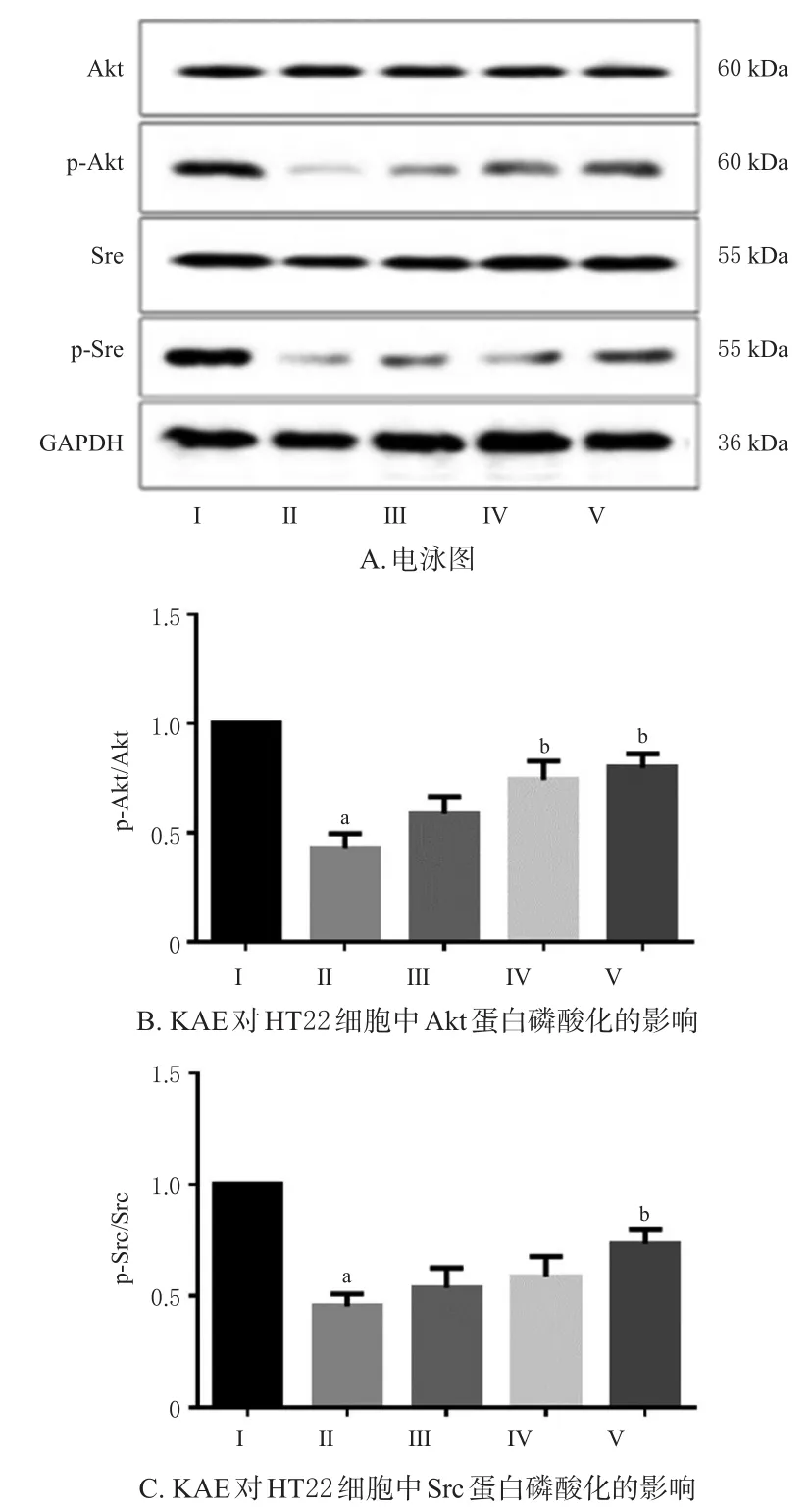
圖4 KAE對HT22細胞中Akt、Src蛋白磷酸化的影響
3.5 大鼠體內實驗驗證結果
3.5.1 KAE對MCAO模型大鼠神經功能的影響 神經功能評分結果顯示,與Sham組比較,MCAO組大鼠神經功能評分顯著升高(P<0.05);與MCAO組比較,KAE組大鼠神經功能評分顯著降低(P<0.05),提示KAE能夠減輕MCAO造成的腦損傷。結果見圖5。
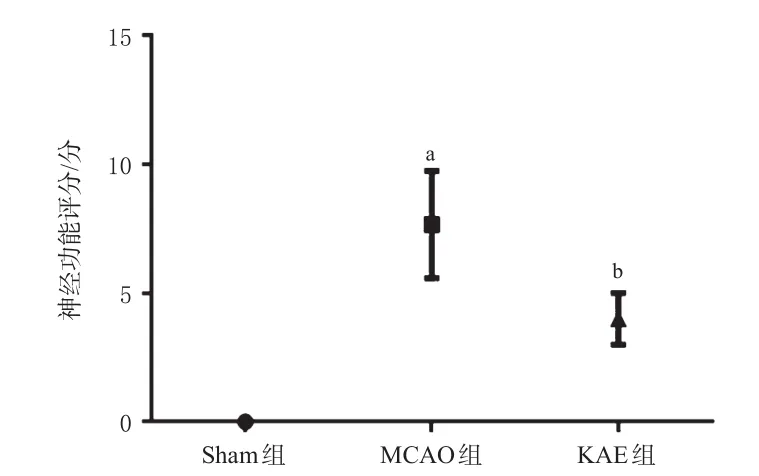
圖5 各組大鼠的神經功能評分
3.5.2 KAE對MCAO模型大鼠腦組織病理學的影響 TTC染色結果顯示,與Sham組比較,MCAO組大鼠腦梗死體積顯著增加(P<0.05);與MCAO組比較,KAE組大鼠腦梗死體積顯著降低(P<0.05)。結果見圖6。

圖6 各組大鼠腦組織的TTC染色圖
3.5.3 KAE對MCAO模型大鼠腦組織中Akt、Src蛋白磷酸化的影響 Western blot法檢測結果顯示,與Sham組比較,MCAO組大鼠腦組織中Akt、Src蛋白磷酸化水平均顯著降低(P<0.05);與MCAO組比較,KAE組大鼠腦組織中Akt、Src蛋白磷酸化水平均顯著升高(P<0.05)。結果見圖7。
4 討論
CI/R損傷是一種復雜的級聯性病理生理過程,其發生機制尚未完全明確。CI/R引起的腦損傷涉及多種生物過程,如炎癥反應、氧化應激、線粒體功能調節和血管內皮功能調節等[15-17]。本研究為闡明KAE治療腦卒中的作用機制,通過網絡藥理學研究和分子對接篩選出了KAE的主要作用靶點,隨后用細胞和動物實驗驗證了篩選的結果。
本網絡藥理學研究結果顯示,KAE可能作用于PTGS2、MMP9、JUN、Akt1、TNF、CASP3、MAPK8、ICAM1、VCAM1、Src 10個核心靶點,從而發揮其治療CI/R損傷的作用。分子對接結果表明,KAE與10個核心靶點的結合親和力均較低,提示KAE與靶點結合穩定。KAE 與PTGS2、MMP9、JUN、Akt1、TNF、CASP3、MAPK8、ICAM1、VCAM1、Src 10個核心靶點的結合位點分別有5、4、4、2、3、5、4、5、5、4個,主要包括ALA、SER、TYR、MET、LYS等,提示KAE可通過與核心靶點多位點結合發揮作用,這與中醫的“多靶點、多通路”治療疾病理論相呼應。其中,KAE與核心靶點Akt、Src的結合能均不高于-9.0 kcal/mol,提示KAE可能通過作用于Akt、Src發揮治療作用。
以往網絡藥理學研究結果顯示,在血管內皮功能調節方面,KAE通過作用于Akt1、MMP9、Src、MAPK8等靶點,調控血管內皮生長因子、松弛素等信號通路進而調節血管內皮功能。Src是一種非受體蛋白酪氨酸激酶,在缺血腦組織中可調節細胞外信號調節激酶,繼而發揮腦保護作用[18]。在腦缺血后再灌注初期,Src可通過調節閉鎖連接蛋白1和血管生成素1的表達,影響血管通透性,從而介導腦損傷[19]。下調Src蛋白磷酸化水平,抑制Src家族激酶信號通路激活,可發揮CI/R保護作用[20]。本研究結果表明,OGD/R損傷HT22細胞及MCAO模型大鼠腦組織中Src蛋白的磷酸化水平均顯著降低,表明CI/R損傷可能導致Src失活,引發腦組織損傷;給予KAE能夠顯著升高OGD/R損傷HT22細胞及MCAO模型大鼠腦組織中Src蛋白的磷酸化水平,提示Scr可能是發揮腦保護作用的重要靶點。
磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)-Akt是維持機體細胞正常生理活動的關鍵信號通路,廣泛存在于腦組織中,其中Akt作為PI3K的下游蛋白,可調節細胞增殖、生長和存活[21]。激活PI3K-Akt通路后可通過減少氧化應激、抑制炎癥細胞因子表達、減少細胞凋亡,從而改善CI/R造成的腦損傷。研究表明,激活PI3K-Akt通路可抑制OGD/R誘導的HT22細胞活性氧的產生,減輕氧化應激[22]。另外,激活PI3K-Akt-核因子E2相關因子2信號轉導可減輕CI/R損傷誘導的神經炎癥和氧化應激[23]。本研究結果表明,OGD/R損傷HT22細胞及MCAO模型大鼠腦組織中Akt蛋白的磷酸化水平均顯著降低,表明CI/R損傷可能導致Akt失活,引發腦組織損傷;給予KAE能夠顯著升高OGD/R損傷HT22細胞及MCAO模型大鼠腦組織中Akt蛋白的磷酸化水平,提示Akt可能是KAE發揮腦保護作用的重要靶點。
綜上所述,KAE可能通過調控Akt、Src蛋白的磷酸化水平來發揮腦保護作用,從而改善CI/R損傷。

