體外法評價青貯玉米與青貯菠蘿渣的組合效應
郭廣振,楊偉光,劉娟,王勝男,陳佳怡,彭蘇,尹福泉,高振華,趙志輝
(廣東海洋大學濱海農業學院,廣東湛江 524088)
0 引言
【研究意義】近年來,我國畜牧業在存在產業發展質量效益低、抵御風險能力不強等老問題的同時,又面臨資源環境約束趨緊、飼草料成本高等新情況,為提高畜牧業競爭力,國務院辦公廳《關于促進畜牧業高質量發展的意見》中指出:以全株青貯玉米、苜蓿等為主導品種,統籌兼顧其他區域和其他飼草品種,加快建設現代化的飼草產業體系。目前,青貯玉米青貯技術在長江以北地區較成熟(布同良,2006),而華南地區尤其是粵西地區由于高溫高濕的氣候特點,導致其發展較緩慢。菠蘿是粵西地區的主要產業之一,加工后的菠蘿副產品(果皮、果渣等)直接丟棄容易造成環境污染和資源浪費。因此,探究菠蘿渣的利用方式,尤其是青貯玉米和青貯菠蘿渣的綜合利用比例,用青貯菠蘿渣替代部分青貯玉米,對于控制飼料成本及環境保護均具有重要意義(王志敬等,2019;Silva Almeida et al.,2019)。【前人研究進展】青貯玉米具有適應性強、產量高、營養豐富等特點,是一種重要的粗飼料來源(布同良,2006)。有研究表明肉羊日糧中添加40%全株青貯玉米可有效降低瘤胃產氣量,提高總揮發性脂肪酸(Total volatile fatty acid,TVFA)含量,肉羊體重可增長50.9%,并降低其飼養成本(梁艾東,2017)。另有研究表明,50%青貯玉米秸稈與50%紅薯秧組合,可顯著提高干物質降解率(Dry matter degradability,DMD)、揮發性脂肪酸和產氣量等指標(葛瀚聰等,2019)。菠蘿作為我國南方特有的熱帶經濟水果,其加工后的副產物富含無氮浸出物、礦物質等營養物質,具有較高飼用價值;經21 d青貯后,即可獲得較好的青貯品質(王志敬等,2019),且山羊對發酵后的菠蘿渣具有較好的利用效果(吳征敏,2019)。在農業廢棄物(甘蔗尾葉、香蕉莖稈、菠蘿葉)中,菠蘿葉的DMD(達79.56%)最高,青貯后的菠蘿渣可替代一定量的青貯高粱(75%,干物質基礎),作為畜禽能量飼料(呂慶芳和王潤蓮,2011;王定發等,2012;Hattakum et al.,2019),可降低飼料成本(Silva Almeida et al.,2019)。【本研究切入點】菠蘿渣作為新型粗飼料,與青貯玉米合理搭配使用對緩解我國南方粗飼料緊張具有重要意義,但目前關于2種飼料原料組合效果的研究鮮有報道。【擬解決的關鍵問題】將青貯玉米與青貯菠蘿渣以不同比例組合分組進行體外發酵試驗,采用體外產氣法探究青貯玉米與青貯菠蘿渣適宜的組合比例,為開發南方地區青貯玉米和菠蘿渣資源提供參考。
1 材料與方法
1.1 試驗材料
青貯玉米(Silage corn,SC):選取文玉3號青貯玉米,于2019年3月在廣東海洋大學試驗基地種植,蠟熟期收獲,留茬25 cm,經人工切短至2~3 cm,混勻后裝入聚乙烯青貯袋(35 cm×25 cm),每袋500 g,用ZG-06型真空保鮮機(真空度60 kPa)抽真空、密封,置于室溫避光儲藏90 d后開封。青貯菠蘿渣(Silage pineapple residue,SPR):菠蘿渣由雷州市某食品加工公司提供,取回后斬碎晾曬至含水量為65%~70%后用于青貯;青貯時加入纖維素酶0.3 g/kg(≥10000μ/g,臺灣亞芯生物科技有限公司),置于室溫避光儲藏35 d后開封。
青貯結束,進行開封烘干(原料經65℃烘干48 h至恒重,制成風干試樣),用微型粉碎機粉碎過40目篩(孔徑0.42 mm)。青貯樣品于常溫回潮后按照干物質比例75∶25、50∶50、25∶75混合裝袋備用,稱取適量青貯樣品和混合樣品于水分皿中,置于105℃烘箱烘2 h后,調至65℃烘24 h后測定干物質含量,全部青貯樣品和混合樣品冷凍保存,用于體外發酵與其他指標測量。青貯飼料原料成分見表1。
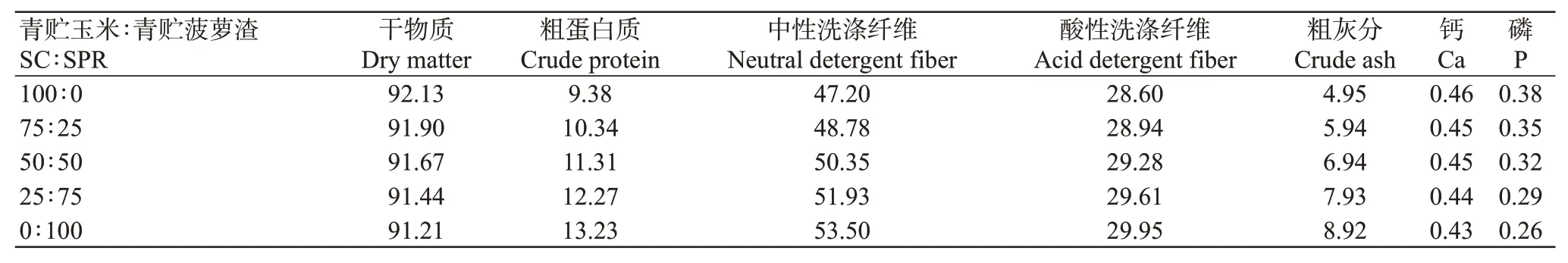
表1 青貯玉米與青貯菠蘿渣營養組成(風干基礎)(%)Table 1 Nutritional composition of SC and SPR(air-dry basis)(%)
1.2 試驗方法
利用200 mL發酵瓶模擬反芻動物瘤胃,將粉碎的青貯菠蘿渣與青貯玉米(風干基礎)以不同比例混合,并加入人工瘤胃液進行體外發酵。二者按照干物質比100∶0、75∶25、50∶50、25∶75、0∶100混合,試驗分為Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ共5組,每組設3個重復,2個空白,進行體外發酵試驗。
1.2.1 人工瘤胃液配制人工唾液制備(王志敬,2017):A液(微量元素溶液)含13.2 g CaCl·2HO、1.0 g CoCl·6HO、10.0 g MnCl·4HO、8.0 g FeCl·6HO,100 mL蒸餾水溶解定容;B液(緩沖液)含5.0 g NaHCO、4.0 g NHHCO,1000 mL蒸餾水溶解定容;C液(常量元素溶液)含9.45 g NaHPO·12HO、0.6 g MgSO·7HO、6.2 g KHPO,1000 mL蒸餾水溶解定容;D液(0.1%刃天青溶液)含100 mg刃天青,100 mL蒸餾水溶解定容;E液(還原劑)含625 mg NaS·9HO、1 mol/L NaOH 4.0 mL,95 mL蒸餾水攪拌均勻。將配制好的原液按蒸餾水+B液+C液+A液+D液+E液順序以一定比例混合后,放入(39.0±0.5)℃水浴鍋內,期間持續通入CO使其由藍色變為粉紅色,最終為無色,制成人工唾液。
瘤胃液:選取2只體重接近(27.0±1.5)kg、健康狀況良好的雷州山羊(公羊)作為瘤胃液供體羊,于放牧采食后3 h,將山羊運至解剖實驗室經屠宰采集瘤胃內容物,用4層紗布過濾,濾液持續通入CO,整個操作于(39.0±0.5)℃恒溫水浴鍋中進行。然后將人工唾液與瘤胃液按照9∶1均勻混合,期間持續通入CO,制成人工瘤胃液(王志敬,2017)。
1.2.2 體外培養提前稱取1.25 g不同組合比例的青貯飼料于體積為200 mL發酵瓶內,并放入(39.0±0.5)℃恒溫振蕩培養箱進行預熱,向瓶中持續通入CO,迅速加入70 mL人工瘤胃液,封閉后置于(39.0±0.5)℃恒溫振蕩培養箱內,分別發酵3、12、24和48 h(空白對照組只添加70 mL人工瘤胃液)。為避免瓶內壓強過大而導致瓶塞松動漏氣,采用50 mL注射器每間隔3 h收集一次氣體,各發酵時間點產氣量為每次收集氣體的累加值。發酵結束時,快速將發酵瓶放入冰水浴中終止微生物活動,測定發酵液及發酵渣各項指標。
1.3 相關指標測定及計算
1.3.1 發酵液pH發酵結束后立即用S220-K型酸度計測定發酵液pH。
1.3.2 發酵液TVFA含量揮發性脂肪酸采用Thermo TRACE 1310-ISQ LT氣—質聯用儀(Thermo,美國),GC-MS檢測方法測定。TVFA濃度為各揮發性脂肪酸濃度之和。樣品處理:從發酵瓶中移取100μL發酵液,加入50μL 15%磷酸、10μL異己酸(75μg/mL)、140μL乙醚,勻漿1 min,于4℃12000 r/min離心10 min,取上清上機測試。色譜條件:色譜柱Agilent HP-INNOWAX毛細管柱(30 m×0.25 mm ID×0.25μm);分流進樣,進樣量1μL,分流比10∶1。進樣口溫度250℃;離子源溫度230℃;傳輸線溫度250℃,四極桿溫度150℃。程序升溫起始溫度90℃;然后以10℃/min升溫至120℃;再以5℃/min升溫至150℃;最后以25℃/min升溫至250℃維持2 min。載氣為氦氣,載氣流速1.0 mL/min。MS條件:電子轟擊電離(EI)源,SIM掃描方式,電子能量70 eV。
1.3.3 試驗原料及發酵產物營養物質測定與降解率計算試驗原料及發酵產物檢測指標:干物質、粗灰分、粗蛋白質、鈣和磷。纖維濾袋法(AnkomⅡ00i)測定試驗原料及發酵產物中的中性洗滌纖維、酸性洗滌纖維。營養成分降解率計算公式(吳征敏等,2018):某養分降解率(%)=(試驗原料中某養分含量-發酵后濾渣中某養分含量)/試驗原料中某養分含量×100。
1.3.4 產氣量和產氣參數計算產氣量采用針筒法測定。

產氣速率與產氣參數:根據不同時間點的產氣量,采用Gompertz模型對各組產氣量數據進行非線性回歸擬合(Schofieid et al.,1994)。
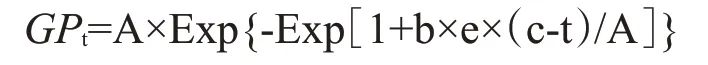
式中,為時間內注射器中的累積產氣量(mL/g);A為理論最大產氣量;b為產氣速率常數(mL/h);e為自然對數函數的底數,約為2.71828;c為體外發酵產氣延滯時間(h);Exp為歐拉常數,為體外發酵產氣時間點(h),發酵周期為0~48 h。
1.3.5 組合效應指數計算組合效應指數參考以下公式計算(吳征敏等,2018):

式中,實測值為樣品某一指標的實際測定消化率;加權估算值=單一青貯玉米實測值×青貯玉米配比+單一青貯菠蘿渣實測值×青貯菠蘿渣配比。
1.4 統計分析
試驗數據經Excel 2019整理后采用SPSS 23.0的ANOVA模型進行雙因素方差分析和非線性回歸分析,用LSD法進行多重比較。
眾人面面相覷,不怕受傷不怕死?就這,也能算制勝法寶?秦鐵崖道:“倘若是打擂臺,以摔倒在地、跌落擂臺為失敗,秦某贏不了張萬邦,贏不了李太嶂。以先受傷為失敗,秦某贏不了李雙岱。”
2 結果與分析
2.1 青貯玉米與青貯菠蘿渣組合對體外瘤胃產氣量及產氣參數的影響
由表2可知,雙因素方差分析結果表明,不同組合比例和發酵時間及二者的交互作用對山羊體外瘤胃產氣量影響極顯著(<0.01,下同)。隨著發酵時間的推移,各試驗組產氣量顯著增加(<0.05,下同)。其中體外發酵3 h時,各試驗組的累積產氣量差異不顯著(>0.05,下同);體外發酵12、24和48 h時,Ⅴ組的累積產氣量最高,Ⅲ組和Ⅳ組的累積產氣量差異不顯著;體外發酵12~24 h時,Ⅲ組的累積產氣量顯著高于Ⅱ組,與Ⅰ組差異不顯著;體外發酵48 h時,Ⅲ組的累積產氣量顯著高于Ⅰ組,Ⅱ組的累積產氣量分別與Ⅰ、Ⅲ和Ⅳ組差異不顯著。
由表2可知,隨著青貯菠蘿渣比例的提高,理論最大產氣量(A值)呈先升高后降低再升高的變化趨勢,Ⅰ組的A值最低,Ⅱ~Ⅴ組間的A值差異不顯著;產氣速率(b值)隨著青貯菠蘿渣比例的提高先降低后升高,Ⅴ組的b值最大,Ⅰ~Ⅳ組間的b值差異不顯著;產氣延滯時間(c值)隨著青貯菠蘿渣比例的提高先升高后降低,Ⅴ組的c值最小,Ⅰ、Ⅲ和Ⅳ組間的c值差異不顯著,但均顯著低于Ⅱ組。
2.2 青貯玉米與青貯菠蘿渣對山羊體外瘤胃DMD的影響
由表3可知,雙因素方差分析結果表明,不同組合比例和發酵時間及二者交互作用對山羊體外瘤胃DMD產生極顯著影響。隨著發酵時間的推移,各試驗組呈線性增加。體外發酵3 h時,Ⅳ組DMD顯著低于Ⅱ組;體外發酵12 h時,Ⅰ組和Ⅱ組DMD顯著高于其他3組,Ⅲ組與Ⅳ組DMD差異不顯著,但顯著高于Ⅴ組;體外發酵24 h時,Ⅰ組DMD顯著低于其他試驗組,Ⅴ組DMD分別與混合組(即Ⅱ、Ⅲ、Ⅳ組)差異不顯著,Ⅱ組和Ⅲ組DMD差異不顯著,但顯著高于Ⅳ組;體外發酵48 h時,Ⅰ組與Ⅳ組的DMD差異不顯著,二者顯著低于其他組,Ⅱ組的DMD分別與Ⅲ組和Ⅴ組差異不顯著,Ⅴ組的DMD顯著高于Ⅲ組。
2.3 體外瘤胃DMD的組合效應
由表4可知,發酵3、24和48 h時,Ⅱ組與Ⅲ組的DMD產生正組合效應,各組間(發酵3 h和48 h時)組合效應指數差異不顯著;發酵24 h時,Ⅳ組的組合效應指數顯著低于Ⅱ組和Ⅲ組,Ⅱ組與Ⅲ組間的組合效應指數差異不顯著;發酵12 h時,僅Ⅳ組DMD產生正組合效應,與Ⅱ組和Ⅲ組的組合效應指數差異不顯著。
2.4 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃粗蛋白降解率(CPD)的影響
由表5可知,雙因素方差分析結果表明,不同組合比例和發酵時間及二者的交互作用對山羊體外瘤胃CPD產生極顯著影響。隨著發酵時間的推移,各試驗組CPD顯著增加,但Ⅳ組在12 h和24 h的CPD差異不顯著。在各發酵時間點,Ⅴ組的CPD顯著高于Ⅰ、Ⅱ組。混合飼料組隨著青貯菠蘿渣比例的增加,CPD逐漸增大,即Ⅱ組<Ⅲ組<Ⅳ組,但48 h時Ⅱ組和Ⅲ組的CPD差異不顯著。體外發酵3 h時,Ⅰ組的CPD最低,Ⅴ組的CPD顯著低于Ⅲ組;體外發酵12 h時,Ⅴ組與Ⅳ組的CPD差異不顯著,Ⅰ組的CPD顯著高于Ⅲ組;體外發酵24 h時,Ⅳ組與Ⅰ組的CPD差異不顯著,顯著低于Ⅴ組;體外發酵48 h時,Ⅴ組與Ⅳ組的CPD差異不顯著,Ⅰ組的CPD顯著高于Ⅱ組,與Ⅲ組的CPD差異不顯著。
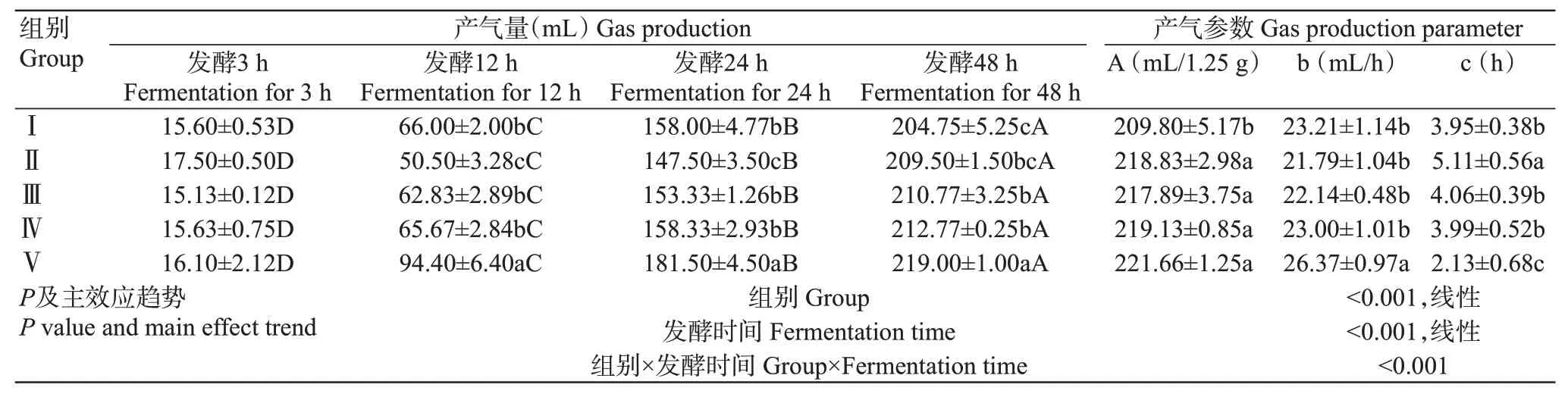
表2 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃產氣量及產氣參數的影響Table 2 Effects of SC and SPR combination on rumen gas production of goats in vitro and its parameter
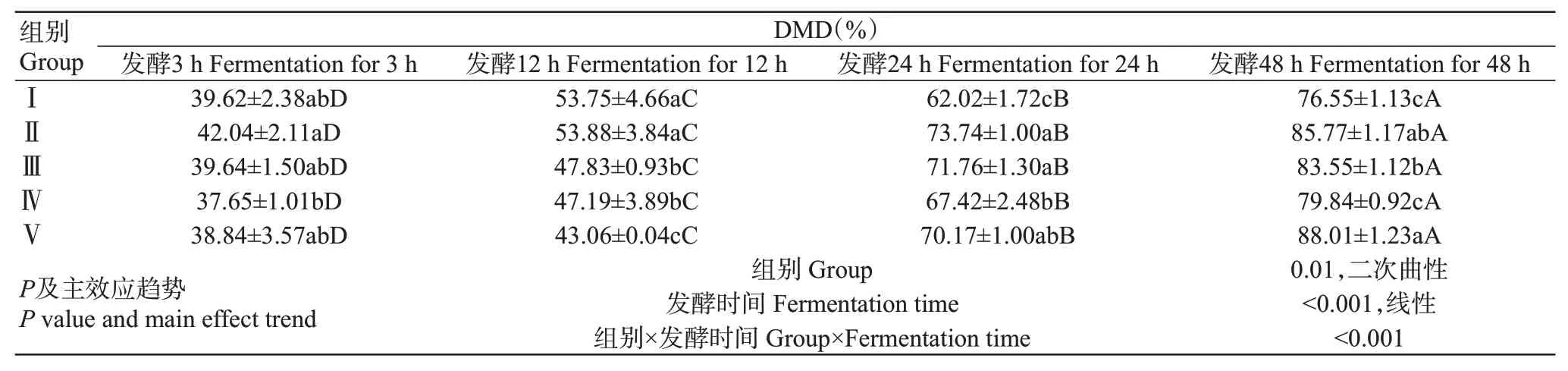
表3 青貯玉米與菠蘿渣組合對山羊體外瘤胃DMD的影響Table 3 Effects of SC and SPR combination on rumen DMD of goats in vitro

表4 青貯玉米與菠蘿渣對山羊體外瘤胃DMD的組合效應Table 4 Associative effects of SC and SPR on rumen DMD of goats in vitro
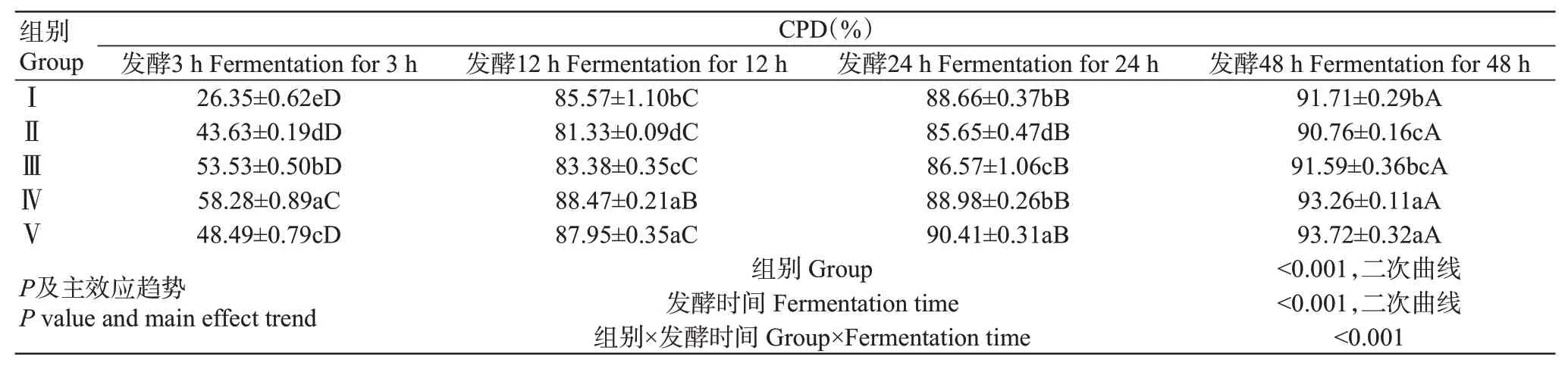
表5 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃CPD的影響Table 5 Effects of SC and SPR combination on rumen CPD of goats in vitro
2.5 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃CPD的組合效應
由表6可知,體外發酵3 h時,混合組均產生了正組合效應,即Ⅱ組>Ⅳ組>Ⅲ組;體外發酵12、24和48 h時,僅Ⅳ組產生正組合效應,其中體外發酵12與24 h的Ⅳ組組合效應指數顯著高于Ⅱ組和Ⅲ組,體外發酵48 h,混合組的組合效應指數差異不顯著。
2.6 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃中性洗滌纖維降解率(NDFD)的影響

表6 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃CPD的組合效應Table 6 Associative effects of SC and SPR combination on rumen CPD of goats in vitro
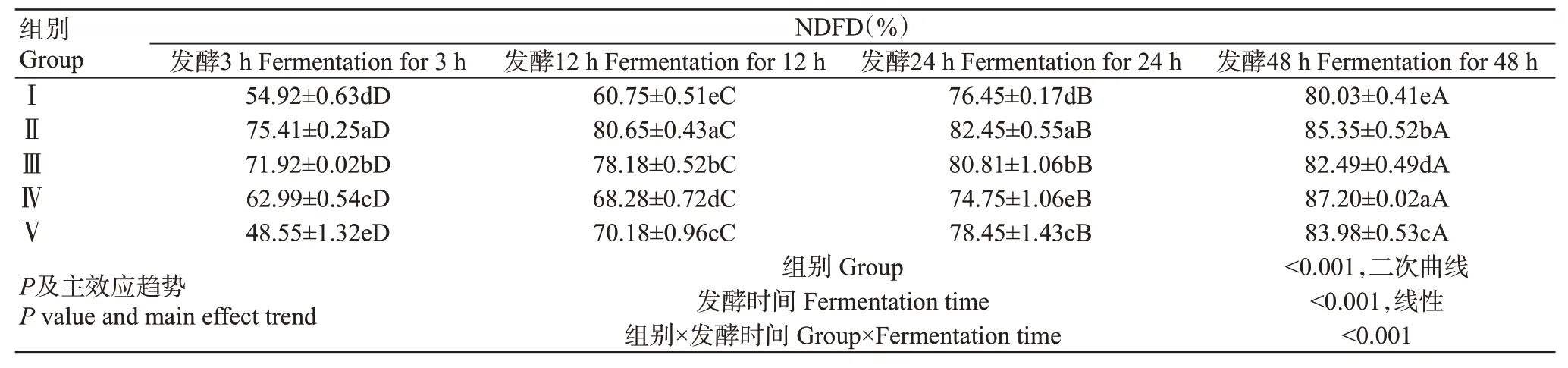
表7 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃NDFD的影響Table 7 Effects of SC and SPR combination on rumen NDFD of goats in vitro
2.7 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃NDFD的組合效應
由表8可知,僅Ⅱ組在發酵12和24 h時產生負組合效應,其他試驗組均產生正組合效應;發酵3和12 h時,Ⅲ組與Ⅳ組的組合效應指數顯著高于Ⅱ組;發酵24 h時,Ⅲ組的組合效應指數與Ⅱ組和Ⅳ組差異不顯著,Ⅳ組的組合效應指數顯著高于Ⅱ組;體外發酵48 h時,混合組間的組合效應指數差異不顯著。
2.8 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃pH的影響
由表9可知,雙因素方差分析結果表明,發酵時間對山羊體外瘤胃pH產生極顯著影響。隨著發酵時間的推移,各試驗組pH呈線性降低。體外發酵3和24 h時各組間pH差異不顯著;發酵12 h時,Ⅲ組的pH顯著低于Ⅰ組和Ⅴ組,與Ⅱ組和Ⅲ組差異不顯著;發酵48 h時,Ⅰ組的pH顯著低于其他組,混合組間pH差異不顯著,Ⅳ組的pH顯著高于Ⅴ組。
2.9 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃揮發性脂肪酸濃度的影響
由表10可知,雙因素方差分析結果表明,不同組合比例和發酵時間及二者的交互作用對山羊體外瘤胃TVFA濃度產生極顯著影響。各組TVFA濃度隨發酵時間推移顯著上升,其中發酵48 h的TVFA濃度顯著高于其他發酵時間。在整個發酵過程中,各試驗組的TVFA濃度隨著青貯菠蘿渣比例的提高呈先降低后升高再降低的變化趨勢。體外發酵3 h時,Ⅲ組的TVFA濃度顯著高于其他各組;Ⅳ組的TVFA濃度分別與Ⅰ、Ⅱ、Ⅴ組差異不顯著;Ⅰ組的TVFA濃度顯著高于Ⅱ、Ⅴ組,而Ⅱ組與Ⅴ組的TVFA濃度差異不顯著。體外發酵12 h時,Ⅲ組的TVFA濃度與Ⅰ組差異不顯著,但二者顯著高于其他各組;Ⅳ組的TVFA濃度顯著高于Ⅱ、Ⅴ組;Ⅱ組的TVFA濃度顯著高于Ⅴ組。體外發酵24和48 h時,各試驗組的TVFA濃度表現為Ⅳ組>Ⅴ組>Ⅲ組>Ⅰ組>Ⅱ組。

表8 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃NDFD的組合效應Table 8 Associative effects of SC and SPR combination on rumen NDFD of goats in vitro
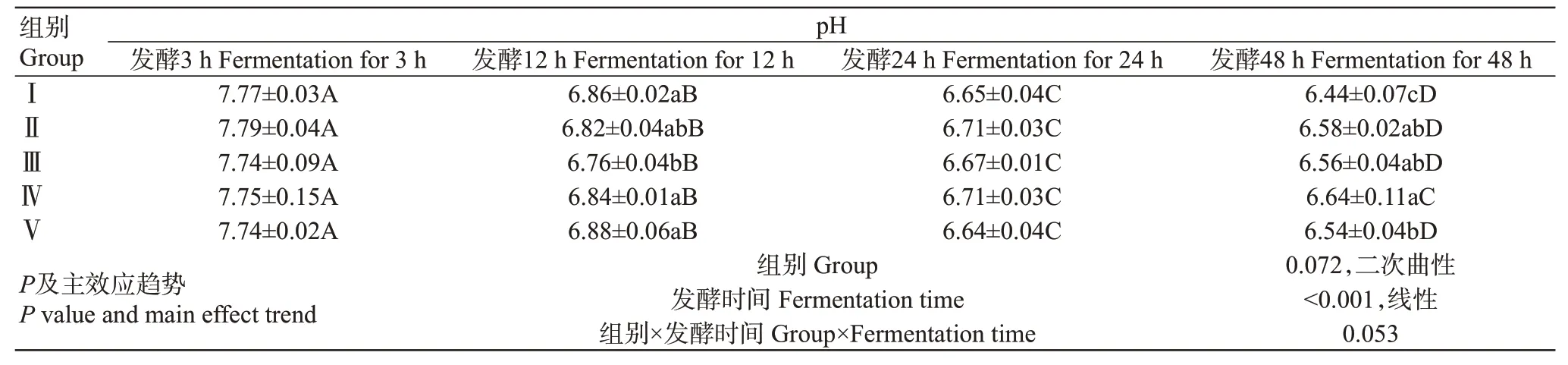
表9 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃pH的影響Table 9 Effects of SC and SPR combination on rumen pH of goats in vitro
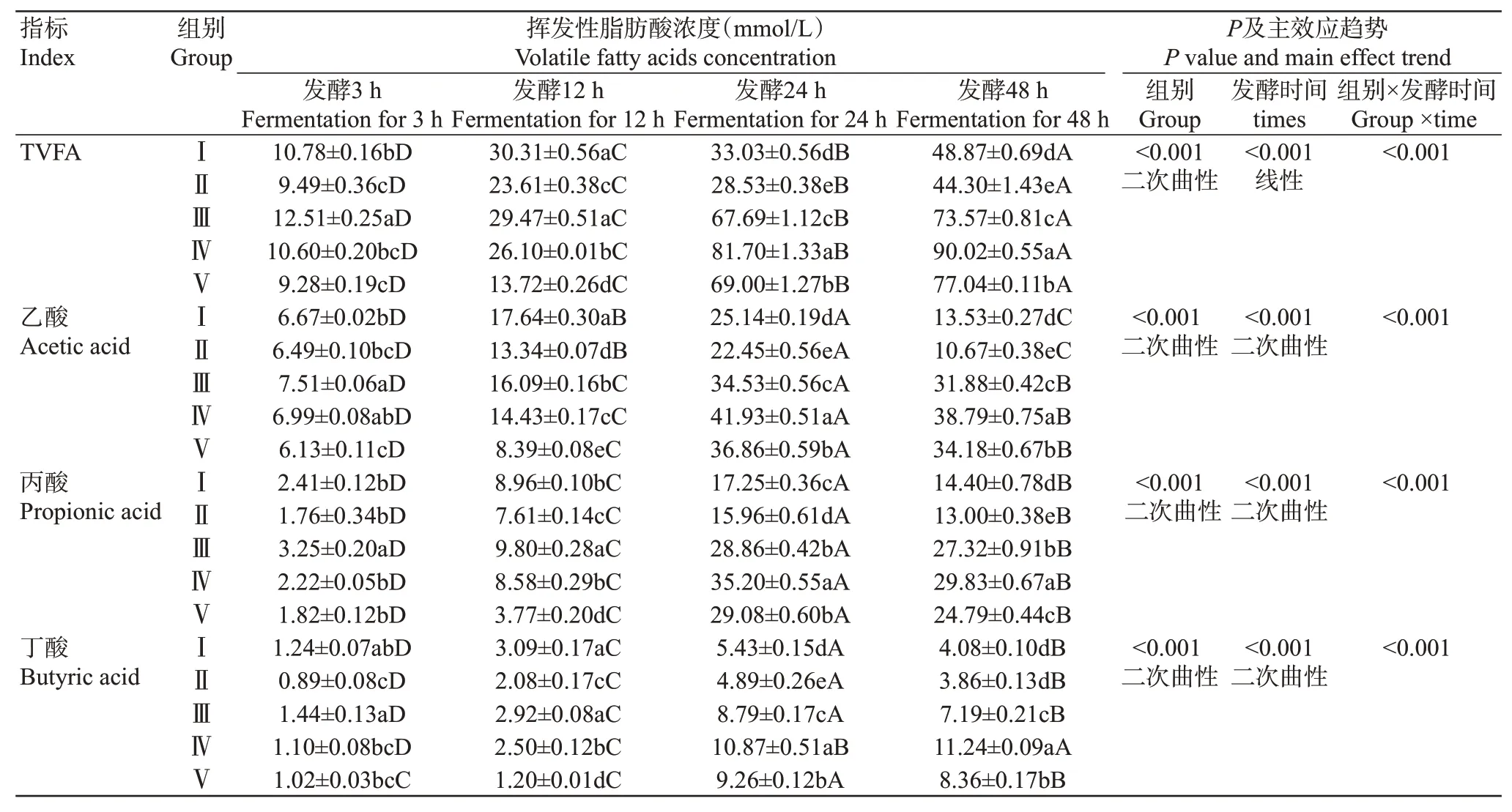
表10 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃揮發性脂肪酸濃度的影響Table 10 Effects of SC and SPR combination on rumen volatile fatty acids of goats in vitro
由表10還可知,不同組合比例和發酵時間及二者的交互作用分別對山羊體外瘤胃乙酸、丙酸和丁酸濃度產生極顯著影響。各試驗組的乙酸、丙酸和丁酸(除Ⅳ組)濃度隨著發酵時間的推移呈先升高后降低的變化趨勢,其中發酵24 h時的乙酸、丙酸和丁酸(48 h時Ⅳ組丁酸濃度最高)濃度顯著高于其他發酵時間點。同一發酵時間,各試驗組乙酸、丙酸和丁酸濃度隨著青貯菠蘿渣比例的增加呈先降低后升高再降低的變化趨勢。體外發酵3 h時,乙酸:Ⅲ組顯著高于Ⅰ、Ⅲ、Ⅴ組,與Ⅳ組差異不顯著;丙酸:Ⅲ組顯著高于其他4組;丁酸:Ⅲ組顯著高于Ⅱ、Ⅳ、Ⅴ組,與Ⅰ組差異不顯著。體外發酵12 h時,乙酸:Ⅰ組>Ⅲ組>Ⅳ組>Ⅱ組>Ⅴ組;丙酸:Ⅲ組>Ⅳ組>Ⅱ組>Ⅴ組>Ⅰ組,Ⅳ組與Ⅰ組差異不顯著;丁酸:Ⅲ組與Ⅰ組差異不顯著,但顯著高于其他3組,即Ⅲ組>Ⅳ組>Ⅱ組>Ⅴ組>Ⅰ組。體外發酵24 h時,乙酸與丁酸:Ⅳ組>Ⅴ組>Ⅲ組>Ⅰ組>Ⅱ組;丙酸:Ⅳ組>Ⅴ組>Ⅰ組>Ⅱ組,Ⅲ組與Ⅴ組差異不顯著。體外發酵48 h時,乙酸:Ⅳ組>Ⅴ組>Ⅲ組>Ⅰ組>Ⅱ組;丙酸:Ⅳ組>Ⅲ組>Ⅴ組>Ⅰ組>Ⅱ組;丁酸:Ⅳ組>Ⅴ組>Ⅲ組>Ⅰ組,Ⅰ組與Ⅱ組差異不顯著。
2.1 0青貯玉米與青貯菠蘿渣對山羊體外瘤胃揮發性脂肪酸的組合效應
由表11可知,在整個發酵過程中,50%~75%比例的青貯菠蘿渣組的揮發性脂肪酸與TVFA產生正組合效應(除50%比例青貯菠蘿渣組體外發酵48 h外),25%比例青貯菠蘿渣組則產生負組合效應。體外發酵3 h時,TVFA組合效應指數:Ⅲ組>Ⅳ組>Ⅱ組;乙酸、丙酸、丁酸組合效應指數:Ⅲ組>Ⅱ組,Ⅳ組與Ⅱ、Ⅲ組差異不顯著。體外發酵12 h時,TVFA組合效應指數:Ⅳ組>Ⅲ組>Ⅱ組;乙酸、丙酸、丁酸組合效應指數:Ⅲ組>Ⅳ組>Ⅱ組。體外發酵24 h和48 h時,TVFA、乙酸、丙酸、丁酸組合效應指數:Ⅳ組>Ⅲ組>Ⅱ組。
2.1 1青貯玉米與青貯菠蘿渣組合體外發酵的多項組合效應指數
由表12可知,僅Ⅱ組的多項組合效應指數產生負值,Ⅲ組和Ⅳ組的多項組合效應指數均為正值。發酵3和12 h時,Ⅲ組的多項組合效應指數最大,分別為1.82和11.85;發酵24和48 h時,Ⅳ組的多項組合效應指數最大,分別為20.01和21.71。
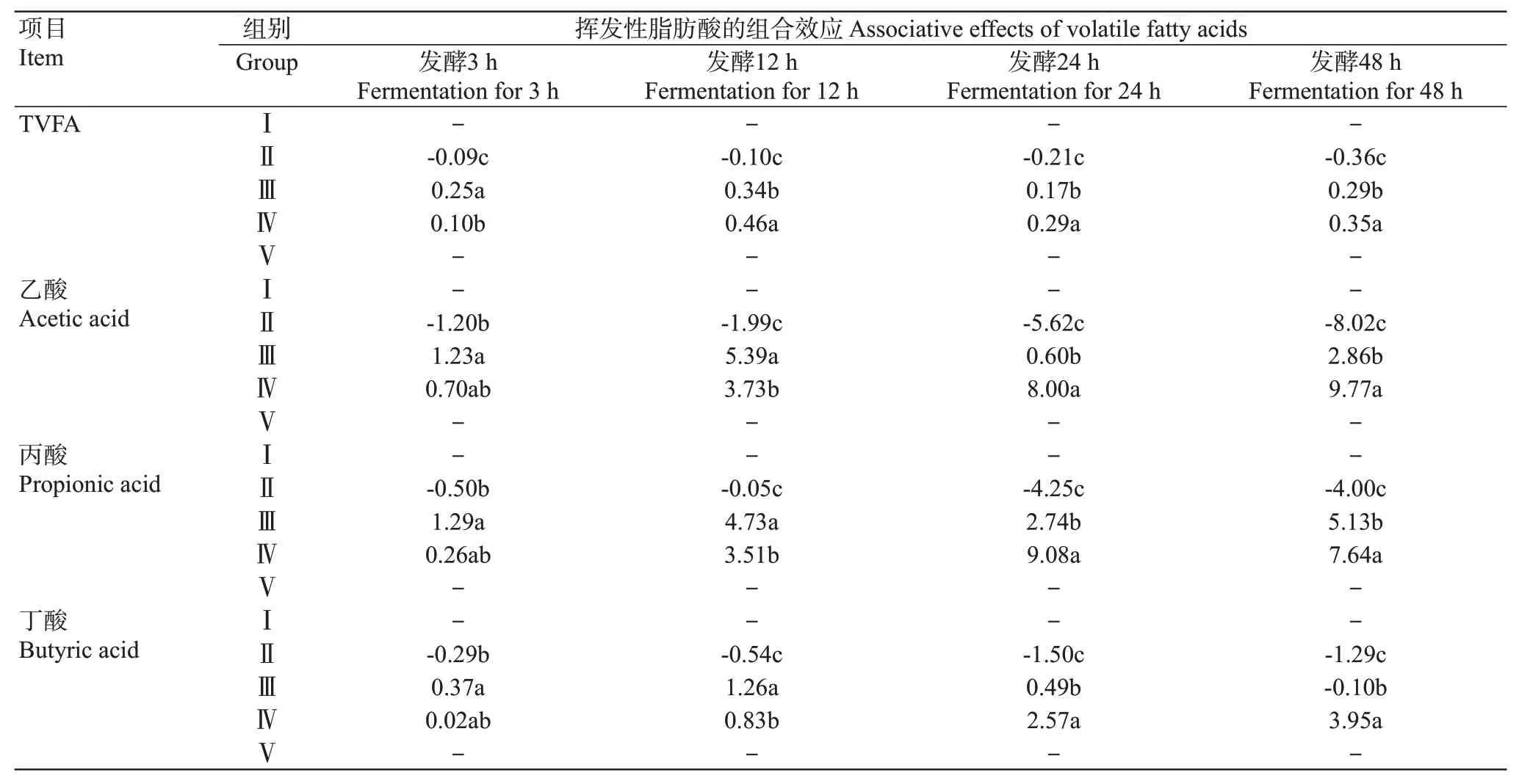
表11 青貯玉米與青貯菠蘿渣對山羊體外瘤胃揮發性脂肪酸濃度的組合效應Table 11 Associative effects of SC and SPR on rumen volatile fatty acids of goats in vitro

表12 青貯玉米與青貯菠蘿渣組合體外發酵的多項組合效應指數Table 12 Multiply factor associative effects index of SC and SPR combination for fermentation in vitro
3 討論
3.1 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃產氣參數的影響
產氣量既能在一定程度上反映反芻動物體內飼料降解特性及其微生物的總體活動趨勢,也是衡量飼料營養價值的重要指標(Son et al.,2003)。本研究中,累積產氣量隨著體外持續發酵時間延長而逐漸升高,且各試驗組理論最大產氣量與48 h實際累積產氣量高低順序基本一致,數值也基本接近理論最大產氣量,表明通過體外發酵產氣法研究青貯玉米和青貯菠蘿渣組合效果可較好地推測飼料在雷州山羊瘤胃內的發酵特性。體外發酵初期,各試驗組產氣量變化基本一致,通過計算累積產氣量線性回歸擬合發現,各試驗組均有短暫的延滯期。由于體外發酵早期是瘤胃微生物的增殖階段,其數量與降解活性較低,使得其對飼料降解緩慢,因此發酵速度緩慢是導致早期體外發酵產氣量偏低的原因(布同良,2006;王志敬等,2017)。發酵后期,在青貯玉米與青貯菠蘿渣的組合中,青貯菠蘿渣比例越大,累積產氣量、理論最大產氣量和產氣速率逐漸增大,且延滯時間縮短。這可能是由于青貯菠蘿渣富含粗蛋白與易發酵碳水化合物,為青貯玉米和青貯菠蘿渣組合發酵提供了較多的氮源與碳源,使低質飼料間部分營養成分含量不足或缺失得到互補,提高了飼料中易發酵的營養物質與不易發酵的結構性碳水化合物比例的合理性,有利于瘤胃微生物增殖及其降解飼料(周傳社等,2005)。可見,青貯菠蘿渣與青貯玉米按照75∶25混合后發酵,可促進瘤胃微生物的生命活動,提高飼料降解率。
宿主與有益微生物間是一種營養互作關系,如瘤胃微生物分泌各種酶分解飼料中可發酵糖類等可被宿主與微生物直接吸收利用的營養成分,同時合成多種維生素、氨基酸和菌體蛋白等營養物質供宿主消化利用(陳代文,2016)。本研究中,各試驗組的DMD、粗蛋白質、NDFD隨體外發酵時間的推移顯著升高,與產氣量升高趨勢一致,表明瘤胃微生物的生命活動正常且逐漸增強。但早期體外發酵的單一青貯菠蘿渣組的干物質和中性洗滌纖維的降解程度低于單一青貯玉米組,發酵后期DMD、NDFD則表現相反結果,同時單一青貯菠蘿渣組的CPD顯著高于單一青貯玉米組,與上述提到的早期產氣量偏低的原因相似。在青貯玉米與青貯菠蘿渣的混合發酵中,DMD隨著青貯菠蘿渣比例的增加而降低,與中性洗滌纖維的降解趨勢一致,與粗蛋白質的降解趨勢則相反;但組合飼料的DMD與NDFD、CPD的組合效應并未完全表現出一致性。其中75%比例青貯菠蘿渣組合中,DMD組合效應指數基本為負值(除3 h),25%~50%比例青貯菠蘿渣的CPD組合效應指數在發酵12~48 h時為負值,青貯菠蘿渣比例為25%在發酵12~24 h時NDFD也產生負組合效應指數。這可能與組合后木質素、粗灰分等不易降解成分含量增加有關(Mohamed-Laid et al.,2003)。而75%比例青貯菠蘿渣的CPD、NDFD在整個發酵過程中產生正組合效應(除DMD)。表明不同飼料的組合能彌補飼料部分營養成分的不足,一定程度上平衡發酵底物中的碳/氮比例,使得瘤胃微生物在利用飼料蛋白滿足自身生命活動的同時,增加飼料中碳水化合物的降解,有助于瘤胃微生物對飼料體外發酵的穩定性(周傳社等,2005)。
3.2 青貯玉米與青貯菠蘿渣組合對山羊體外瘤胃pH和揮發性脂肪酸的影響
pH是反映瘤胃內環境的重要指標,是影響瘤胃微生物生命活動的重要因素,該值受微生物代謝物(揮發性脂肪酸)及飼料營養成分組成等各種因素相互作用的影響。瘤胃中纖維分解菌(和)的最適環境pH為6.2~6.8(Tajima et al.,2001;盧德勛,2016)。纖維分解菌將纖維素發酵產生乙酸,進而被用于合成動物乳脂;丙酸是反芻動物合成葡萄糖的前體物;飼料消化產生的丁酸以酮體的形式被氧化(邵麗瑋等,2020)。本研究中,各試驗組pH隨青貯菠蘿渣比例增加呈無規律變化,發酵12~48 h時發酵液pH維持在6.44~6.88,均處在正常范圍內,說明發酵環境穩定,有利于微生物的生長代謝。而體外發酵3 h,各組pH均大于7.50,可能的原因與上述早期產氣量偏低的原因相同;同時與日糧改變影響瘤胃微生物數量及活性,從而影響瘤胃中揮發性脂肪酸產生的速度和數量,在TVFA及各揮發性脂肪酸濃度的試驗結果中也驗證了這一點。有研究結果表明日糧從干草換成谷物類糧食后第3 d,的DNA濃度下降20倍,則下降了飼喂干草的10%(Tajima et al.,2001)。而本研究中的雷州山羊主要采食皇竹草,與試驗發酵底物明顯不同。因此日糧改變瘤胃微生物產生一定影響需進一步的微生物試驗予以驗證。
揮發性脂肪酸作為反芻動物能量的主要物質來源,占能量總量的70%~80%;也是反映瘤胃發酵及微生物活力的重要參數之一。本研究中,各發酵時間點的各VFA濃度與TVFA濃度的變化趨勢一致。TVFA濃度隨發酵時間呈上升趨勢,與唐賽涌(2009)的研究結果基本一致,其中發酵48 h時TVFA濃度最高,此時各組發酵液pH最低,說明此時瘤胃微生物活性最高,飼料降解程度最高;同時在發酵后期(24~48 h),50%~75%比例青貯菠蘿渣組的各揮發性脂肪酸濃度與TVFA濃度均處于較高水平,可能是青貯玉米與青貯菠蘿渣產生了一定的正組合效應,從營養物質的構成分析,青貯菠蘿渣與青貯玉米組合的營養成分要比單一粗飼料的營養組成更合理,平衡了粗飼料營養成分,有利于瘤胃微生物的生長繁殖及其發酵。
3.3 青貯玉米與青貯菠蘿渣組合對組合效應的影響
反芻動物瘤胃是各種微生物共存且相對封閉的動態生物發酵系統,是反芻動物生長發育的重要營養來源場所。體外產氣法是通過人工技術模擬反芻動物瘤胃對攝入飼料中營養物質消化降解的一種方法,與體內法存在高度相關性,已被廣泛應用于評價飼料的營養價值(布同良,2006;王志敬,2017;吳征敏等,2018),但體外產氣法與反芻動物瘤胃對飼料的實際降解情況存在差異。因此,對于這種批式發酵模型(支梓鑒等,2016),單項組合效應指數難以對飼料價值作出全面評價,需引入多項組合效應指數,該值是對飼料的各個單項組合效應指數進行綜合評定,結果更能表明不同飼料組合之間的整體價值(李妍等,2017;葛瀚聰等,2019;吳征敏等,2019)。本研究通過將各發酵時間點DMD、CPD、NDFD、TVFA、乙酸、丙酸和丁酸進行單項組合效應指數對比與多項組合效應指數的疊加,從累積產氣量及其參數、模擬瘤胃體外發酵環境與飼料營養物質降解率等多方面綜合分析,發現適當比例的青貯玉米與青貯菠蘿渣組合優于單一粗飼料。其中50%~75%比例青貯菠蘿渣組的多項組合效應指數均為正值,25%比例的青貯菠蘿渣組的多項組合效應指數則出現負值;75%比例的青貯菠蘿渣組隨著發酵時間推移,多項組合效應指數呈明顯上升趨勢。說明青貯玉米與青貯菠蘿渣合理配比組合后,飼料間營養物質得到互補,提高了飼料的飼用品質。菠蘿渣作為新型非常規飼料資源,變廢為寶,應充分研究、開發和利用,以緩解人畜爭糧的矛盾和粗飼料緊張的局面。
4 結論
通過體外產氣法研究青貯玉米與青貯菠蘿渣的組合效應,以50∶50與25∶75組合時粗飼料具有較優的組合效應,其中比例為25∶75時多項組合效應指數最大,有助于瘤胃微生物生長代謝,提高營養物質的降解率。

