微生物菌劑對栽培基質微生物群落的影響
陳 臻,曾翠云,張永合,萬家秀
(1.蘭州資源環境職業技術大學環境與化工學院,甘肅蘭州 730021;2.甘肅中醫藥大學藥學院,甘肅蘭州 730000;3.西北中藏藥協同創新中心,甘肅蘭州 730000)
無土基質栽培有效地解決了以往設施農業與露地農業生產爭地的矛盾,實現了蔬菜對水分、肥料的高吸收。甘肅現代絲路寒旱農業區通過循環利用玉米秸稈等農業廢棄物,以及椰糠、草炭、牛糞等制作無土栽培基質,不僅解決了農業面源污染難題,而且實現了農果蔬結合、農牧互補和資源再利用的綠色循環發展。無土基質栽培已成為現代絲路寒旱農業生產的重要環節,現已在我國西北地區大面積推廣應用。由于基質是作物賴以生存的基礎,戈壁農業中作物生長發育所需要的養分、水分和土壤微生物都需從基質中獲得,尤其是土壤微生物與植物的生長和健康密切相關,是土壤肥力的重要組成部分和重要保障。
微生物菌劑是從土壤或植物體內經篩選、分離后得到的一類菌群,再經過發酵等一系列工業化處理將這些微生物擴增培養后加工成一種液態或固態的活菌制劑,將其應用到農作物上,能夠實現綠色無污染的現代化農業生產模式。木霉菌(spp.) 是自然界廣泛分布的生防真菌,其中的綠色木霉() 和哈茨木霉() 是常用的微生物菌劑。近年來研究發現,哈茨木霉協同秸稈處理對馬鈴薯土壤微生物群落有一定影響,尤其對真菌群落多樣性、群落結構組成影響較大。施用微生物菌劑有利于改善土壤的微生物結構,增加土壤細菌、放線菌的數量。
目前,關于河西走廊戈壁農業區無土栽培基質根際微生物現狀以及微生物菌劑施用后對基質的根部微生物群落等影響報道較少。為此,該研究以溫室大棚栽培土壤作為對照,對比其與栽培基質本身的微生物群落結構狀況;并通過在基質上施用哈茨木霉,探討微生物菌劑對基質微生物群落多樣性的影響,以期為戈壁生態農業無土栽培基質中微生物菌劑的應用提供理論依據。
1 材料與方法
供試植物。供試辣椒(L.)品種為螺絲椒,市場購買,生產廠家為河北茂華種業有限公司。
供試微生物菌劑。哈茨木霉,主要菌種為哈茨木霉菌(),有效活孢數≥10億/g,市場購買,生產廠家為北海亦強生物科技有限公司。
供試基質。基質購自酒泉康多生態農業科技發展有限公司,以有機質為主要原料,通過高溫發酵腐熟后,復配生物菌劑、草炭、珍珠巖,經自動化程序加工而成。其中有機質35%~45%,pH中性,腐殖酸15%~25%。
供試土壤。采自白銀區水川鎮樺皮川村農業示范園溫室大棚。
試驗于2021年3—6月在白銀市白銀區水川鎮樺皮川村農業示范園溫室大棚內進行,以基質栽培為處理1(T),以土壤栽培為處理2(T),定植時將哈茨木霉菌對水稀釋2 000倍后灌根,每株澆灌200 mL。設1個對照(CK),對照用清水噴施,其他栽培方式、條件相同。
取樣:在定植移栽后60 d,按五點取樣法采集0~20 cm土層基質(土壤)得到混合土樣。迅速將土樣保存于帶有冰袋的保溫箱中,帶回實驗室,于-20 ℃冰箱保存,備用。
采用 Power Soil DNA Isolation kit 提取試劑盒(MOBIO),稱取 0.5 g土樣,按試劑盒說明書分別提取供試土壤(T)、噴施哈茨木霉的栽培基質(T)和對照(CK)的 DNA。用 0.8% 瓊脂糖凝膠電泳對 DNA的質量進行檢測,測定DNA的純度和濃度。樣品總 DNA 提取后,對細菌16S rRNA V3-V4區和真菌18S rRNA V4區進行 PCR 擴增:細菌引物序列為341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′);真菌引物序列為V4F(5′-GGCAAGTCTGGTGCCAG-3′)和V4R(5′-ACGGTATCTRATCRTCTTCG-3′)。PCR 反應成分:Phusion DNA 聚合酶預混液 12.5 μL,上下引物各 2.5 μL,DNA 50 ng,補無菌水至 25 μL。PCR 擴增反應條件:98 ℃預變性 2 min;98 ℃變性 15 s,55 ℃退火30 s,72 ℃延伸30 s,25個循環;72 ℃ 延伸5 min。用 2% 的瓊脂糖凝膠電泳對 PCR 產物進行檢測,PCR 產物的回收采用 AXYGEN 公司的凝膠回收試劑盒,待測定后產物的濃度和特異性合格后,送生工生物工程(上海)股份有限公司測序。
利用 Uparse 軟件對所有有效序列按 97%相似度進行分類操作單元(operational taxonomic units,OTUs)劃分;然后選取每個 OTUs 中頻數最高的代表性序列,進行物種注釋,用 Mothur 方法將 OTUs 的代表序列與 SSUrRNA 數據庫進行物種注釋,最終獲得分類學信息。統計各個樣本的物種在門、綱、目、科、屬和種分類水平上的分類單元數量。運用QIIME2軟件計算各樣本微生物群落的α多樣性指數,以表征物種的豐富度、多樣性及均勻度。采用語言的Venn Diagram包繪制各分類學水平上的細菌和真菌基因序列的Venn圖。
2 結果與分析
從稀釋曲線(圖1)可以看出,從樣本中隨機抽取一定數量的序列,隨著抽取的測序數據量的增加,細菌和真菌稀釋曲線均基本趨于平緩,所有個體的深度測序指數(Coverage指數)在 0.996 9~0.999 7(表1),說明該研究的測序結果有足夠的測序數據量,能反映當前樣本所包含的多樣性。
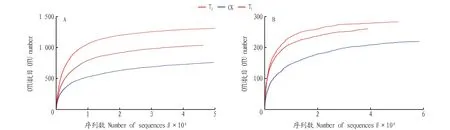
圖1 相似度為0.97條件下各土壤細菌(A)和真菌(B)的稀釋曲線Fig.1 The dilution curve of each soil bacteria (A) and fungi (B) under the condition that the similarity is 0.97
Chao1指數和Shannon指數代表了微生物群落結構的變化,Chao1指數越大,該樣本物種數越多;Shannon指數越大,群落多樣性越高。從表1可以看出,辣椒根際土壤(T)細菌的Chao1指數、Shannon指數均為最高,表明在不同的栽培介質中,土壤栽培的根際土壤細菌群落豐富度和多樣性大于栽培基質。施用哈茨木霉后處理(T)的細菌類群的Chao1指數和Shannon指數較未施用哈茨木霉(CK)分別提高了16.87%和6.48%,真菌類群(包括其他真核生物)分別提高了17.36%、42.33%,說明施用哈茨木霉后,栽培基質中的微生物群落多樣性和物種數量均有不同幅度的升高。
圖 2 表明,栽培土壤(T)、施用哈茨木霉的栽培基質(T)、對照(CK)共有的細菌 OTUs 數量為402,T、CK、T特有的 OTUs 數量分別為639、49、144,可見土壤的細菌OTUs 數量最多,哈茨木霉處理后的栽培基質細菌OTUs 數量高于對照;3種不同處理共有真菌的 OTUs 數量為117,而T、CK、T特有的真菌OTUs 數量分別為92、28、29,栽培土壤(T)的真菌群落的 OTUs數量仍為最高,哈茨木霉處理后的栽培基質(T)真菌OTUs數量略高于對照(CK)。
T、CK和T這3種處理根際土壤中共有24門64綱108目215科378屬細菌,其中T為21門59綱96目184科295屬,CK為20門51綱86目176科293屬,T為21門55綱95目194科333屬。在細菌的門、綱、目、科、屬水平,栽培土壤(T)均表現較高。施用哈茨木霉(T)后細菌類群高于對照(CK),分別增加了1門、4綱、9目、18科、40屬。各處理細菌群落在門分類水平上具有較高的多樣性,相對豐度位于前8的分別為變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria)、厚壁菌門(Firmicutes)、酸桿菌門(Acidobacteria)、浮霉菌門(Planctomycetes)、綠彎菌門(Chloroflexi)、疣微菌門(Verrucomicrobia),其他類群的相對豐度占比為19.81%。在T中變形菌門、擬桿菌門、酸桿菌門為優勢菌群,相對豐度分別為 31.55%、22.00%、15.47%;在CK中變形菌門、放線菌門、厚壁菌門為優勢菌群,相對豐度分別為 33.79%、22.63%、9.11%;在T中變形菌門、擬桿菌門、厚壁菌門為優勢菌群,相對豐度分別為 35.05%、27.68%、16.99%。施用哈茨木霉后,優勢菌群中變形菌門、厚壁菌門的相對豐度分別增加了3.73%、86.50%(圖3)。
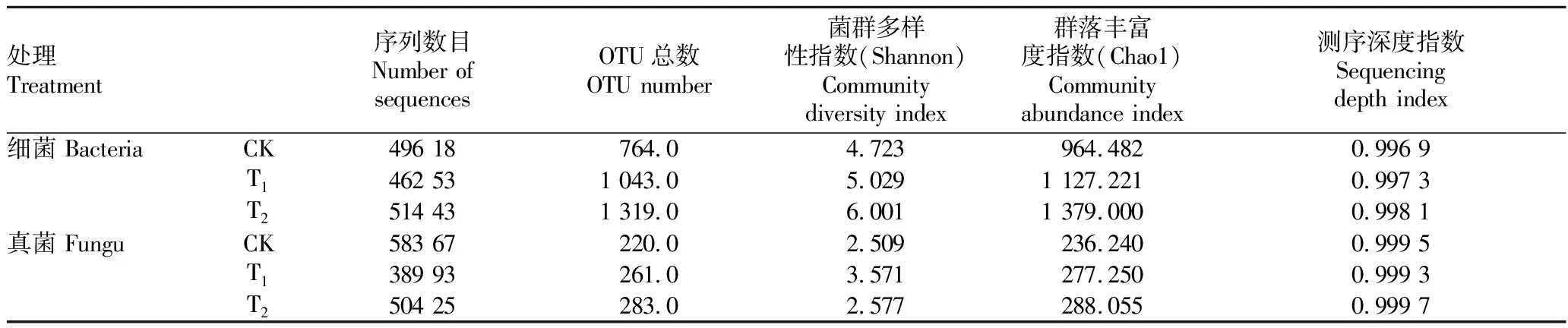
表1 哈茨木霉處理后辣椒根際土壤細菌、真菌群落多樣性指數
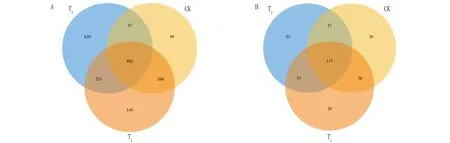
圖2 不同處理辣椒根際土壤細菌(A)和真菌(B)群落的OTUs韋恩圖Fig.2 Venn diagrams of OTUs of bacterial (A) and fungal (B) communities in the rhizosphere soil of pepper under different treatments
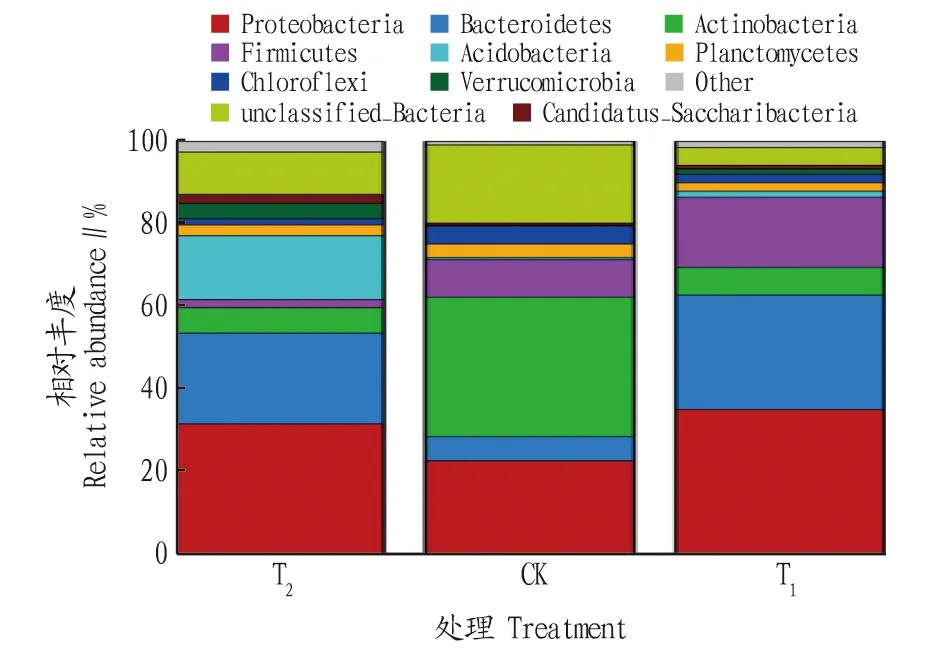
圖3 不同處理辣椒根際土壤細菌群落在門水平上的相對豐度Fig.3 Relative abundance of bacterial communities in the rhizosphere soil of pepper under different treatments at the phylum level
T、CK和T這3種處理根際土壤中共有4門8綱12目14科16屬17種真菌,其中在真菌的門、綱、目、科水平均相同;在屬水平上,T最少,為13屬,CK和T均為16屬;在種水平上,T最少,為12種,CK和T均為17種。施用哈茨木霉(T)真菌類群和對照(CK)數量無變化。各處理真菌群落在門分類水平上具有較高的多樣性,相對豐度位于前4的土壤真菌群落分別為子囊菌門(Ascomycota)、壺菌門(Chytridiomycota)、毛霉門(Mucoromycota)、擔子菌門(Basidiomycota)。其中CK中相對豐度子囊菌門占59.54%,壺菌門、毛霉門、擔子菌門分別占0.52%、4.85%、0.28%;T中相對豐度子囊菌門占42.20%,壺菌門、毛霉門、擔子菌門分別占3.88%、0.30%、4.11%。施用哈茨木霉后,優勢菌群有增有減,子囊菌門和毛霉門相對豐度分別減少了29.12%和93.81%,壺菌門和擔子菌門相對豐度分別增加了6.5和13.7倍(圖4)。
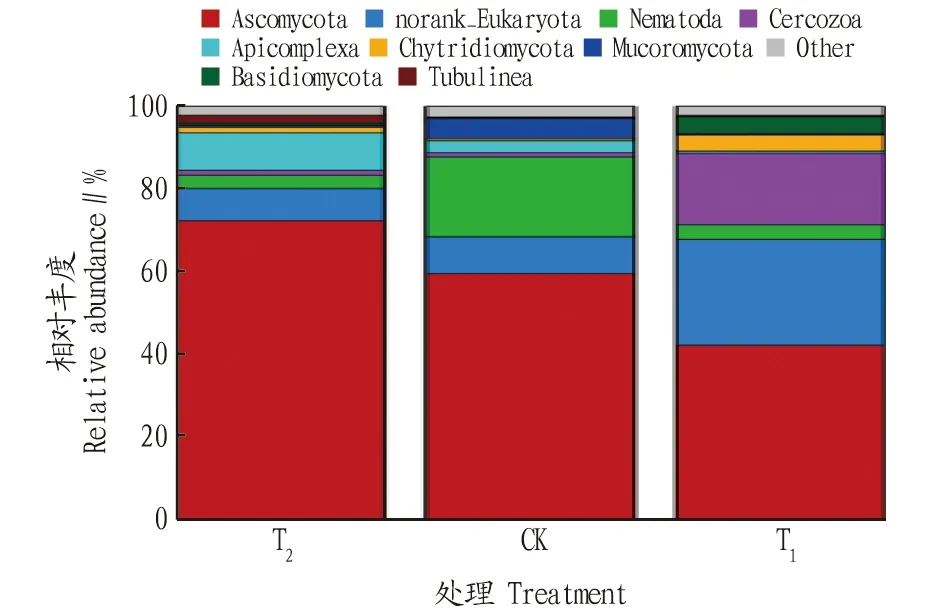
圖4 不同處理辣椒根際土壤真菌群落在門水平上的相對豐度Fig.4 Relative abundance of fungal communities in the rhizosphere soil of pepper under different treatments at the phylum level
3 討論
土壤微生物能分解土壤中的動植物殘體,形成有機質,是最豐富最全面的植物營養來源,有益微生物與根系形成互補共生關系。無土栽培基質在使用前都經過高溫滅菌,基質中含有微生物很少,但在作物栽培過程中,許多微生物會通過各種途徑進入基質。在該研究中,溫室大棚中原有栽培土壤中微生物群落不論是細菌還是真菌群落的豐富度和多樣性均高于栽培基質,在施用哈茨木霉后,栽培基質中的微生物群落多樣性呈現顯著提升,說明微生物菌劑可對基質的改良起到較好的促進作用。近年來,微生物菌劑的應用越來越廣泛,多種微生物制劑在作物上取得了較好的效果,施用微生物菌肥和菌劑能促進農作物生長,增加產量,提高品質,增加有益菌豐度,減少病原菌豐度,改變土壤微生物群落結構,改善土壤微環境。也有研究表明,微生物菌劑對土壤微生物群落多樣性的影響并不明顯,但顯著改變了土壤微生物群落組成,土壤微生物群落通過影響土壤碳、磷循環的微生物酶活性,從而間接地影響作物產量。
施用微生物菌劑對土壤細菌群落和真菌群落會產生不同的影響。據報道,微生物菌劑的添加對草莓土壤細菌群落結構產生了顯著影響,增加了厚壁菌門細菌的相對豐度,但對真菌的作用不明顯。不同的微生物菌劑對土壤微生物群落影響也不同,施用枯草芽孢桿菌()后,華重樓根際土壤細菌豐富度和多樣性顯著下降,而解淀粉芽孢桿菌()對細菌豐富度和多樣性無顯著影響,2種微生物菌劑均對根際土壤中真菌數量的影響不顯著。長枝木霉處理會增加根際玉米土壤細菌群落數量,但會減少真菌群落數量。施入木霉制劑后,茉莉根圍土壤中細菌和真菌的數量顯著提高。在該研究中,施用哈茨木霉后,基質細菌類群較對照分別增加了1門、4綱、9目、18科、40屬,優勢菌群中變形菌門、厚壁菌門的相對豐度分別增加了3.73%、86.50%;基質真菌類群中優勢菌群中子囊菌門和毛霉門相對豐度分別減少了29.12%和93.81%,壺菌門和擔子菌門相對豐度分別增加了6.5和13.7倍,但在屬和種的水平上基本沒有變化,這與前期相關學者的研究結果基本一致。施用微生物菌劑,可以通過調節土壤微生物群落結構和組成,使其中功能菌和激發的關鍵微生物來增加作物產量,同時還能夠提高根際土壤微生物群落代謝能力,促進土壤微生物群落對碳源的整體利用,增強代謝活性,提高作物品質、改善土壤肥力。因此,未來微生物菌劑在基質改良、綠色生產中有廣泛的應用前景。
4 結論
該試驗通過研究栽培土壤與栽培基質之間微生物群落結構及多樣性差異,以及施用微生物菌劑后對栽培基質微生物群落的影響,發現農田栽培土壤的根際土壤細菌和真菌群落豐富度和多樣性高于栽培基質,微生物菌劑的施用顯著提升了栽培基質細菌類群,但對栽培基質的真菌類群影響較小。這些結果為認識無土栽培基質種植帶來的根際微生態問題提供了新的視角,可為戈壁農業科學種植農作物、高質量持續發展提供理論依據。

