LASS2通過AMPKα/mTORC1信號通路誘導HepG2肝癌細胞自噬和凋亡*
黎 兵,何 維,向加林,楊 艷,楊小理△
1.遵義醫(yī)科大學附屬醫(yī)院醫(yī)學檢驗科,貴州遵義 563000;2.遵義醫(yī)科大學檢驗醫(yī)學院,貴州遵義 563000
原發(fā)性肝癌是全球最常見的惡性腫瘤之一,每年新確診的肝癌病例數位居惡性腫瘤第6位[1]。在我國,肝癌患者的5年生存率僅為14.1%[1],是僅次于胰腺癌的第2大致死癌癥。盡管近年來肝癌的治療取得了很大進展,但其治療的選擇和臨床結局仍很有限。由于肝癌在遺傳、代謝、分子機制及臨床癥狀方面存在極大的異質性,使得其早期診斷和癌基因靶向治療的設計極具挑戰(zhàn)性。一些研究試圖闡明肝癌細胞產生和存活的潛在機制,因為這些研究可以為肝癌的治療提供新的干預措施或靶點。細胞生存和死亡之間的平衡對體內穩(wěn)態(tài)至關重要,其中自噬起重要作用[2]。自噬是一個高度保守的分解代謝過程,它可以循環(huán)利用胞內成分來保護細胞,同時也可以在一定條件下殺死細胞[3]。研究表明,自噬在肝癌的發(fā)生和進展中可能發(fā)揮雙刃劍的作用,靶向自噬或與其他化療藥物聯合阻斷自噬可能是治療肝癌的潛在策略[4]。
LAG1長壽保證基因2(LASS2),又被稱為腫瘤轉移抑制基因1(TMSG-1)、神經酰胺合酶2(CERS2),在肝癌[5]、乳腺癌[6]、膀胱癌[7]等惡性腫瘤的浸潤和生長發(fā)揮抑癌作用。LASS2能通過促進神經酰胺的合成誘導肺上皮細胞保護性自噬[8]。本課題組前期研究發(fā)現LASS2過表達增加了HepG2胞內活性氧(ROS)[9],最新的研究表明ROS可作為第二信使直接參與細胞存活的調節(jié),并能誘導自噬的發(fā)生[10]。然而LASS2過表達是否激活HepG2肝癌細胞的自噬并影響其存活,目前未見相關報道。本研究以HepG2肝癌細胞株為研究模型,檢測LASS2過表達對HepG2細胞自噬、凋亡的影響及探討其可能的信號通路。
1 材料與方法
1.1實驗材料與儀器 HepG2購自中科院上海細胞庫;Adv-GFP、Adv-LASS2-GFP重組腺病毒由北京百奧川生物科技有限責任公司合成;DMEM培養(yǎng)基、胎牛血清(FBS)購自Gibco公司;單磷酸腺苷活化蛋白激酶(AMPK)α、p-AMPKα、Raptor、p-Raptor、Beclin-1、LC3A/B一抗購自CST公司;GAPDH、SQSTM1、BCL2、Bax一抗購自華安生物技術有限公司;Trizol(總RNA抽取試劑盒)、實時熒光定量反轉錄PCR(qRT-PCR)試劑購自TAKARA寶日醫(yī)生物技術有限公司;全蛋白提取試劑盒購自凱基生物技術有限公司;BCA蛋白定量試劑盒購自上海雅酶生物科技公司;LASS2抗體購自Abcam公司;Annexin Ⅴ-APC/7AAD凋亡檢測試劑盒購自江蘇凱基生物技術股份有限公司;FACSA Ⅱ流式細胞儀(FACS Calibur型,BD公司);Chemi-DocTM凝膠成像系統購自Bio-Rad公司。
1.2實驗方法
1.2.1細胞培養(yǎng)與轉染 HepG2肝癌細胞采用含10%FBS的DMEM培養(yǎng)基、置于37 ℃、5%CO2培養(yǎng)箱中培養(yǎng)。將HepG2細胞分為3組:空白對照組(n=3)、空載組(n=3,重組腺病毒Adv-GFP感染細胞)和實驗組(n=3,重組腺病毒Adv-LASS2-GFP感染細胞),轉染48 h后根據各實驗目的進行收集樣品。所有實驗重復3次。
1.2.2qRT-PCR檢測LASS2 mRNA表達情況 感染48 h后,提取各組細胞總RNA,測定RNA濃度與純度,并逆轉錄合成cDNA,儲存于-80 ℃冰箱中待用。以β-actin作為內參,qRT-PCR檢測分析LASS2 mRNA相對表達水平(反應條件:95 ℃、30 s;95 ℃、5 s;60 ℃、34 s,40個循環(huán);融解曲線:95 ℃、15 s;60 ℃、60 s;95 ℃、15 s),以2-ΔΔCt計算基因相對表達量。目的基因引物序列:β-actin上游5′-TCCTGTGGCATCCACGAAACT-3′,下游5′-GAAGCATTTGCGGTGGACGAT-3′;LASS2上游5′-ATCGTCTTCGCCATTGTT-3′,下游5′-CGGTCACTGCGTTCATCT-3′。
1.2.3CCK-8法檢測細胞增殖能力 將呈對數生長的HepG2細胞接種至96孔板中,次日感染Adv-GFP、Adv-LASS2-GFP,分別在感染0、24、48、72 h,加入100 μL DMEM以及10 μL CCK-8試劑,37 ℃孵育2 h后,于酶標儀450 nm處測定各吸光度(A)值并制作生長曲線。
1.2.4Annexin V-APC/7 AAD雙染色檢測細胞凋亡 感染48 h后,采用不含EDTA的0.25%胰蛋白酶消化并收集各組HepG2細胞,嚴格按試劑說明書操作,用冷PBS洗滌2次,收集細胞、加入500 μL的Binding Buffer重懸細胞,依次添加5 μL Annexin V-APC和5 μL 7-AAD,充分混勻并在室溫下避光孵育15 min后,置于流式細胞儀檢測并采用Cell Quest軟件分析各組細胞凋亡率。
1.2.5Western blot法檢測各組細胞LASS2、自噬、凋亡相關蛋白及AMPKα/哺乳動物雷帕霉素靶蛋白復合物1(mTORC1)信號通路相關蛋白的相對表達水平 轉染48 h后,按照全蛋白提取試劑盒說明書提取各組細胞總蛋白,BCA法定量蛋白濃度,經蛋白變性、分裝并暫存于-80 ℃。每個泳道上樣量為20 μg,10%或12.5%SDS-PAGE分離各組細胞蛋白并電轉至PVDF膜。5%脫脂牛奶在室溫下封閉2 h,4 ℃一抗(參照各一抗廠家推薦稀釋比)孵育過夜。二抗(羊抗鼠、羊抗兔二抗稀釋倍數均為1:5 000)室溫孵育2 h,洗膜、成像,測量條帶灰度值并統計數據,計算LASS2、BCL2、Bax、SQSTM1、Beclin-1、LC3A/B、t-AMPKα、p-AMPKα、t-Raptor、p-Raptor蛋白相對表達量。

2 結 果
2.1LASS2在HepG2肝癌細胞過表達的驗證 實驗組LASS2 mRNA、蛋白相對表達水平較空白對照組、空載組明顯上調(P<0.001),LASS2 mRNA相對表達水平較空白對照組上調51.6倍,其蛋白表達水平上調40倍,而空白對照組和空載組比較差異無統計學意義(P>0.05)。
2.2過表達LASS2對HepG2肝癌細胞增殖的抑制作用 與空白對照組、空載組比較,實驗組細胞活力在24 h差異無統計學意義(P>0.05),而48 h、72 h的細胞活力分別為空白對照組的(57.6±3.0)%和(23.8±0.3)%,差異均有統計學意義(P<0.001);空白對照組和空載組細胞活力比較差異無統計學意義(P>0.05)。這表明過表達LASS2抑制了HepG2肝癌細胞增殖的,見圖1。
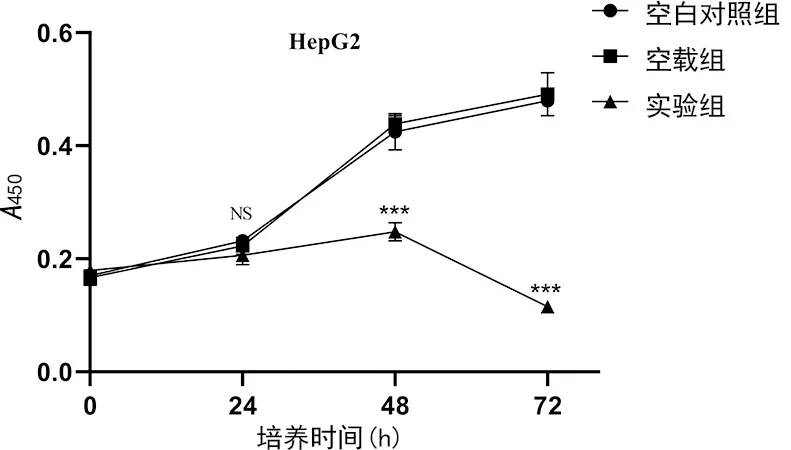
注:與對照組及空載組比較,***P<0.001。
2.3過表達LASS2對HepG2肝癌細胞凋亡的影響 實驗組細胞凋亡率明顯高于對照組,差異有統計學意義(均P<0.001),空白對照組和空載組未見明顯統計學差異(P>0.05)。

表1 流式細胞術檢測HepG2各組細胞的凋亡率
2.4過表達LASS2對HepG2細胞中凋亡相關蛋白的影響 與空白對照組、空載組相比,實驗組凋亡相關蛋白BCL2相對表達水平明顯下調(P<0.001),同時Bax蛋白相對表達水平明顯上調(P<0.001),空白對照組與空載組比較差異無統計學意義(P>0.05),這表明過表達的LASS2促進HepG2肝癌細胞凋亡,見圖2。
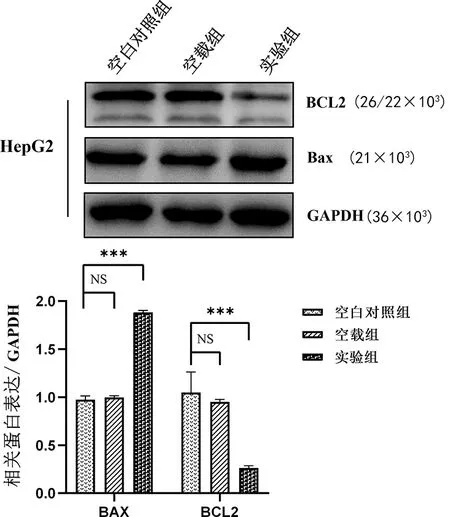
注:與空白對照組及空載組比較,***P<0.001;NS表示差異無統計學意義。
2.5過表達 LASS2對HepG2細胞自噬相關蛋白Beclin-1、LC3A/B 、SQSTM1的影響 與空白對照組、空載組相比,實驗組SQSTM1蛋白相對表達水平明顯較低(P<0.001),而Beclin-1、LC3A/B蛋白表達水平均明顯上調(P<0.001);空白對照組和空載組比較差異無統計學意義(P>0.05)。見圖3。

注:與空白對照組及空載組比較,***P<0.001;NS表示差異無統計學意義。
2.6LASS2誘導HepG2細胞自噬和凋亡與AMPKα/mTORC1信號通路的關系 與空白對照組、空載組相比,實驗組p-AMPKα/t-AMPKα的比值和p-Raptor/t-Raptor比值均明顯上調(P<0.001),空白對照組和空載組比較差異無統計學意義(P>0.05),見圖4。
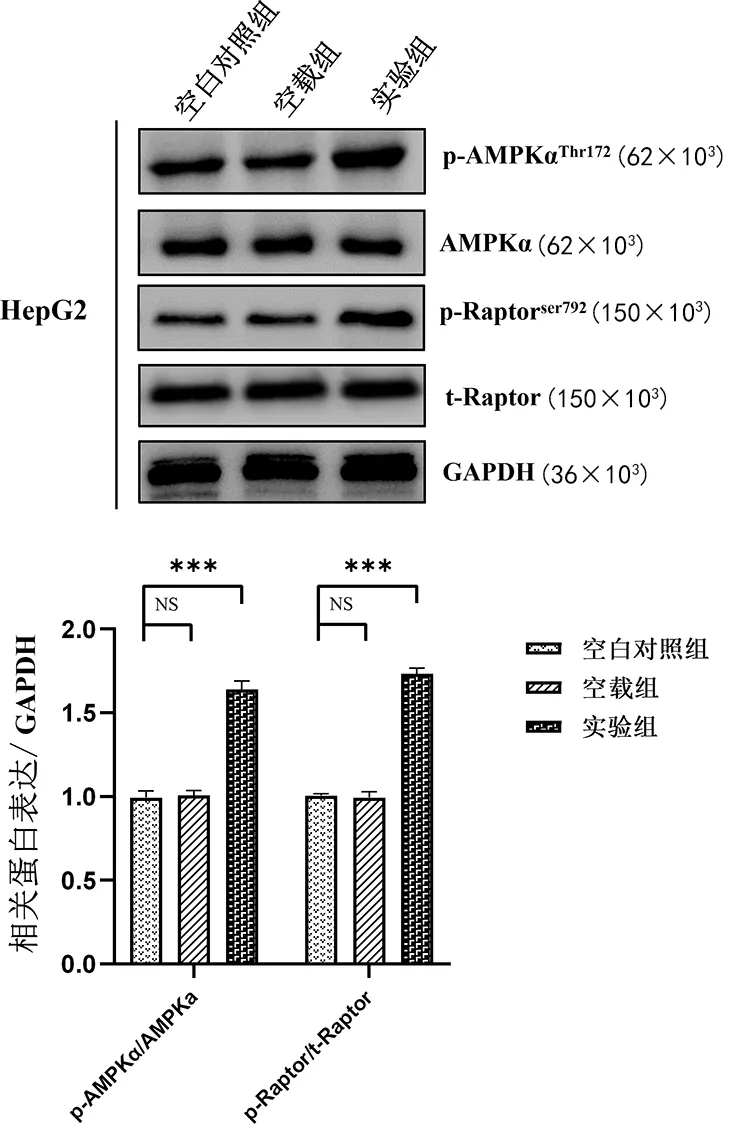
注:與空白對照組及空載組比較,***P<0.001;NS表示差異無統計學意義。
3 討 論
多數研究認為LASS2是一個抑癌基因,在腫瘤細胞增殖、侵襲和遷移起抑制作用并可促其凋亡。SU等[11]研究提出TMSG1/LASS2可能通過caspase依賴的線粒體途徑抑制HEK293和293T細胞增殖,誘導細胞凋亡。本課題組前期研究發(fā)現,LASS2過表達可促HepG2肝癌細胞、Hepa1-6肝癌細胞ROS生成增多[9,12]。然而,內源性ROS主要在線粒體或由還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶產生,線粒體是否存在LASS2的作用靶點本課題組對此進行了深入研究,并率先揭示LASS2可能與線粒體復合物Ⅰ活性主要調節(jié)因子——NDUFS2相互作用介導了線粒體活性氧(mtROS)的生成[12]。而mtROS的積累可使線粒體膜通道開放并影響線粒體的功能,研究認為線粒體功能的嚴重損害可引起自噬、凋亡[13]。
在本課題前期研究中證實了LASS2過表達使HepG2肝癌細胞線粒體膜電位下降,且胞內Ca2+超載,線粒體功能受損,但是否激活細胞凋亡信號通路和自噬需進一步研究證實。在本研究中,流式細胞術分析及Western blot結果表明,過表達的LASS2顯著促進HepG2肝癌細胞凋亡并上調其Bax蛋白、降低BCL2蛋白的表達,提示LASS2通過調控線粒體相關內源性凋亡途徑介導肝癌細胞程序性死亡。有研究表明,下調LASS2導致神經母細胞瘤細胞系SMS-KCNR細胞發(fā)生自噬和未折疊蛋白反應[14]。不同的是,在關于心肌細胞損傷的研究中,LASS2的過度表達導致VLC神經酰胺升高,導致胰島素抵抗、氧化應激、線粒體功能障礙和線粒體自噬[15]。然而,自噬在癌癥中的作用仍不清楚,因為它可以作為腫瘤的啟動子或抑制劑。QU等[16]研究發(fā)現Beclin-1雜合子小鼠和肝臟特異性Atg5 KO小鼠在衰老時發(fā)生自發(fā)性肝腫瘤,提供了支持自噬在肝腫瘤中抑制作用的證據。本研究結果提示:LASS2過表達促使HepG2肝癌細胞中Beclin-1、LC3A/B蛋白相對表達水平增加,自噬底物蛋白SQSTM1表達降低,激活HepG2肝癌細胞自噬。這與LAW等[15]研究報道相同,與STEFKA等[14]的研究不符,這可能與不同癌癥類型和遺傳背景有關。越來越多的研究揭示,細胞凋亡調節(jié)與自噬誘導之間存在深層聯系,在每個過程的不同階段都發(fā)生串擾[17],而這種串擾是癌癥發(fā)病機制的基礎,也是肝癌治療有希望的靶點之一。筆者推測LASS2促HepG2肝癌細胞凋亡并激活自噬,兩者相互促進癌細胞程序性死亡,這將為肝癌的臨床前治療選擇提供參考資料。
基于本課題前期研究基礎“LASS2過表達促ROS生成增加”,本研究進一步探討過表達LASS2激活自噬、凋亡的可能信號通路。自噬的激活受營養(yǎng)/能量傳感器的兩個關鍵組成部分AMPK和mTORC1的調節(jié)。mTORC1是mTOR激酶與mTOR調節(jié)相關蛋白、MLST8、PRAS40和DEPTOR等亞基形成的復合物,是自噬的主要調節(jié)因子,還直接調節(jié)自噬過程的后續(xù)步驟[18]。激活的AMPK也可以通過Raptor磷酸化抑制mTORC1的活性,進而啟動自噬,且兩者之間存在一個必不可少的雙重負反饋機制,對自噬的適當動態(tài)特性至關重要[19]。本研究結果表明LASS2過表達激活AMPKα,促使Raptor磷酸化抑制mTORC1的活性,結合本課題前期研究結果[12], NDUFS2作為氧感知器及線粒體復合物I產生ROS的主要靶點之一,LASS2與其互相作用介導了mtROS的生成,而mtROS作為第二信使通過AMPKα亞基直接激活AMPK及下游級聯信號如mTORC1信號通路,這可能是LASS2激活HepG2自噬的機制,這一結果的發(fā)現是不同于既往研究的。最近的研究表明,AMPK通過刺激不同的細胞過程,如凋亡、自噬、細胞生長和增殖,通過各種信號分子發(fā)揮腫瘤抑制活性[20],mTOR(尤其是mTORC1)信號的過度激活與致癌細胞過程有關[18]。因此,本研究推測AMPKα/mTORC1(Raptor)信號通路是LASS2激活HepG2肝癌細胞自噬和凋亡的關鍵信號通路,也是LASS2抑制肝癌進程的可能機制,將會在后續(xù)研究中證實這一科學假設。
綜上所述,LASS2可能通過AMPKα/mTORC1信號通路誘導HepG2肝癌細胞自噬和凋亡,但具體作用機制有待后續(xù)深入研究,這可能為肝癌的治療提供新的理論基礎或新的策略。

