CypD敲除對衰老小鼠代謝狀態及鐵死亡的影響
劉凱,王建寧
1山東大學齊魯醫學院,山東濟南 250033;2山東第一醫科大學第一附屬醫院(山東省千佛山醫院)泌尿外科,山東濟南 250033
肥胖、糖尿病等代謝性疾病的發病率隨著年齡的增長逐漸升高,給社會經濟造成巨大負擔。代謝性疾病發病機制復雜,線粒體功能紊亂是其發生發展的重要機制。CypD是線粒體通透性轉換孔的重要元件,其表達量增加會導致線粒體通透性轉換孔過度開放,導致線粒體水腫,影響線粒體功能,從而導致細胞整體氧化應激增加[1]。研究顯示,CypD與代謝性疾病和衰老密切相關:CypD在代謝相關脂肪性肝病中表達升高[2];CypD敲除會延長小鼠的壽命[3];CypD敲除會改善衰老小鼠的阿爾茨海默病[4]。鐵死亡是新近發現的一種細胞死亡方式,其特征是鐵依賴性脂質過氧化物累積到致死水平[5]。鐵死亡在衰老機體中增加,導致衰老細胞的高氧化應激狀態從而促進衰老[6]。并且,鐵死亡也參與并促進了代謝性疾病的發生發展[7]。目前尚無研究報道CypD對衰老小鼠代謝狀態的影響以及CypD敲除是否會改變衰老小鼠的鐵死亡。為進一步深入探討,2019年8月—2021年12月,本研究觀察了CypD敲除對衰老小鼠能量代謝和糖代謝的影響,同時觀察了CypD敲除對衰老小鼠代謝器官(肝臟和肌肉)鐵死亡水平的影響。
1 材料與方法
1.1 材料SPF級6周齡的雄性CypD全身敲除小鼠和同窩野生型對照(C57BL/6),均來自山東省千佛山醫院中心試驗室動物實驗中心(SPF級)。飼料購自北京科澳協力飼料有限公司,基因型鑒定試劑購自天根生化科技有限公司,引物合成自北京六合華大基因科技有限公司,重組人胰島素注射液(40 U/mL)購自江蘇萬邦生化醫藥股份有限公司,丙酮酸鈉購自Sigma-Aldrich,普魯士藍染色試劑盒購自北京索萊寶科技公司,Gpx4抗體購自Abcam公司,Gapdh抗體及Western blotting二抗購自Proteintech公司。
1.2 動物分組及處理方法將CypD敲除小鼠和同窩野生型對照分別命名為CypD KO組和對照組,各10只,兩組小鼠喂養前體質量沒有差異,具有可比性。在SPF環境里普通飼料喂養14個月后,每組各有2只自然死亡,對存活的小鼠分別進行各種代謝狀態觀察和鐵死亡指標檢測。
1.3 小鼠代謝狀態觀察
1.3.1 體質量和飲食喂養14個月后,記錄CypD KO組和對照組各8只小鼠最終體質量和每周的進食量。
1.3.2 呼吸交換率(RER)、產熱和活動度隨機取CypD KO組和對照組各4只小鼠,將小鼠提前在代謝籠(一種特殊設計的為采集實驗動物各種排泄物質的密封式飼養籠)適應24 h后開始記錄數據,首先記錄小鼠的體質量和去脂體質量,輸入代謝籠分析系統以獲得體質量校正后的數據。利用曲線圖和曲線下面積(AUC)分別展示整體和黑暗期、光照期的RER、產熱、活動度數據。
1.3.3 糖代謝指標
1.3.3.1 空腹血糖檢測CypD KO組和對照組各取8只小鼠,在干凈籠子里禁食18 h,在安靜狀態剪掉1~2 mm尾端后輕輕擠壓小鼠尾巴,擠出一滴血用血糖儀檢測基礎血糖值。
1.3.3.2 糖耐量試驗CypD KO組和對照組各取8只小鼠,在干凈籠子里禁食18 h,稱量體質量后按照2 g葡萄糖/kg體質量的標準腹腔注射20%的葡萄糖溶液,記錄小鼠0、30、60、90、120 min的血糖值。
1.3.3.3 胰島素敏感性試驗CypD KO組和對照組各取6只小鼠,在干凈籠子里禁食2 h,按照每20 g體質量注射200 μL胰島素的量進行腹腔注射,記錄小鼠0、15、30、60、90 min的血糖值。
1.3.3.4 丙酮酸耐量試驗CypD KO組和對照組各取6只小鼠,在干凈籠子里禁食8 h,按照2 g葡萄糖/kg體質量的標準腹腔注射20%的丙酮酸鈉溶液,記錄0、30、60、90 min的血糖值。
1.4 鐵死亡指標檢測
1.4.1 普魯士藍染色CypD KO組和對照組小鼠麻醉后,眼球取血,隨后兩組各取3只小鼠的肝臟,4%多聚甲醛固定、脫水、石蠟包埋后制作肝臟的石蠟切片,按照說明書,切片脫蠟至水后放入Perls stain染色30 min,蒸餾水充分沖洗后,用伊紅染液淡染細胞核15 s,自來水沖洗5 s后脫水、透明、封固。油鏡(×100倍)下拍照觀察。
1.4.2 Gpx4蛋白檢測采用Western blotting法。CypD KO組和對照組小鼠麻醉后,眼球取血,隨后各取8只小鼠的肝臟、右側腓腸肌組織,置于-80℃冰箱凍存。提取小鼠肝臟、肌肉組織蛋白,BCA法測蛋白水平。配制12%的分離膠,電泳、轉膜后5%牛奶室溫封閉1 h,一抗Gpx4(1∶1 000)及內參Gapdh(1∶7 500)搖床4℃孵育過夜;次日TBST洗膜后二抗室溫孵育1 h,化學發光法顯影分析。
1.5 統計學方法采用SPSS22.0統計軟件。計量資料以±s表示,組間比較采用獨立樣本t檢驗或重復測量方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 兩組基本情況、體質量和進食量比較存活的兩組小鼠外觀差異不明顯,都表現出衰老小鼠的特征。CypD KO組小鼠體質量為(29.38±1.32)g低于對照組(31.86±1.21)g(P<0.05);CypD KO組小鼠每周進食量為(17.3±0.97)g,與對照組(18.24±1.00)g相比差異無統計學意義(P>0.05)。
2.2 兩組RER、產熱和活動度比較兩組代謝籠數據都呈現有規律的晝夜節律。RER AUC比較,黑暗期CypD KO組高于對照組(P<0.05),光照期兩組沒有統計學差異(P>0.05);產熱AUC比較,光照期CypD KO組高于對照組(P<0.05),黑暗期兩組沒有統計學差異(P>0.05);活動度AUC比較,黑暗期和光照期兩組均沒有統計學差異(P>0.05)。代謝籠3 d光照期和黑暗期不同時段RER、產熱和活動度曲線和AUC比較分別見圖1~3和表1。
表1 兩組3 d光照期和黑暗期不同時段RER、產熱和活動度AUC比較(±s)
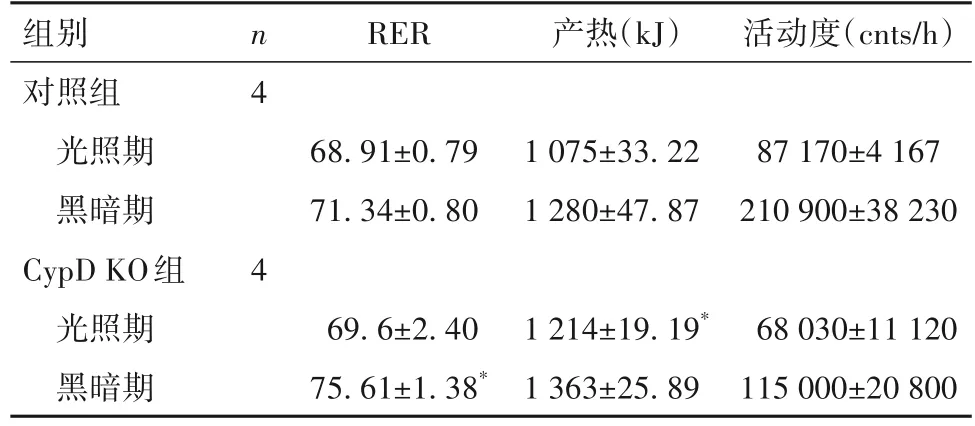
表1 兩組3 d光照期和黑暗期不同時段RER、產熱和活動度AUC比較(±s)
注:與對照組相比,*P<0.05。
組別對照組光照期黑暗期CypD KO組光照期黑暗期n 4 4 RER 產熱(kJ)活動度(cnts/h)68.91±0.79 71.34±0.80 1 075±33.22 1 280±47.87 87 170±4 167 210 900±38 230 68 030±11 120 115 000±20 800 69.6±2.40 75.61±1.38*1 214±19.19*1 363±25.89
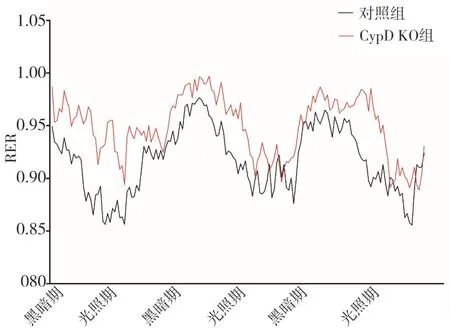
圖1 兩組3 d光照期和黑暗期不同時段RER曲線比較
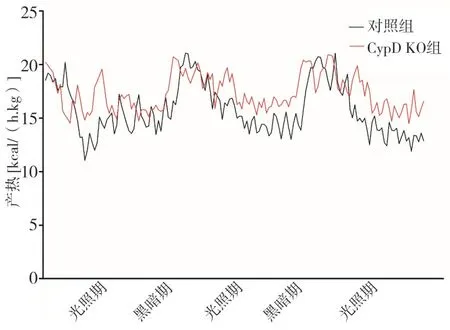
圖2 兩組3 d光照期和黑暗期不同時段產熱曲線比較
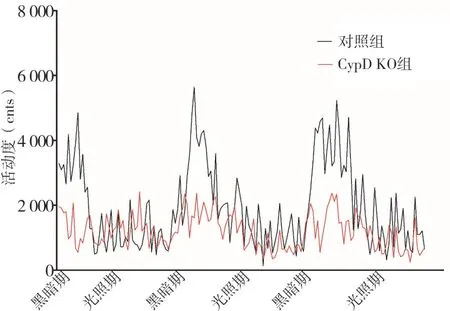
圖3 兩組3 d光照期和黑暗期不同時段活動度曲線比較
2.3 兩組糖代謝指標比較
2.3.1 糖耐量比較CypD KO組糖耐量AUC為(759.9±178.4)mmol/(L·min),低于對照組[(1 347±94.57)mmol/(L·min)](P<0.01)。CypD KO組0、30、90、120 min血糖值低于對照組(P均<0.05)。見圖4。

圖4 兩組糖耐量不同時點血糖值比較
2.3.2 胰島素敏感性比較CypD KO組胰島素敏感性AUC為(436.4±73.85)mmol/(L·min),低于對照 組[(657.5±46.16)mmol/(L·min)](P<0.01)。CypD KO組0、15、30、90 min血糖值低于對照組(P均<0.05)。見圖5。

圖5 兩組胰島素敏感性不同時點血糖值比較
2.3.3 丙酮酸耐量比較CypD KO組丙酮酸耐量AUC為(471.8±38.67)mmol/(L·min),低于對照組[(625.5±17.18)mmol/(L·min)](P<0.01)。CypD KO組0、30、60 min血糖值低于對照組(P均<0.05)。見圖6。
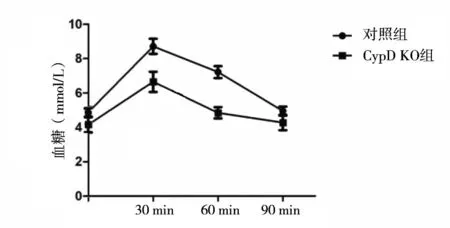
圖6 兩組丙酮酸耐量不同時點血糖值比較
2.4 兩組肝臟鐵死亡指標比較
2.4.1 肝臟普魯士藍染色比較對照組衰老小鼠鐵沉積比較嚴重,染色結果為密集的點狀伴隨塊狀的鐵沉積,而CypD KO組的鐵沉積為細小的顆粒狀且無團塊。見圖7。

圖7 肝臟普魯士藍染色結果(×100倍)
2.4.2 Gpx4蛋白檢測比較CypD KO組肝臟組織Gpx4的相對表達量為1.10±0.058,高于對照組的0.90±0.029(P<0.05)。CypD KO組肌肉組織Gpx4的相對表達量為1.07±0.15,低于對照組的1.12±0.13,兩組比較差異無統計學意義(P>0.05)。見圖8。
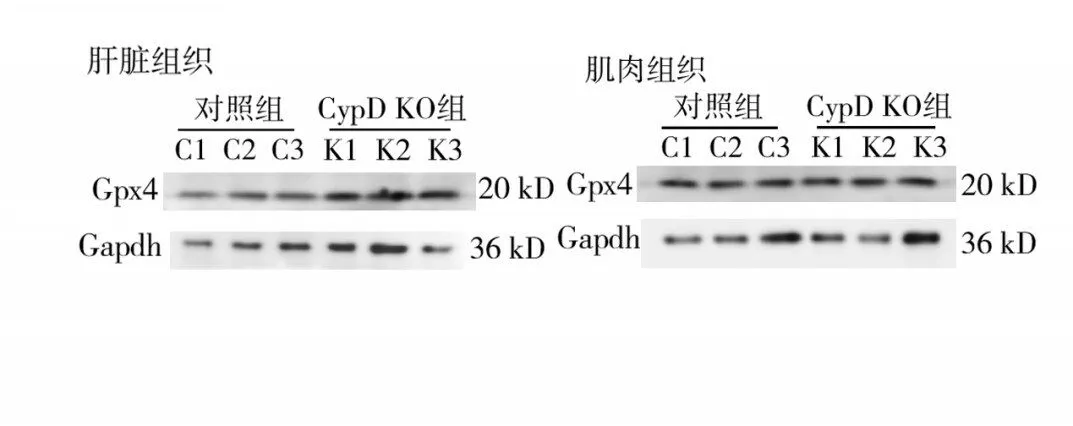
圖8 肝臟組織和肌肉組織Gpx4的Western blotting法檢測顯示條帶
3 討論
衰老是代謝性疾病的重要因素之一,利用衰老小鼠模型可以觀察各種因素對衰老狀態下代謝指標的影響。線粒體功能障礙是多種疾病的重要發病機制,已有研究顯示線粒體功能紊亂與衰老具有密切聯系,衰老會導致線粒體通透性轉換孔開放增加,進而出現水腫、功能障礙,最終產生大量活性氧中介物(ROS),導致細胞整體的氧化應激水平增加[8]。CypD作為線粒體通透性轉換孔的重要元件,其表達量增加會導致線粒體通透性轉換孔過度開放;CypD敲低或者敲除的模型中線粒體通透性轉換孔開放減少,細胞整體的氧化應激水平也會隨之降低。鐵死亡是以鐵依賴的脂質過氧化為特征[9],線粒體在鐵死亡的發生發展中也發揮了重要作用。
本研究顯示,CypD敲除小鼠(CypD KO組)體質量較野生型衰老小鼠(對照組)低,但每周進食量無統計學差異,推測是CypD敲除小鼠能量消耗更多導致。代謝籠是測量動物能量收支的實驗方法,其中,RER是二氧化碳產生量和耗氧量的比值,反映的是供能所消耗的底物情況。如果機體100%消耗碳水化合物供能,RER=1;如果機體100%消耗脂類供能,RER=0.7。因為飲食的復合性,所以RER應在0.7~1.0范圍內。胰島素的改變會影響RER的變化。胰島素分泌增加,一方面促進糖的攝取和利用,糖作為底物供能比增加;另一方面促進脂質儲存,脂質作為底物供能比降低,兩方面均使RER升高。哺乳動物90%的O2消耗供能在線粒體發生,所以富含線粒體的器官組織所占比例及其中線粒體的數量、供能均會影響產熱。本研究代謝籠顯示CypD KO組光照期產熱高于對照組,由于兩組小鼠開始喂養時體質量無顯著差異,這可以解釋兩組小鼠飲食量無差異但CypD KO組小鼠體質量降低的現象,推測產熱的改變可能是因為CypD的改變影響了衰老小鼠產熱的重要細胞器——線粒體的功能,進一步推測產熱的重要器官——肝臟和肌肉(肌肉、肝臟富含線粒體[10])可能存在差異。此外,代謝籠提示CypD KO組黑暗期活動度低于對照組但無統計學差異,推測黑暗期由于對照組活動量的增加導致兩組產熱無統計學差異。但是,為什么CypD KO組小鼠黑暗期活動量不及對照組還需要研究,一個推測是衰老導致大腦氧化應激增加從而導致對照組小鼠表現出焦慮的癥狀。CypD KO組小鼠黑暗期RER高于對照組,說明CypD敲除的衰老小鼠以糖作為底物的比例高于對照組衰老小鼠。因此,CypD敲除在衰老小鼠中通過影響線粒體功能可以導致能量產生的底物利用和產熱的改變,具體機制還需要基礎實驗的支持。
空腹血糖、糖耐量檢測可以反映胰島素分泌情況;胰島素敏感性可以反映外周組織對胰島素的響應情況;丙酮酸耐量試驗可以反映出饑餓狀態下肝臟糖異生能力。本研究中CypD KO組糖代謝明顯改善:胰島素分泌狀態優于對照組,肌肉和肝臟對葡萄糖的利用良好以及肝臟糖異生弱于對照組。但是,糖代謝試驗中未以年輕小鼠做對照,而且糖耐量試驗在30 min時,CypD KO組小鼠血糖升高不理想且組內數據有一定差異(30 min血糖數據組內方差較大),因此不能得出CypD敲除的衰老小鼠糖代謝正常的結論。
肝臟在血糖調節中發揮重要作用,而且肝臟是內源性糖產出的最主要器官,其次是腎臟。此外,葡萄糖的清除主要依賴肝臟和骨骼肌等。丙酮酸耐量試驗提示CypD KO組衰老小鼠饑餓狀態下肝臟糖異生能力弱于對照組衰老小鼠,提示空腹血糖的差異有可能是因為CypD敲除影響了肝臟糖異生能力。因此,研究肝臟的改變有助于發現CypD KO組小鼠血糖改變的機制。鐵死亡作為新近出現的細胞死亡方式,其過程涉及氨基酸代謝、糖代謝和脂代謝,是幾大代謝過程的交匯[11]。機體鐵代謝的異常導致各個器官的鐵死亡水平升高。其中,肝臟是機體鐵調控的樞紐。肝臟通過分泌hepcidin調控各個器官的鐵的轉運和代謝[12]。文獻報道鐵死亡參與了能量代謝異常的發生,例如糖尿病[13];另外,鐵死亡和衰老有密切聯系,鐵死亡參與神經退行性疾病的發生發展[14]。普魯士藍染色可以觀察鐵在組織中的沉積狀況,肝臟切片的普魯士藍染色顯示野生型衰老小鼠存在大量密集的鐵沉積顆粒。Gpx4是觀察鐵死亡的核心指標[15]。Gpx4通過還原谷胱甘肽過氧化物從而抑制鐵死亡[16]。本研究結果顯示,CypD KO組肝臟Gpx4表達高于對照組;而肌肉的Gpx4改變不明顯。提示,CypD敲除除緩解衰老導致的線粒體功能紊亂以外,還會抑制鐵死亡。進一步提示與肌肉組織相比,肝臟在CypD敲除的衰老小鼠糖代謝改變中發揮了主要作用。但是,確鑿的證據需要利用肝臟CypD特敲的衰老小鼠模型證實。由于肝臟通過分泌肝鐵調素在全身鐵代謝中發揮核心作用,推測CypD敲除對肝臟的影響將導致全身鐵代謝的改變。肝臟糖代謝的改變與鐵死亡的關系需要進一步實驗的證實。
綜上所述,CypD敲除可以改善衰老造成的體質量增加、產熱降低、底物構成比以及糖代謝異常,而且可以降低能量和糖代謝的重要器官——肝臟中的鐵死亡水平。以上研究為改善衰老的代謝狀況提供了新的思路,由于已有成熟的鐵死亡抑制劑和激動劑以及CypD的抑制劑,因此可以通過減輕鐵死亡或抑制CypD的表達從而達到改善代謝的目的。
利益沖突所有作者聲明不存在利益沖突
作者貢獻聲明劉凱:實驗研究、數據收集與整理、論文撰寫;王建寧:論文修訂與指導

