非酒精性脂肪性肝病與慢性腎病關系的研究進展
楊夢茹,韓 睿
昆明醫科大學第一附屬醫院 內分泌二科,昆明 650032
非酒精性脂肪性肝病(NAFLD)是一組與代謝功能紊亂及遺傳易感因素相關的疾病。其疾病譜主要包括非酒精性單純性脂肪肝、非酒精性脂肪性肝炎(NASH)、肝硬化和肝細胞癌[1]。目前慢性腎病(chronic kidney disease, CKD)作為NAFLD肝外相關疾病正得到越來越多的關注。經統計,非NAFLD患者CKD的患病率為5%~35%,而NAFLD患者CKD的患病率為20%~55%[2]。CKD已成為世界性公共衛生問題,全球等待替代治療的終末期腎病患者已有490.2萬~708.3萬[3]。面對如此巨大的疾病負擔,現階段探明NAFLD與腎臟損害間的可能機制,實現疾病早期診斷、開展科學的臨床管理,顯得尤為重要。
1 NAFLD增加CKD發生風險的相關研究
在國外,越來越多證據表明NAFLD與CKD的發生密切相關。Targher等[4-5]的前瞻性隊列研究發現NAFLD會增加2型糖尿病(diabetes mellitus type 2, T2DM)及1型糖尿病患者的CKD發病率。Seo等[6]則提出NAFLD患者存在進展期肝纖維化(FIB-4≥2.67)時才與T2DM患者CKD風險增加獨立相關(aHR=1.75,95%CI:1.15~2.66)。2020年Kaps等[7]的回顧性隊列研究顯示,校正傳統心腎危險因素后,NAFLD與CKD風險增加獨立相關(HR=1.58,95%CI:1.51~1.66),這與Akahane等[8]同年發表文章中肥胖、高血壓和高尿酸血癥可作為NAFLD患者CKD獨立預測因子的觀點略有不同。此后,2022年Mantovani等[9]更新一項Meta分析證實,NAFLD患者中,第3期及以上CKD發生的長期風險增加了1.45倍,且與年齡、性別,及其他傳統CKD危險因素無關,同時肝纖維化程度較高的患者更易發生CKD。
國內學者也對NAFLD與CKD的關系開展了積極探索。中國心臟代謝疾病和癌癥隊列研究[10]采用脂肪肝指數≥60診斷NAFLD,并利用AST/ALT比值評估肝纖維化程度,發現NAFLD及其肝纖維化嚴重程度與糖尿病前期、糖尿病患者CKD風險增加有關(aHR=1.33,95%CI:1.20~1.48),若患者糖化血紅蛋白、血壓、低密度脂蛋白膽固醇等代謝指標控制達標,上述疾病相關性可減弱。Liu等[11]開展的橫斷面隊列研究也顯示NAFLD患者CKD患病率高于非NAFLD患者(17.5% vs 13.9%,P<0.001),且NAFLD嚴重程度與CKD的發生發展呈正相關。Cai等[12]進行的研究分析表明,在校正糖尿病、肥胖、血脂異常和高血壓等危險因素后,NAFLD與CKD仍相關。Zhang等[13]首次比較了不同種族NAFLD與早期腎功能下降的關系,指出NAFLD增加了中國和美國人群早期CKD的發病風險,但對于CKD晚期階段,疾病復雜程度的增加可能減弱NALFD對CKD發生發展的影響。
總體而言,在糖尿病與非糖尿病患者中,通過生化指標、影像學或組織學診斷的NAFLD,與CKD顯著關聯的研究結論具有一致性。
2 NAFLD可能增加CKD發生風險的潛在機制
2.1 代謝綜合征與炎癥 2020年,國際專家小組建議將NAFLD更名為代謝相關脂肪性肝病(metabolic associated fatty liver disease, MAFLD),診斷標準為成人肝脂肪變基礎上合并超重/肥胖、T2DM、代謝功能障礙三者之一,以強調代謝風險因素對肝病的影響[14]。Sun等[15]對我國第3次健康和營養調查(NHANES-Ⅲ 1988-1994)數據進行橫斷面分析發現,12 571例受試者中MAFLD和NAFLD的患病率分別為30.2%和36.2%。與NAFLD個體相比,MAFLD擁有更低的估算腎小球濾過率(eGFR)[(74.96±18.21)ml·min-1·1.73 m-2vs(76.46±18.24)ml·min-1·1.73 m-2,P<0.001]和更高的3~5期CKD患病率(29.60% vs 26.56%,P<0.05)。調整性別、年齡、種族、飲酒史和糖尿病因素后,MAFLD仍與CKD發病風險的增加有關,提示MAFLD可能比NAFLD更能識別CKD患者。但Deng等[16]對美國2017年—2018年NHANES數據的橫斷面調查未發現MAFLD與CKD存在獨立關聯,研究者通過亞組分析推測MAFLD與CKD之間的聯系可能是由代謝異常因素介導。因此還需要更多研究明確MAFLD和CKD之間的關聯。實際上,當常見疾病共存并具有共同的危險因素時,很難解釋其間的因果關系及混雜因素的作用。肥胖(尤其是中心性肥胖)和胰島素抵抗(insulin resistance, IR)既是代謝綜合征的核心部分,也是NAFLD和T2DM的重要致病因素,臨床中NAFLD和T2DM往往共存,協同增加肝內、外不良臨床結局風險。研究[17]顯示若存在NAFLD,T2DM發病風險大約增加2倍,且發病風險隨NAFLD嚴重程度的增加而增加。T2DM同時也是NAFLD快速向NASH、肝纖維化、肝硬化進展,或導致肝病相關死亡的最強危險因素之一[17]。糖尿病腎病(diabetic nephropathy, DN)作為T2DM典型的微血管并發癥,是CKD的一種重要類型,也是導致終末期腎病的主要原因。T2DM患者往往更易伴發代謝綜合征的一些特征性疾病,如肥胖、高血壓、血脂異常等,這些疾病狀態可能造成腎素-血管緊張素-醛固酮系統激活、IR、多元醇代謝通路激活、高尿酸血癥以及糖基化終末產物的形成并導致腎小管間質炎癥和纖維化,造成繼發性腎損傷[18]。
此外,NAFLD被認為是一種低級別炎癥性疾病,炎癥表現在NASH和晚期肝纖維化患者中更為顯著[19]。研究[20]表明進行性胰島素敏感組織功能障礙和IR在NASH發展中起著核心作用。炎性細胞,尤其是巨噬細胞浸潤是胰島素敏感組織功能障礙標志之一,巨噬細胞通過分泌TNF、IL-1β和IL-6等因子促發IR和炎癥,并造成脂肪因子譜紊亂(低脂聯素、高瘦素、高TNF水平)。腎臟血流灌注量極高,卻并不具備類似肝臟組織的抗氧化、解毒和抗炎防御機制,因此在慢性疾病中更易受到傷害。持續性低度炎癥狀態是CKD發生發展的重要危險因素,與不良飲食模式、氧化應激、酸中毒、感染、脂肪組織及腸道微生物群代謝失調有關[21],營養管理是減緩CKD進展和預防終末期腎病的重要干預措施之一[22]。
2.2 過量果糖攝入與內源性果糖的產生 果糖是常用甜味劑蔗糖、高果糖玉米糖漿的主要成分,大量存在于高熱量食品和含糖飲料中,肝臟、腎臟與腸道是果糖代謝的主要部位[23]。過量果糖攝入可增加脂肪酸產生,加重氧化應激和IR,這也提升了NASH、肝纖維化、肝癌的發生風險[24]。除膳食攝入外,人體還可以通過多元醇途徑,利用醛糖還原酶和山梨糖醇脫氫酶將葡萄糖向山梨糖醇和果糖轉化。果糖作為代謝過程中產生尿酸的唯一常見碳水化合物,在肝細胞中可被已酮糖激酶快速代謝,消耗ATP并導致尿酸積累,增加的尿酸又可利用正反饋調節機制刺激多元醇途徑中的醛糖還原酶,致使內源性果糖增多。如此惡性循環,可能加重了尿酸介導的腎損害[25]。
2.3 尿酸代謝異常 血清尿酸水平升高被認為與NAFLD進展相關[26-27],黃嘌呤氧化還原酶是催化尿酸生成的關鍵酶,在NAFLD患者及小鼠模型中顯示高活性[28-29]。尿酸因抑制一氧化氮合酶活性可加重IR,并以濃度依賴性的方式增加果糖激酶活性,促進果糖誘導的脂肪變性。尿酸還誘導肝細胞內質網應激,并從中調控甾醇調節元件結合蛋白,增加肝內甘油三酯(TG)的積累[30]。眾所周知,因誘發高血壓及腎小球灌注損傷、激活腎素-血管緊張素-醛固酮系統、增加氧化應激、導致線粒體功能障礙、促炎和促血管平滑肌細胞增殖,高尿酸血癥也是CKD發生發展的獨立危險因素[31-32],降尿酸治療對延緩CKD進展有一定作用[33]。
2.4 飲食-腸道菌群軸失調 人體腸道內存在數千種與代謝相關的微生物群落,其結構可受宿主飲食習慣影響。高熱量、低纖維飲食對腸道菌群生態有一定破壞作用。腸道菌群失調后,不但影響短鏈脂肪酸在腸道免疫調節、抗炎、抗癌、調節胰高血糖素樣肽分泌等方面的作用,還增加內源性乙醇等肝毒性分子的生成,破壞腸道緊密連接進而影響腸道通透性,加之脂多糖(LPS)等腸源性病原體相關分子模式水平的升高,可促發“代謝性內毒素血癥”。LPS還可與肝臟中特異性Toll樣受體結合造成組織慢性低度炎癥狀態。此外,腸道菌群失調可能抑制血管生成素樣蛋白4的分泌,引發β-氧化抑制和TG儲存增加。大量膽堿因被細菌用于合成磷脂酰膽堿,或向二甲胺和三甲胺轉化,其缺乏可加劇肝臟TG積累。三甲胺通過門靜脈循環到達肝臟被氧化為三甲胺-N-氧化物(TMAO)后釋放入血,TMAO水平升高往往與NAFLD嚴重程度呈正相關[34-35]。
實際上,循環TMAO濃度與腎功能損害呈正相關。作為重要的腎毒性分子,TMAO不僅加劇腎纖維化,還參與高血壓、糖尿病、炎癥、動脈粥樣硬化等疾病或病理過程損害腎臟健康[36-37]。短鏈脂肪酸[38]和LPS[39]水平的變化,在CKD的發生發展中也起著重要的作用。其他腸道菌群失調所產生的腎毒性分子還包括馬尿酸、苯乙酰谷氨酰胺、次級膽汁酸、吲哚、苯酚、硫酸苯酯等[40]。
2.5 氧化應激 在NAFLD患者中,脂代謝異常造成的慢性損傷與機體氧化劑/抗氧化劑失衡有關。脂質過氧化、β-氧化功能受損及內質網應激時,脂毒性的產生和活性氧(ROS)生成可誘發氧化應激,從而觸發肝細胞應激途徑導致炎癥和纖維化,促進NASH發展。目前認為由Nrf2/ARE通路調節的抗氧化反應有助于恢復正常的脂質代謝,減輕氧化應激損傷[41]。而腎臟作為人體線粒體含量第二高的器官,氧化還原反應豐富,故極易受氧化應激的影響[42]。
2.6 血小板激活 氧化應激與血脂異常均為血小板活化的關鍵調節因素[43]。活化的血小板通過釋放血小板衍生生長因子(PDGF)β、TGFβ、5-羥色胺等介質過度激活肝星狀細胞(HSC),加之HSC本身收縮作用,為肝纖維化的發生和門靜脈壓力改變奠定了基礎[44]。Kabra等[45]為此設計出多糖治療劑SBR-294,具有抑制血小板活化和PDGF活性的雙重作用,有望發揮血小板-PDGF拮抗劑在肝纖維化中的治療作用。此外,研究[46]發現CKD小鼠血清中硫酸吲哚氧基增加,這種常規透析難以清除的尿毒癥毒素,可通過ROS/p38MAPK通路誘導血小板激活,這與CKD相關血栓形成及動脈粥樣硬化有關;硫酸吲哚氧基還可激活NF-κB信號通路,降低具有腎臟保護作用的Klotho蛋白水平,增加ROS。
2.7 遺傳學與表觀遺傳學機制 NAFLD被認為是一種與生活習慣、營養和遺傳有關的多因素疾病。研究[2]表明PNPLA3、HSD17B13、TM6SF2、MBOAT7、GCKR等基因多態性與NAFLD相關,其中一部分基因也與腎功能異常相關。PNPLA3基因在肝臟(主要是肝細胞和HSC)、脂肪組織和腎臟(主要是足細胞和腎小管上皮細胞)中高度表達,是NAFLD的主要遺傳決定因素。PNPLA3 rs738409C>G變體型不具備野生型PNPLA3編碼蛋白對TG和視黃酯的水解活性,因此與肝臟脂肪變性、HSC過度激活、肝纖維化相關,該變體型還增加腎系膜、腎小管脂質沉積,利用脂毒性損害足細胞功能,導致腎纖維化和腎小球硬化[2]。
另一方面,表觀遺傳變化與遺傳風險因素相互作用,決定個體對疾病的易感性。NAFLD的發病可受組蛋白修飾、DNA甲基化和非編碼RNA等表觀遺傳機制的調控[47]。研究[48]發現小鼠及人類NASH模型中,過氧化物酶體增殖物激活受體γ可通過miR-21-5p/SFRP5通路減輕炎癥和氧化應激,因此有望成為治療新靶點。此外,miR-21在腎病動物模型、人急性腎損傷、人CKD組織樣本中均有上調,在促纖維化和器官衰竭中動態發揮作用[49]。
3 有CKD進展風險的NAFLD患者識別與管理
Paik等[50]指出,CKD的存在及嚴重程度與NAFLD患者死亡率增加獨立相關,更加肯定了在NAFLD患者中早期識別CKD的價值。介于肝活檢開展的局限性,目前已提出多種無創評分系統,如NAFLD纖維化評分(NFS)、基于4因子的纖維化指數(FIB-4)、AST/血小板比值(APRI)、BARD評分等用于預測NASH和肝纖維化的進展。其中,FIB-4還被認為是預測NAFLD患者發生CKD的最佳指標[51],在T2DM患者中,FIB-4對DN和蛋白尿也有一定預測作用[52]。此外,生化指標也是研究熱點。研究[53]表明我國非肥胖人群血清GGT水平變化可能有助于監測NAFLD的發生發展,但GGT作為CKD的預測因子尚存在爭議[54-55]。此外,有學者[56]認為無論GGT升高與否,ALT升高、AST/ALT比值降低均與CKD相關。邵翠萍等[57]則提出NAFLD患病風險與血清尿酸/肌酐比值升高有關,肌酐水平監測可能指導NAFLD干預時機,改善患者預后。而血清尿酸/肌酐水平升高也被認為是早期DN發生的獨立危險因素,對早期DN有很好的預測價值[58]。但目前還無足夠研究評估生化指標在NAFLD中診斷CKD的準確性。鑒于CKD在NAFLD患者中的高患病率,準確評估患者腎功能仍有意義。表1總結了目前在臨床實踐中可用于NAFLD患者腎功能評估的監測指標及優缺點。
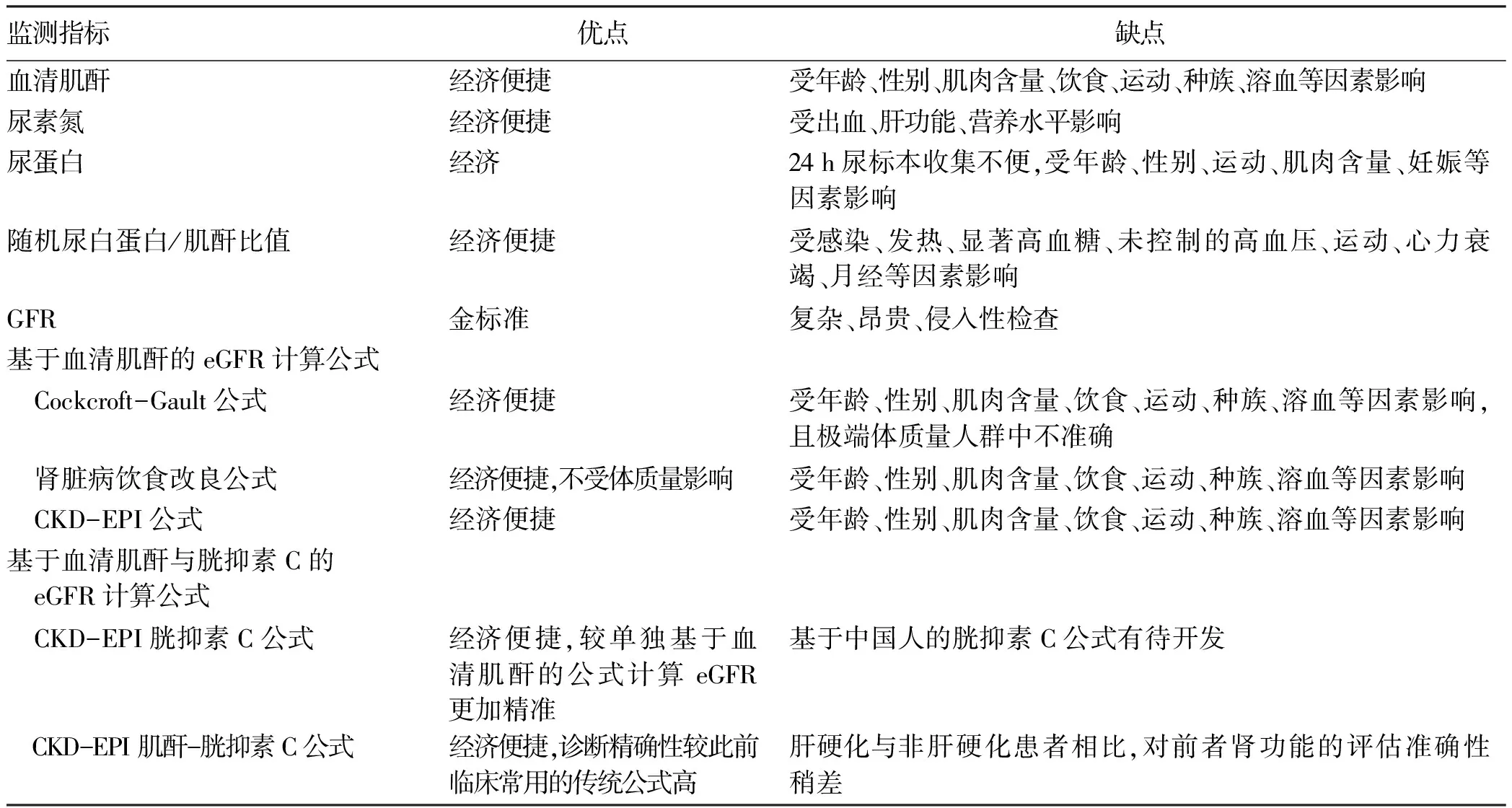
表1 建議用于NAFLD患者腎功能評估的監測指標及優缺點
與其他代謝相關疾病類似,健康的生活方式和體質量管理對于NAFLD的防治至關重要。Wong等[59]對77例社區NAFLD患者進行為期12個月以飲食和運動處方制定為主的干預后發現,非肥胖患者(BMI<25 kg/m2)在適度減重的情況下達到NAFLD緩解的比例甚至高于肥胖患者,生活方式干預對非肥胖和肥胖患者的NAFLD治療均有效。美國肝病學會對地中海飲食有所推薦,主張控制熱卡攝入在500~1000 kcal/d,以實現0.5~1.0 kg/周的減重目標,總體減重至少在3%~5%來改善肝脂肪變性,減重7%~10%改善NASH和纖維化[60]。此外,適當體育活動可降低NAFLD患者肝內TG水平和肝細胞損傷標志物而與減重本身無關,一般建議患者每周進行3~5次,總時間150~200 min的中等強度有氧運動[61]。但運動療法需考慮個體化因素,因此暫無最佳運動類型、強度和頻率的定論。在藥物治療領域,前文建議對NAFLD患者腎功能進行早期監測,可能實現醫師對藥物劑量的動態調整,保證治療安全性。更重要的是,由疾病機制提示二者共享潛在治療靶點。利拉魯肽是我國唯一上市的藥品說明書中注明能治療糖尿病合并脂肪肝的胰高血糖素樣肽-1受體激動劑,其對NAFLD的改善可能與減重作用有關[62]。胰高血糖素樣肽-1受體激動劑還被證實具有腎臟抗炎、抗纖維化和抗氧化作用;或抑制血管緊張素Ⅱ、近端小管Na-H交換體3的激活而對腎臟有直接及間接保護作用[63]。相比之下,二肽基肽酶-4抑制劑在腎臟獲益方面還有待研究。鈉-葡萄糖協同轉運蛋白-2抑制劑通過減輕腎小球高濾過、降低尿蛋白、防止高血糖誘導的氧化應激和炎癥抑制等機制對腎臟發揮保護作用,還可獨立于抗高血糖作用,預防飲食引起的肝脂肪變性、炎癥和纖維化。這些肝臟相關獲益的潛在機制包括胰島素增敏、減脂、改善脂肪組織功能障礙、抗氧化等。更多處在探索階段的治療方案還包括過氧化物酶體增殖物激活受體γ激動劑、缺氧誘導因子激活劑、mTOR復合物1抑制劑、半乳糖凝集素-3抑制劑等[63]。
4 展望
當前NAFLD與CKD患病率的增加和影響范圍的擴大已引起臨床醫師及科研人員的重視。目前NAFLD與CKD的因果關聯未能闡明,NAFLD與腎臟病理改變之間的關系也尚不明確。考慮到臨床對于NAFLD患者的腎功能監測,或在CKD患者中進行NAFLD篩查還缺乏具體實施意見,未來仍需要進行更多的前瞻性和干預性研究。期待日后能夠從確切的疾病機制,對疾病開展有效防控和精準化治療。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:楊夢茹負責課題設計,查閱文獻,撰寫論文;韓睿指導文章撰寫及修改、校閱論文。

