lncRNA NEAT1靶向miR-497-5p對胰腺癌細胞增殖、凋亡及上皮-間質轉化的影響
于文昊 王海久(青海大學附屬醫院肝膽胰外科,西寧 810000)
胰腺癌是臨床常見消化系統惡性腫瘤,近30年來其發病率在全球范圍內呈上升趨勢,且病死率較高,其早期癥狀不明顯,缺乏特異性篩查指標,80%患者確診時多已是中晚期,僅5%左右患者進行手術治療,但五年生存率不足5%[1-3]。因此,探尋胰腺癌新型生物治療靶標已成為臨床研究熱點。長鏈非 編 碼RNA(long non-coding RNAs,lncRNAs)是一種反義RNA分子,不具有蛋白編碼能力,能與靶基因非編碼區特異性結合,調節基因轉錄和表達而發揮促癌或抑癌作用[4]。核富集轉錄體1(nuclear enriched abundant transcript 1,NEAT1)是lncRNAs家族成員之一,研究顯示,其對多種惡性腫瘤如甲狀腺癌、肝癌、舌鱗狀細胞癌等細胞生物學行為均具有調控作用[5-7]。miR-497-5p屬于miRNAs家族重要一員[8],姜達偉等[9]研究顯示,過表達miR-497-5p能夠誘導胰腺癌細胞周期阻滯進而抑制細胞增殖。XIA等[10]研究顯示,NEAT1靶向下調miR-497-5p表達促進胃癌細胞增殖并抑制凋亡。目前,有關NEAT1能否調控miR-497-5p影響胰腺癌細胞生物學行為的研究鮮有報道,因此本研究探討NEAT1與miR-497-5p對胰腺癌細胞增殖、凋亡等的影響,以期為臨床尋找胰腺癌新型生物治療靶點提供一定參考。
1 材料與方法
1.1 材料
1.1.1 細胞 人胰腺癌PANC-1細胞(bio-51676)購自北京百歐博偉生物技術有限公司。
1.1.2 試劑與儀器DMEM培養基(3-2001)、蛋白提取試劑盒(BC3711-50T)、LipofectamineTM3000轉染試劑盒(EF010-E)購自美國艾美捷(武漢)科技有限公司;CCK-8試劑盒(CA1210-500T)、Annexin V-FITC/PI凋亡檢測試劑盒(WK304)、反轉錄試劑盒(RP1105-100T)、AceQqPCR SYBR Green Mix(ALH185)、Trizol Reagent核酸分離試劑(YT526)、雙熒光素酶報告基因檢測試劑盒(KFS303-HUV)購自北京百奧萊博科技有限公司;靶向NEAT1的特異性siRNA(NEAT1-siRNA)及無關序列siRNA-NC由上海普邁生物科技有限公司設計合成;miR-497-5p-inhibitor及相應陰性對照inhibitor-NC由百奧邁科生物技術有限公司合成;兔抗人細胞增殖相關核抗原(MKI67 Affinity Purified Polyclonal Ab,Ki-67)(100130-MM21)、B淋巴 細 胞 瘤 基 因-2(B-cell lymphoma-2,Bcl-2)(FTB3598S)、Bcl-2相關X蛋白(Bcl-2 associated X protein,Bax)(ATA25287)、E-鈣黏附蛋白(E-cadherin)抗體(貨號ACRO)、間質標志物波形蛋白(Vimentin)(貨號K26866-PGZ)、N-鈣黏附蛋白(N-cadherin)抗體(貨號M00403-FCZ)、β-actin(ABP57456)多克隆抗體、山羊抗兔HRP(SE12-0.1)二抗均購自武漢益普生物科技有限公司;二氧化碳細胞培養箱(型號:BBD6220)購自美國Thermo Fisher Scientific公司;酶標儀(型號:ELx800)、熒光定量PCR儀(型號:C1000)購自美國Bio-Rad公司;流式細胞儀(型號:CytoFLEX)購自美國Beckman公司。
1.2 方法
1.2.1 細胞培養 取PANC-1細胞解凍,復蘇,置于含10%滅活胎牛血清(FBS)+DMEM培養基,37℃、5%CO2培養箱中培養,每2~3 d換液,無菌操作,細胞已長滿(達80%~90%)時進行傳代培養。
1.2.2 細胞瞬時轉染及分組處理 取1.2.1對數生長期的PANC-1細胞接種于24孔板(2.5×104個/孔),培養24 h后,更換無FBS的培養液,對細胞進行轉染并分組:①空白對照組(NG組):細胞不做特殊處理;②陰性轉染組(siRNA-NC組):采用LipofectamineTM3000將NEAT1-siRNA轉染至PANC-1細胞中;③沉默NEAT1組(NEAT1-siRNA組):采用LipofectamineTM3000將NEAT1-siRNA轉染至PANC-1細胞中;④共轉染組(NEAT1-siRNA+miR-497-5p-inhibitor組):采用LipofectamineTM3000將NEAT1-siRNA和miR-497-5p-inhibitor序列共轉染。用含10%滅活FBS+DMEM培養液繼續培養細胞48 h。嚴格按照轉染試劑盒說明書操作,收集各組細胞用于后續實驗。
1.2.3 實時定量聚合酶鏈反應檢測NEAT1、miR-497-5p水平TRIzol法提取1.2.2各組培養48 h的PANC-1細胞總RNA并測定濃度。以RNA為模板、PrimeScript RT reagent試劑盒說明書為操作標準進行逆轉錄合成cDNA。體系20μl:ULtraSYBR mixture(10.0μl)、模板cDNA(2.0μl)、上下游引物(各2.0μl)、去離子純化水(4.0μl);93℃30 s、93℃5 s、65℃30 s,40個循環。引物序列詳見表1,由蘇州泓迅生物科技股份有限公司設計并合成。采用2-ΔΔCt方法計算NEAT1、miR-497-5p水平相對表達量。

表1 引物序列Tab.1 Primer sequences
1.2.4 CCK-8法檢測各組PANC-1細胞增殖能力取1.2.2各組培養48 h后的PANC-1細胞,消化,接種至24孔板(2.5×104個/孔),繼續培養48 h,嚴格按照CCK-8試劑盒說明書加入CCK-8試劑,繼續培養2 h,檢測490 nm處各孔細胞光密度(optical density,OD)值,計算細胞增殖抑制率(%)=(1-實驗組OD值/對照組OD值)×100%。實驗重復3次。
1.2.5 流式細胞術檢測各組PANC-1細胞凋亡率取1.2.2各組培養48 h后的PANC-1細胞接種于24孔板中(2.5×105個/孔),按照Annexin-V FITC/PI試劑盒說明書處理細胞;加5μl碘化丙啶(PI)+5μl Annexin V-FITC混勻,染色,稀釋,流式細胞儀檢測細胞凋亡率。實驗重復3次。
1.2.6 Western blot檢測增殖、凋亡及上皮-間質轉化(epithelial-mesenchymal transition,EMT)標志蛋白表達情況 以RIPA液裂解細胞,提取總蛋白并檢測濃度及純度,行10%SDS-PAGE電泳、轉膜,以5%脫脂牛奶封閉,加入一抗Ki-67、Bcl-2、Bax、E-cadherin、N-cadherin、Vimentin及內參β-actin,稀釋比均為1∶500,4℃過夜,清洗,加入HRP標記的山羊抗兔二抗(1∶1 000)孵育1 h。分析各蛋白相對表達量。
1.2.7 雙熒光素酶報告基因實驗 數據庫(Starbase)顯示NEAT1與miR-497-5p核苷酸存在結合位點,根據miR-497-5p與NEAT1-3'UTR結合位點的預測結果,采用PCR技術擴增NEAT1-3'UTR序列中包含與miR-497-5p存在結合位點的片段,并插入到熒光素酶pGL4載體中,構建NEAT1野生型質粒(NEAT1-WT),并利用基因突變技術將個別結合位點序列突變,構建突變型質粒(NEAT1-MT)。使用LipofectamineTM3000將NEAT1-WT、NEAT1-MT分別與miR-497-5p-inhibitor-NC、miR-497-5p-inhibitor共轉染于PANC-1細胞,分別為miR-497-5p-inhibitor-NC-NEAT1-WT組、miR-497-5p-inhibitor-NEAT1-WT組、miR-497-5p-inhibitor-NC-NEAT1-MT組、miR-497-5p-inhibitor-NC-NEAT1-MT組,轉染48 h后,用PBS洗滌細胞,加入RIPA裂解液(250μl)于室溫搖床中搖晃15 min裂解細胞,收集裂解液,加入50μl熒光素酶檢測試劑Ⅱ,以自動熒光素酶檢測儀測定熒光強度A,之后加入Stop&Glo,測定熒光強度B,以A/B表示熒光素酶相對活性。
1.3 統計學方法 采用SPSS22.0分析數據,計量資料以±s表示,多組間比較采用單因素方差分析,進一步兩兩比較采用SNK-q檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 各組PANC-1細胞NEAT1、miR-497-5p水平比較 與NG組、siRNA-NC組比較,NEAT1-siRNA組PANC-1細胞NEAT1水平顯著降低(P<0.05),miR-497-5p水平顯著升高(P<0.05);與NEAT1-siRNA組比較,NEAT1-siRNA+miR-497-5p-inhibitor組PANC-1細胞NEAT1水平差異無統計學意義(P>0.05),miR-497-5p水平顯著降低(P<0.05,表2)。
表2 各 組PANC-1細 胞NEAT1、miR-497-5p水 平 比較(±s,n=6)Tab.2 Comparison of NEAT1 and miR-497-5p levels in PANC-1 cells of each group(±s,n=6)
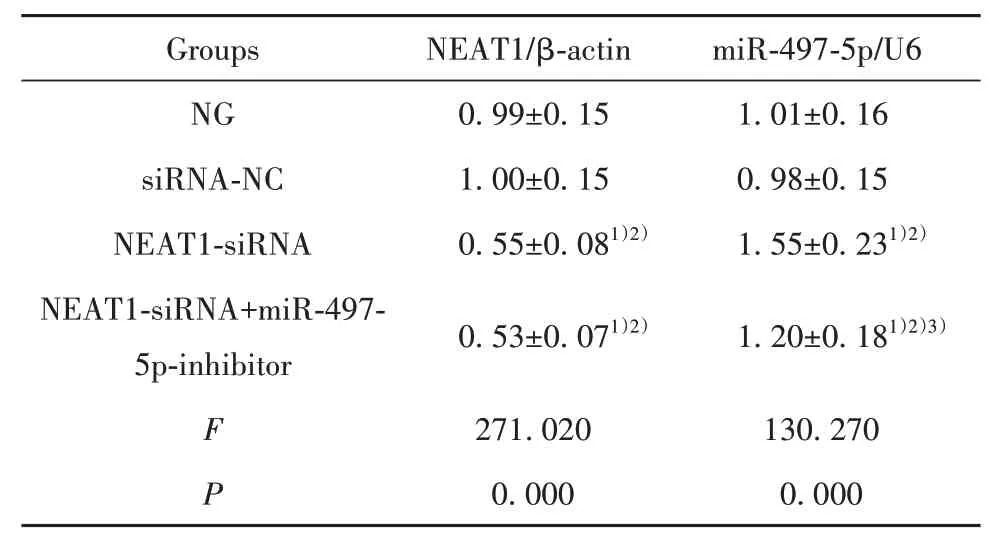
表2 各 組PANC-1細 胞NEAT1、miR-497-5p水 平 比較(±s,n=6)Tab.2 Comparison of NEAT1 and miR-497-5p levels in PANC-1 cells of each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor F P NEAT1/β-actin 0.99±0.15 1.00±0.15 0.55±0.081)2)0.53±0.071)2)271.020 0.000 miR-497-5p/U6 1.01±0.16 0.98±0.15 1.55±0.231)2)1.20±0.181)2)3)130.270 0.000
2.2 各組PANC-1細胞增殖情況比較 與NG組、siRNA-NC組比較,NEAT1-siRNA組PANC-1細胞增殖抑制率顯著升高(P<0.05);與NEAT1-siRNA組比較,NEAT1-siRNA+miR-497-5p-inhibitor組PANC-1細胞增殖抑制率顯著降低(P<0.05,表3)。
表3 各組PANC-1細胞增殖情況比較(±s,n=6)Tab.3 Comparison of PANC-1 cell proliferation in each group(±s,n=6)
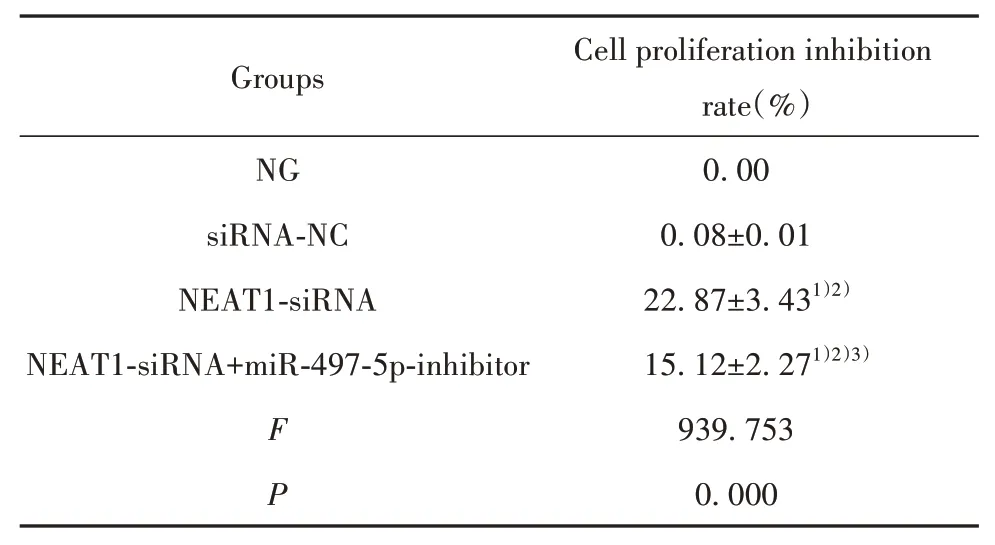
表3 各組PANC-1細胞增殖情況比較(±s,n=6)Tab.3 Comparison of PANC-1 cell proliferation in each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor F P Cell proliferation inhibition rate(%)0.00 0.08±0.01 22.87±3.431)2)15.12±2.271)2)3)939.753 0.000
2.3 各組PANC-1細胞凋亡情況比較 與NG組、siRNA-NC組比較,NEAT1-siRNA組PANC-1細胞凋亡率顯著升高(P<0.05);與NEAT1-siRNA組比較,NEAT1-siRNA+miR-497-5p-inhibitor組PANC-1細 胞凋亡率顯著降低(P<0.05,圖1、表4)。
表4 各組PANC-1細胞凋亡情況比較(±s,n=6)Tab.4 Comparison of PANC-1 cell apoptosis in each group(±s,n=6)
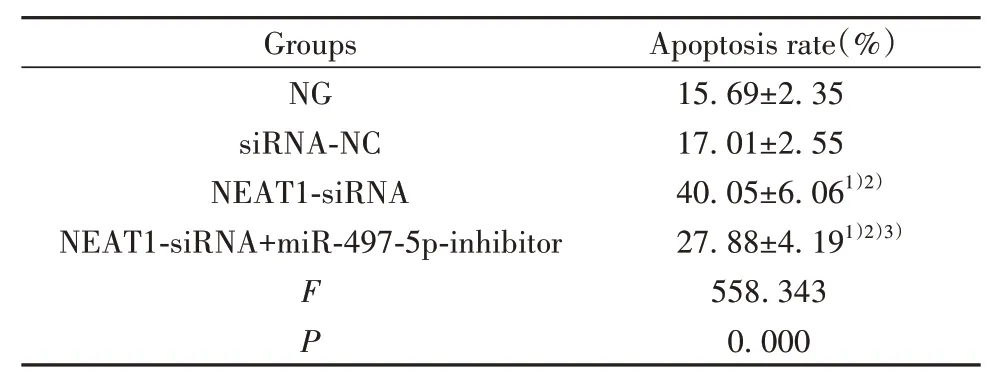
表4 各組PANC-1細胞凋亡情況比較(±s,n=6)Tab.4 Comparison of PANC-1 cell apoptosis in each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor FP Apoptosis rate(%)15.69±2.35 17.01±2.55 40.05±6.061)2)27.88±4.191)2)3)558.343 0.000
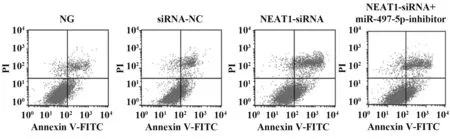
圖1 各組PANC-1細胞凋亡情況比較Fig.1 Comparison of PANC-1 cell apoptosis in each group
2.4 各組PANC-1細胞增殖、凋亡及EMT相關蛋白表達比較 與NG組、siRNA-NC組比較,NEAT1-siRNA組PANC-1細胞Ki-67、Bcl-2、N-cadherin、Vimentin蛋白表達顯著降低(P<0.05),Bax、E-cadherin蛋白表達顯著升高(P<0.05);與NEAT1-siRNA組比較,NEAT1-siRNA+miR-497-5p-inhibitor組PANC-1細胞Ki-67、Bcl-2、N-cadherin、Vimentin蛋白表達顯著升高(P<0.05),Bax、E-cadherin蛋白表達顯著降低(P<0.05,圖2、表5)。
表5 各組PANC-1細胞增殖、凋亡及EMT相關蛋白表達比較(±s,n=6)Tab.5 Comparison of proliferation,apoptosis and EMT related protein expressions of PANC-1 cells in each group(±s,n=6)
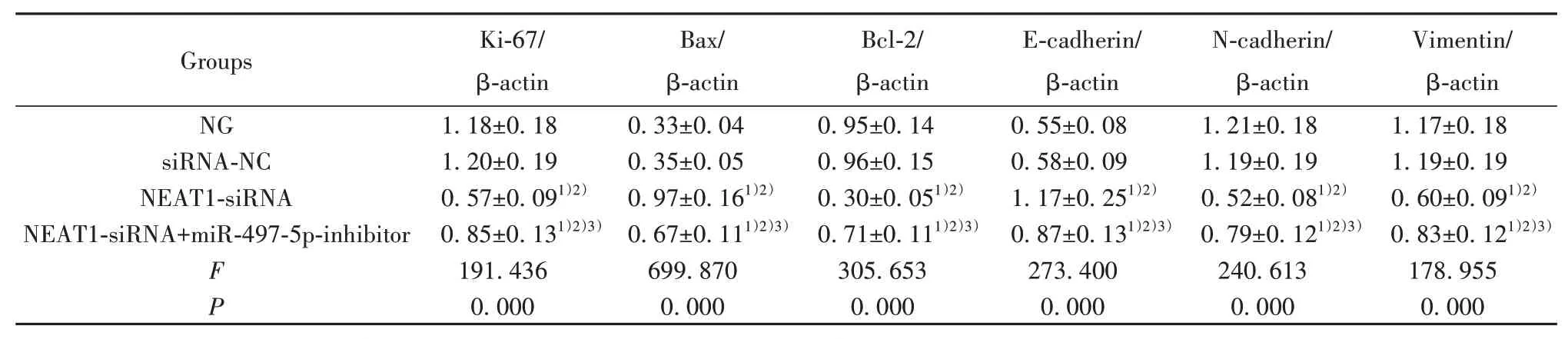
表5 各組PANC-1細胞增殖、凋亡及EMT相關蛋白表達比較(±s,n=6)Tab.5 Comparison of proliferation,apoptosis and EMT related protein expressions of PANC-1 cells in each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor FP Ki-67/β-actin 1.18±0.18 1.20±0.19 0.57±0.091)2)0.85±0.131)2)3)191.436 0.000 Bax/β-actin 0.33±0.04 0.35±0.05 0.97±0.161)2)0.67±0.111)2)3)699.870 0.000 Bcl-2/β-actin 0.95±0.14 0.96±0.15 0.30±0.051)2)0.71±0.111)2)3)305.653 0.000 E-cadherin/β-actin 0.55±0.08 0.58±0.09 1.17±0.251)2)0.87±0.131)2)3)273.400 0.000 N-cadherin/β-actin 1.21±0.18 1.19±0.19 0.52±0.081)2)0.79±0.121)2)3)240.613 0.000 Vimentin/β-actin 1.17±0.18 1.19±0.19 0.60±0.091)2)0.83±0.121)2)3)178.955 0.000
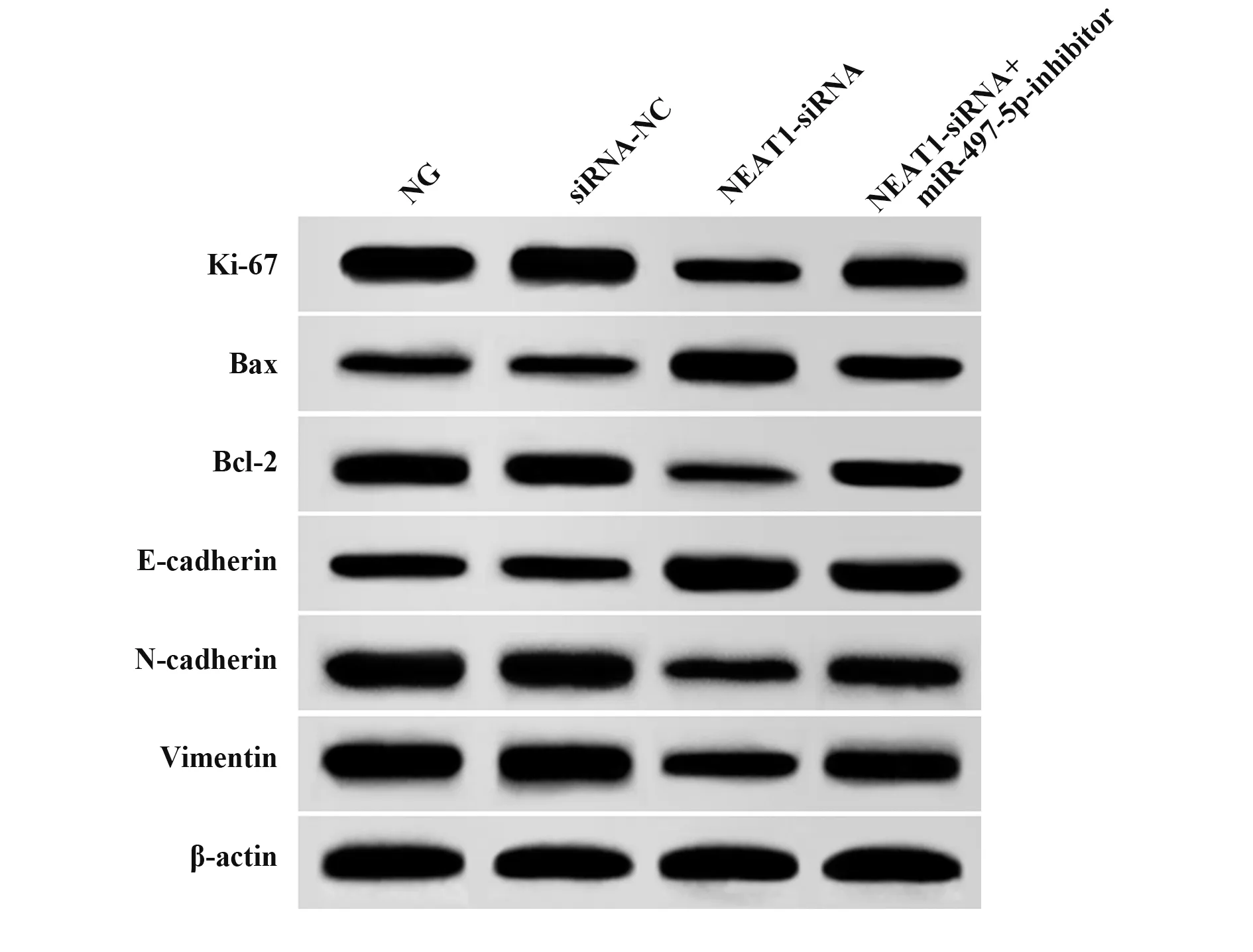
圖2 各組PANC-1細胞增殖、凋亡及EMT相關蛋白表達比較Fig.2 Comparison of proliferation,apoptosis and EMT related protein expression of PANC-1 cells in each group
2.5 雙熒光素酶報告基因檢測NEAT1對miR-497-5p的轉錄調控Starbase(http://starbase.sysu.edu.cn/degradomeRNA.php?source=mRNA)預測結果顯示,NEAT1與miR-497-5p基因序列存在結合位點,見圖3。熒光素酶報告基因實驗結果顯示,轉染NEAT1 WT的實驗中,miR-497-5p-inhibitor-NEAT1-WT組熒光素酶活性(1.37±0.21)顯著高于miR-497-5p-inhibitor-NC-NEAT1-WT組(1.03±0.15),(P<0.05,圖4)。
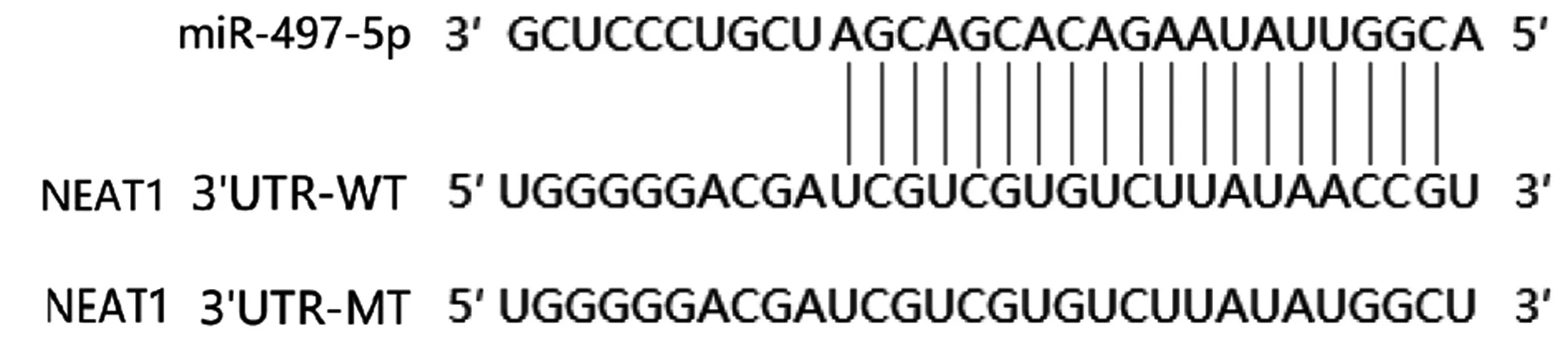
圖3 NEAT1與miR-497-5p基因靶向關系Fig.3 Targeting relationship between NEAT1 and miR-497-5p gene
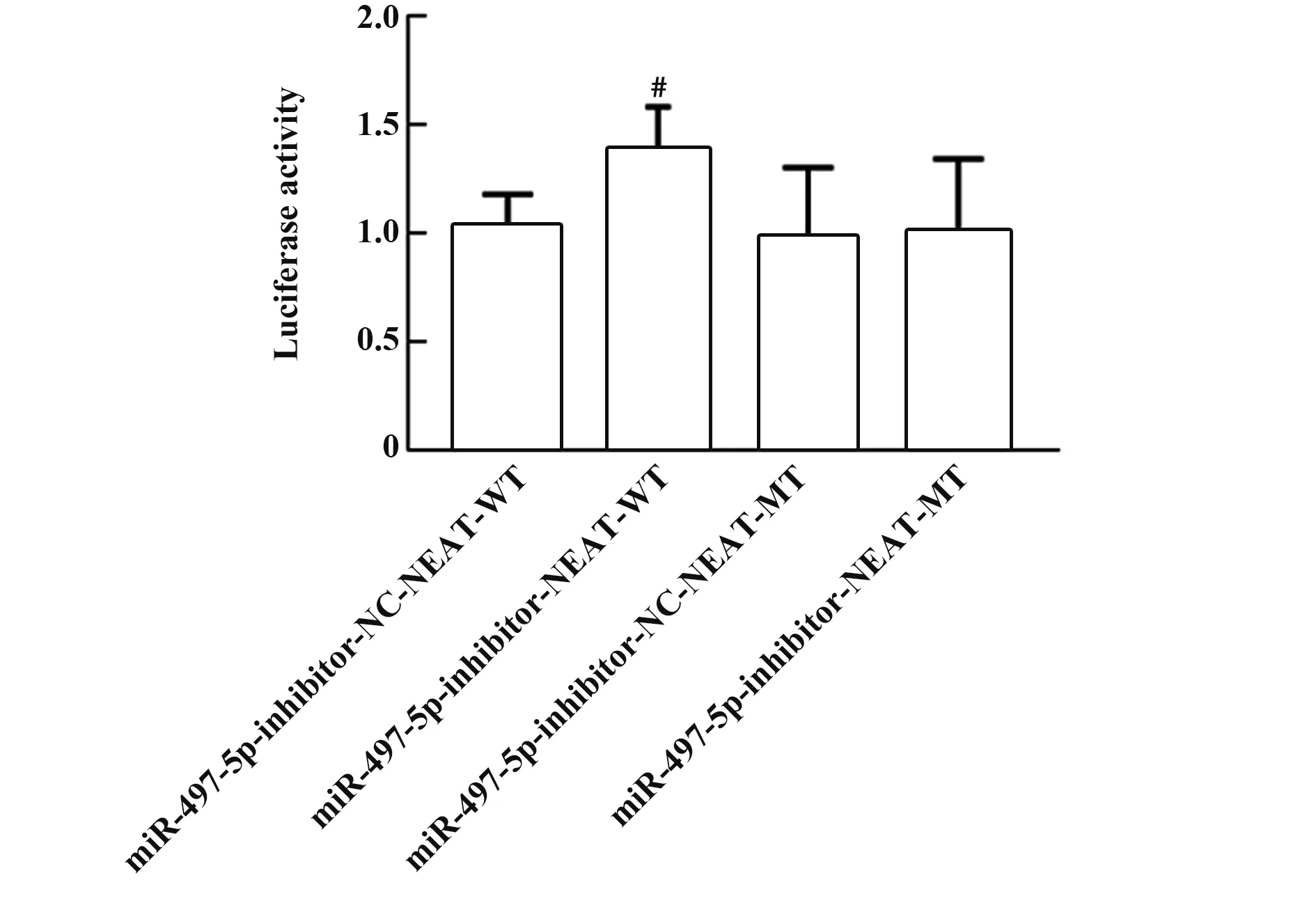
圖4 熒光素酶實驗結果Fig.4 Results of luciferase experiment
3 討論
胰腺癌是消化系統惡性腫瘤,具有發病隱匿、侵襲性強特點,導致大多數患者確診時已是中晚期[11]。目前手術及化療手段是臨床治療胰腺癌的主要手段,但手術對于浸潤程度深的患者有較大風險,同時療效有一定局限性,而腫瘤細胞對化療藥物耐藥性又限制了化療藥物的廣泛應用及療效。
NEAT1是新近發現的一個lncRNA,能夠參與多種基因轉錄調控,研究表明,其作為癌基因參與多種腫瘤發生發展[12]。郭春芳等[13]研究顯示,NEAT1在卵巢癌組織中異常高表達可能是卵巢癌潛 在 治 療 靶 點。WANG等[14]研 究 顯 示,過 表 達NEAT1顯著促進子宮內膜癌細胞增殖、侵襲等。細胞增殖及凋亡失衡是腫瘤發生發展的關鍵,而EMT是指上皮細胞在正常生理及病理特征下向間質細胞表型的轉變過程,是腫瘤細胞發生遷移和侵襲的關鍵步驟[15-16]。其中上皮細胞標志蛋白E-cadherin及間質細胞標志蛋白N-cadherin、Vimentin是EMT標志蛋白,E-cadherin表達下調及N-cadherin、Vimentin表達上調,胞間黏附作用減弱,進一步促使癌細胞向周邊正常組織發生侵襲、轉移[17-18]。本研究結果顯示,與NG組、siRNA-NC組比較,NEAT1-siRNA組PANC-1細胞增殖抑制率、凋亡率、Bax、Ecadherin蛋白表達顯著升高,NEAT1水平及Ki-67、Bcl-2、N-cadherin、Vimentin蛋白表達顯著降低。與既往腫瘤研究中表達模式一致,說明沉默NEAT1表達可能抑制胰腺癌細胞增殖、EMT過程并誘導細胞凋亡。miR-497-5p是一種單鏈小分子RNA,位于腫瘤易突變區域人類染色體17q13.1,在多種腫瘤中異常低表達[19]。LIU等[20]研究顯示,miR-497可能通過抑制血管內皮生長因子-A表達抑制胰腺癌細胞增殖、血管生成和轉移能力。本研究結果顯示,與NG組、siRNA-NC組比較,NEAT1-siRNA組PANC-1細胞miR-497-5p水平顯著升高,當在轉染NEAT1-siRNA基礎上抑制miR-497-5p表達后,沉默NEAT1表達抑制PANC-1細胞增殖并誘導細胞凋亡能力減弱,說明沉默NEAT1表達可能通過上調miR-497-5p表達發揮抑癌作用。研究發現,NEAT1可對miR-497-5p發揮負調控作用促進胃癌細胞增殖并抑制凋亡[10]。本研究經生物信息學預測網站得知NEAT1與miR-497-5p基因序列存在結合位點,且經雙熒光素酶報告實驗證實,miR-497-5p-inhibitor-NEAT1-WT組熒光素酶活性顯著高于miR-497-5pinhibitor-NC-NEAT1-WT組。以上研究結果表明,沉默NEAT1表達可能靶向上調miR-497-5p表達,抑制胰腺癌細胞增殖及EMT過程,并誘導細胞凋亡。
綜上所述,沉默lncRNA NEAT1表達能抑制胰腺癌細胞增殖及EMT過程,并誘導細胞凋亡,可能是通過靶向上調miR-497-5p實現的。然而胰腺癌發生發展是多因素的復雜過程,關于其細胞增殖、凋亡等生物學惡性行為進展中lncRNA NEAT1對下游靶基因或相關通路的調控作用仍需深入探索。

