2 種奧卡西平片在中國健康受試者中空腹及餐后單次口服給藥的安全性研究
方智 唐維 丁晶 劉艷紅 張茜 龔鳳云
奧卡西平(oxcarbazepine)是第二代抗癲癇藥物,是第一代抗癲癇藥物卡馬西平的酮衍生物[1-3]。該藥物主要通過其藥理活性代謝物(10-單羥基衍生物,MHD)發揮作用[4]。其主要適用于治療原發性全面性強直-陣攣發作和部分性發作,伴有或不伴有繼發性全面性發作[5,6]。奧卡西平最早是由瑞士汽巴-嘉基公司開發,1990 年首次在丹麥上市,2000 年美國食品藥品監督管理局(FDA)批準奧卡西平片上市,規格為0.15、0.3、0.6 g。國家藥監局批準諾華作為持有人的進口奧卡西平片,商品名為曲萊(Trileptal),規格為0.3、0.15 g。武漢人福藥業有限責任公司2004 年仿制奧卡西平片并獲得批準文號,規格為0.3 g,商品名為萬儀(Wanyi)。本研究旨在比較國產仿制奧卡西平片(萬儀)與進口原研藥奧卡西平片(曲萊)在中國健康受試者中空腹及餐后條件下單次口服給藥的安全性。
1 受試者、材料與方法
1.1 試驗設計 空腹試驗采用單中心、隨機、開放、單次給藥、2 個周期、雙交叉試驗設計。餐后試驗采用單中心、隨機、開放、單次給藥、3 個周期、部分重復交叉試驗設計。
1.2 受試者 本試驗申辦方為武漢人福藥業有限責任公司,已在國家藥監局藥物臨床試驗登記與信息公示平臺登記公示,登記號為CTR20211866。研究由武漢金銀潭醫院藥物Ⅰ期臨床試驗研究室完成,獲得武漢金銀潭醫院倫理委員會批準(批件號GCPICT-2021-09)。所有受試者均簽署知情同意書。
入選標準:18~65 歲的男性和女性;男性體重≥50.0 kg,女性體重≥45.0 kg,體質量指數(BMI)19.0~26.0 kg/m2;受試者無心血管、肝臟、腎臟、血液和淋巴、內分泌、免疫、精神、神經、胃腸道系統等慢性疾病史或嚴重疾病史,并且總體健康狀況良好。
排除標準:對奧卡西平或任意藥物組分有過敏史;吞咽困難或胃腸道疾病史;可能影響試驗安全性的手術史、外傷史;2 周內使用過任何藥品或者保健品;6 個月內有藥物濫用史者;3 個月內使用過毒品;3 個月內吸煙量>5 支/d,或試驗期不能戒煙;3 個月內每周飲酒量>14 單位(1 單位=17.7 ml 乙醇),或試驗期不能禁酒;3 個月內參加過其他的藥物臨床試驗;4 周內接種過疫苗,或計劃試驗期接種疫苗;女性處在哺乳期;乙型肝炎(乙肝)、丙型肝炎(丙肝)、人類免疫缺陷病毒(HIV)或梅毒患者;女性受試者在篩選期妊娠檢查結果陽性者。
1.3 藥物 受試制劑為武漢人福藥業有限責任公司生產的奧卡西平片(萬儀),規格0.3 g,批號49102101,含量99.6%,有效期至2023 年12 月。參比制劑為Novartis Farma S.p.A 生產的奧卡西平片(曲萊),規格0.3 g,批號T0099,含量97.1%,有效期至2023 年01 月。
1.4 分組及給藥 空腹試驗中,受試者按照1∶1 比例隨機分配到2 個給藥順序組(T-R 組/R-T 組)之一。餐后試驗中,受試者按照1∶1∶1 比例隨機分配到3 個給藥順序組(T-R-R 組/R-T-R 組/R-R-T 組)之一。Ⅰ期臨床試驗研究室藥師根據隨機化列表為每階段試驗分配試驗用藥品。
每個周期給藥當日,在室溫條件下空腹(空腹試驗)或進食高脂餐食后(30±0.5)min(高脂餐后試驗)口服萬儀1 片(0.3 g)或曲萊1 片(0.3 g),240 ml 水送服。服藥后要檢查口腔和盛藥容器,以確保藥物的正確服用。受試者在給藥前1 h 至給藥后1 h 內禁止飲水,給藥后4 h 內禁食。
1.5 藥物安全性評價 安全性評價指標包括不良事件,嚴重不良事件,合并用藥,臨床實驗室結果的改變(血常規、血生化、尿常規等),臨床癥狀、生命體征測定結果,12-導聯心電圖和體格檢查結果。
參考NCI CTCAE 5.0 標準評估不良事件嚴重程度,根據藥物與不良事件因果關系判斷標準,將不良事件與受試藥物應用的相關性分為五級,肯定有關、很可能有關、可能有關、可能無關、肯定無關。所有臨床事件和有臨床意義的實驗室不良反應均按照常見不良反應事件評價標準NCI CTCAE5.0 版進行處理。臨床事件和有臨床意義的實驗室檢測異常均將按照NCI CTCAE5.0 進行分級。無論是否被視為與治療相關,均必須定期監測發生不良事件的所有受試者(如果可行),直至癥狀消退、任何異常實驗室值恢復正常或恢復至基線水平或認為它們不可逆,或直至可恰當解釋所觀察到的變化。
1.6 安全性分析 統計不良事件、嚴重不良事件、不良反應、嚴重不良反應的發生率。
2 結果
2.1 試驗完成情況 空腹試驗入組56 例,男46 例,女10 例;漢族54 例,土家族2 例;年齡最小18 歲,最大40 歲,平均年齡(26.04±4.97) 歲;平均身高(169.62±7.20)cm;平均體重(63.58±8.05)kg;BMI 最小19.0 kg/m2,最大26.0 kg/m2,平均BMI(22.07±2.10)kg/m2。55 例受試者完成了2 個周期的給藥試驗。1 例完成第1 個周期后自行退出研究。
餐后試驗入組75 例,男60 例,女15 例;漢族72 例,土家族2 例,彝族1 例;年齡最小18 歲,最大43 歲,平均年齡(28.29±5.92)歲;平均身高(168.11±7.75)cm;平均體重(64.39±7.94)kg;BMI 最小19.3 kg/m2,最大25.6 kg/m2,平均BMI(22.73±1.74)kg/m2。71 例受試者按照方案完成了3 個周期的給藥,1 例受試者隨機后未給藥退出,3例受試者第1個周期給藥后自行退出。
2.2 安全性分析 空腹56 例受試者均納入全分析集(FAS)、安全數據集(SS)。空腹試驗萬儀組出現2例(3.6%,2/55)受試者發生3 例次不良反應,曲萊組出現11 例(19.6%,11/56)受試者發生11 例次不良反應,均無嚴重不良反應。見表1,表2。全部不良反應均隨訪至痊愈/恢復。見表3。
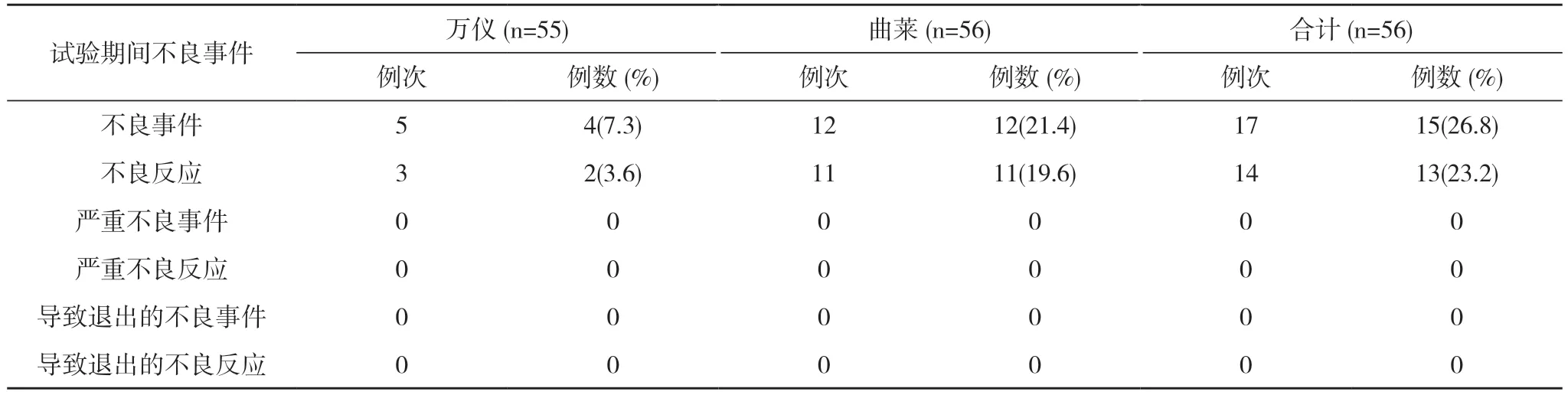
表1 空腹試驗期間不良事件發生情況(SS)
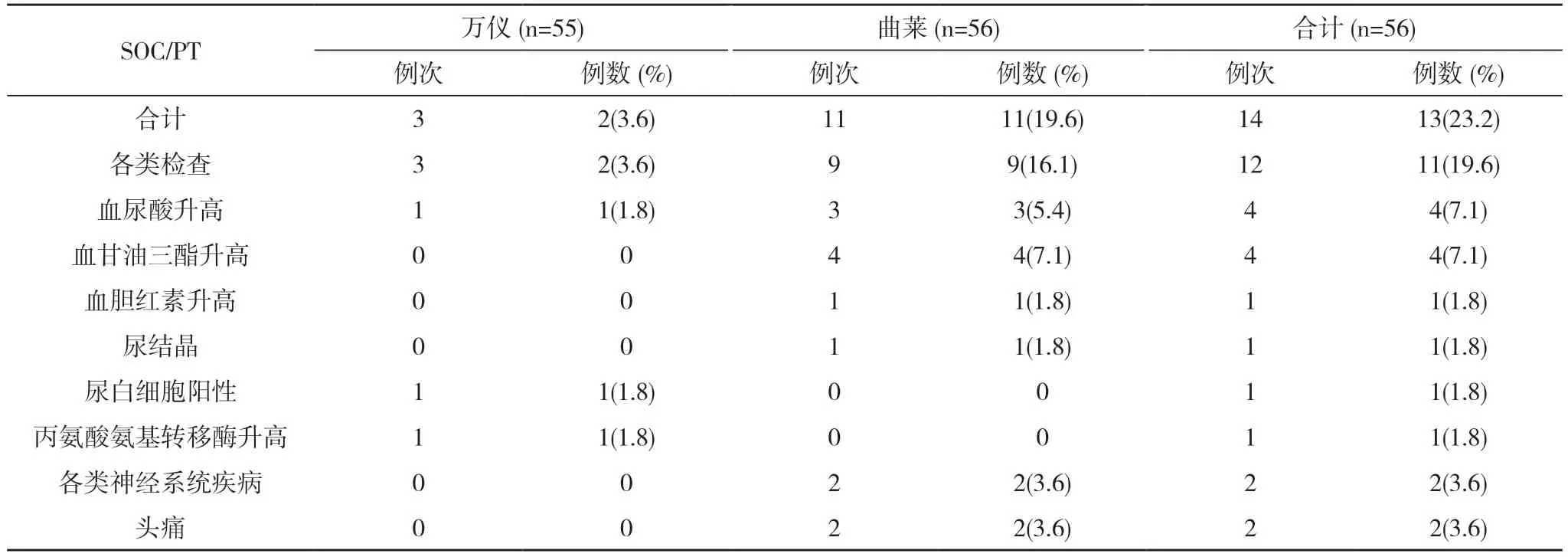
表2 空腹試驗各系統不良反應發生情況(SS)
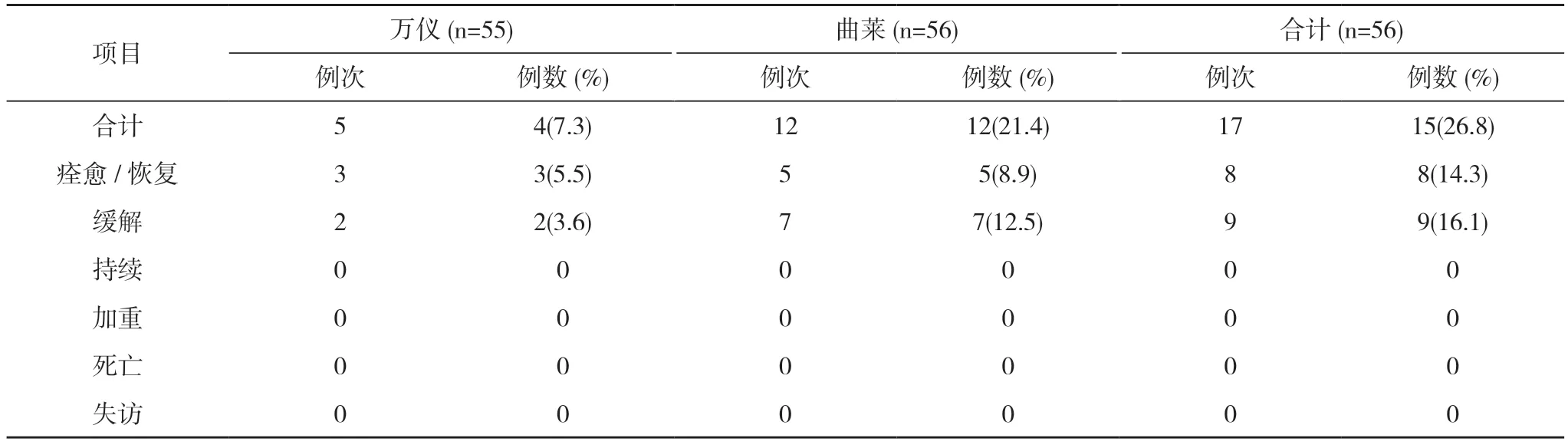
表3 空腹不良事件轉歸(SS)
餐后試驗75 例受試者均納入FAS,74 例受試者納入SS(1 例因拒絕進食高脂餐未給藥,并退出研究)。餐后試驗萬儀組出現10 例(14.1%,10/71)受試者發生10 例次不良反應,曲萊組出現16 例(21.6%,16/74)受試者發生20 例次不良反應,均無嚴重不良反應。見表4,表5。全部不良反應均隨訪至痊愈/恢復,見表6。
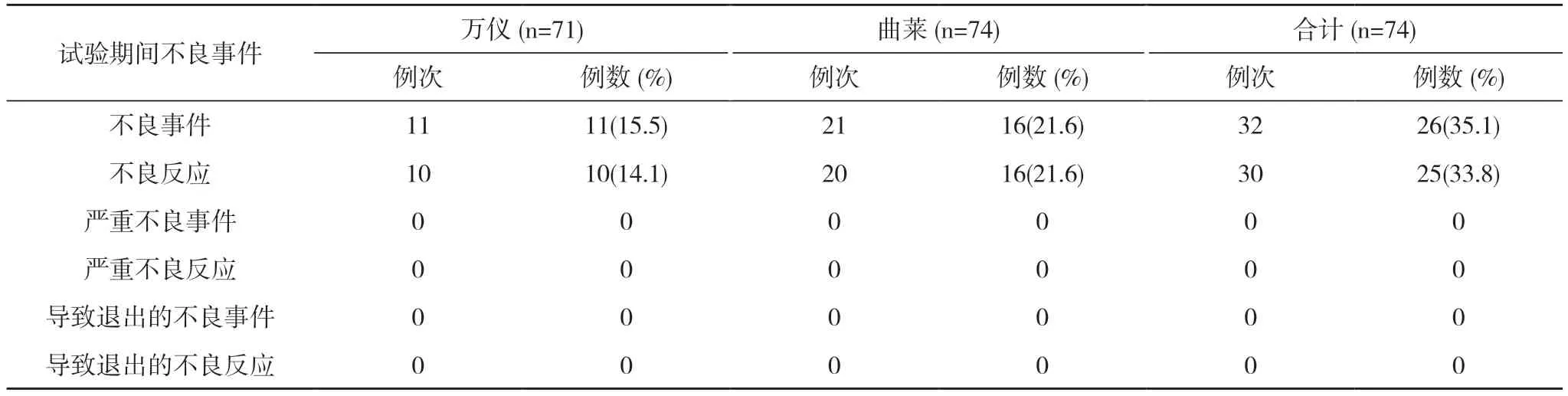
表4 餐后試驗期間不良事件發生情況(SS)
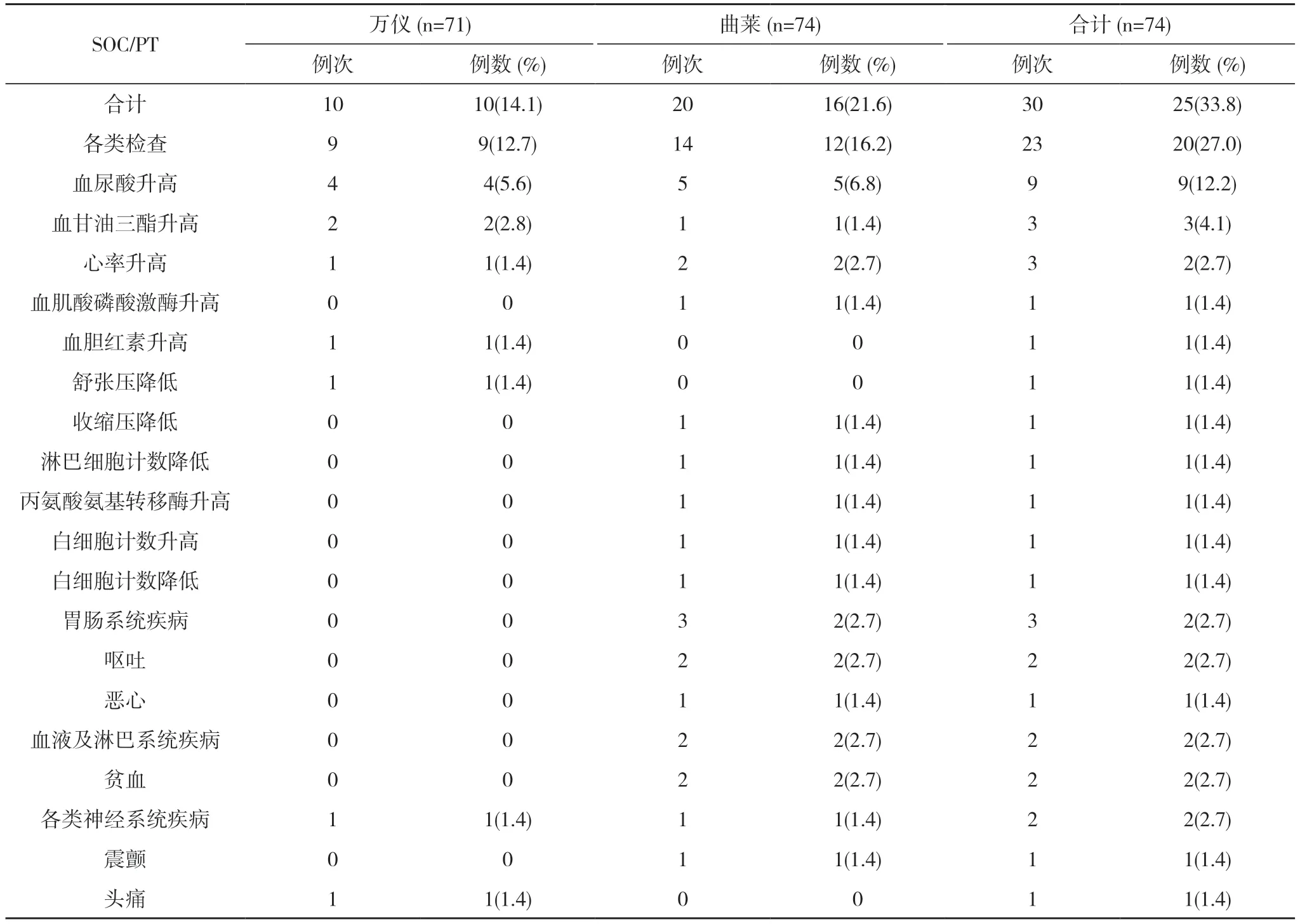
表5 餐后試驗各系統不良反應發生情況(SS)
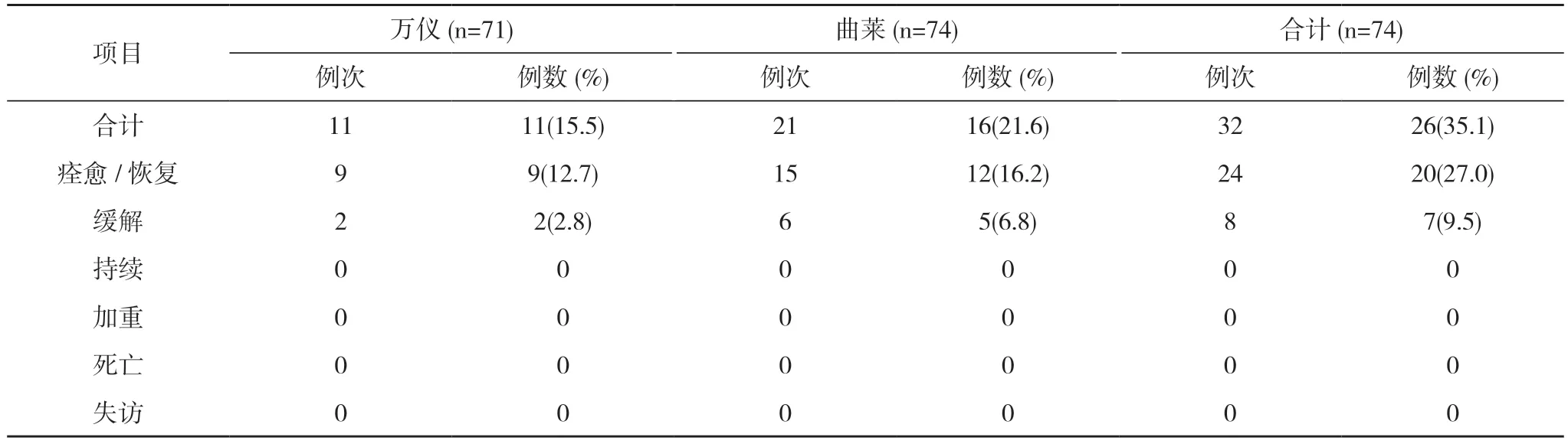
表6 餐后試驗不良事件轉歸(SS)
統計結果表明,萬儀組的不良事件、不良反應略少于曲萊,但2 種制劑的不良事件、不良反應的發生率、種類、嚴重程度和轉歸無統計學差異。
3 討論
奧卡西平片作為第二代抗癲癇藥物,在世界及中國大規模臨床應用已有20 余年,安全性和耐受性較好已成為醫學界共識[7,8]。本研究結果亦表明,國產仿制藥奧卡西平片(萬儀)和進口原研藥奧卡西平片(曲萊)的不良反應較輕,主要表現為尿酸升高和甘油三酯升高。兩種制劑在試驗期間均無嚴重不良事件發生,不良反應發生率、類型、嚴重程度和轉歸無統計學差異,且全部治愈或緩解,無持續、加重或死亡發生。
綜上所述,國產仿制藥奧卡西平片(萬儀)與進口原研藥奧卡西平片(曲萊)在中國健康受試者空腹及餐后單次口服給藥安全性良好。

