NLRP3炎癥小體在熱應激損傷中的作用研究
楊麗麗 李 斌 倪海東
(南通大學附屬醫院兒科 南通 226001)
小兒熱性驚厥(Febrile Seizures,FS)主要是因為發熱所引起的,對于6個月-5歲的幼兒有著較高的發病率[1]。尤其是在我國的南方地區,發病率達到了16%。關于FS的發病機制,主要是由于異常過度放電引起[2],所以是難以進行預測的,主要的診斷手段為影像學、腦電波記錄、腰椎穿刺等等,這些都是屬于有創診斷,會對患兒的身體造成較大傷害。由于缺少FS治療手段,所以在臨床上往往是通過藥物緩解癥狀,但是具有一定的副作用[3]。炎癥小體是胞漿當中的多蛋白復合物,可以對受體進行識別以及危險信號傳導,激活下游級聯反應。相關研究表明,NLRP3炎癥小體在很多疾病當中都會產生炎癥反應[4]。本文基于此,對NLRP3炎癥小體在熱應激損傷中的作用進行了研究。研究報告如下。
1 材料與方法
1.1 設備
生物超凈臺DMEM培養基(美國Hcyclone),胎牛血清(美國GIBCO),青鏈霉素(美國GIBCO),MTT(美國GIBCO),DMSO(美國Sigma公司),蘇木精-伊紅染液(上海舜田生物有限公司)[5]。
1.2 方法
選擇2019年5月1日-2021年11月1日在南通大學附屬醫院就診的90例6月-6歲FS患兒作為熱性驚厥組(FS組),其中單純性熱性驚厥患兒(SPS)52例,復雜性熱性驚厥患兒(CFS)38例。選擇同一時期到我院進行健康體檢的25例健康兒童作為對照組。通過PCR的方法對外周血NLRP3、ASC和Caspase-1mRNA的表達進行檢測,通過ELISA法檢測患者外周血IL-1β、IL-6, TNF-α、NSE表達水平進行檢測。納入標準:FS診斷標準:根據第八版《諸福棠實用兒科學》,并最終確診原發病為急性上呼吸道感染[6]。CFS入選標準:長時間的驚厥發作,持續時間≥15min;叢集式發作,24h內反復發作≥2次;局灶性發作,且熱退1周后有腦電圖異常;反復頻繁的驚厥發作,累計發作總次數≥5次。具備上述1條即可診斷為CFS。排除標準:1)有原發性的顱腦損傷患兒;2)有顱內感染的患兒;3)CT/MRI檢查有異常的患兒;4)確診癲癇的患兒;5)維生素D缺乏低Ca性抽搐;6)其他電解質紊亂引起的抽搐;7)代謝性疾病引起的抽搐;8)出生為早產兒或過期產兒[7]。
建立FS動物模型,選擇20只SPF級別周齡2周的正常SD大鼠作為研究對象,通過熱水浴誘導驚厥的方式進行建模,FS5級行為評分標準進行評分。共分為五級,癥狀從輕到重[8]。使用RIPA裂解液對蛋白進行裂解,溫度為4℃,在12000g下離心15min,靜置10min后取上清液,按照每孔30ug進行蛋白分離。最后,為了探討NLRP3炎癥小體抑制劑在反復FS當中的保護作用,將大鼠分為FS組(n=10)、FS+NLRP3炎癥小體抑制劑組(n=10),在熱水浴槽當中進行誘導,觀察驚厥行為的特征,若出現跌倒或者痙攣,將其當做第一次的驚厥發作,并講放入熱水浴槽到驚厥發作的時間進行記錄,發作驚厥后放入常溫平板中進行休息,休息時間5min,隨后重新放入熱水浴槽,若再次出現驚厥行為,將其當做第二個發作。實驗時長為55min,若沒有發生驚厥性為,則當做未出現驚厥發作。誘發驚厥 2次/d,共 10次。比較兩組潛時。
2 結果
2.1 兩組患兒外周血相關數據變化
將兩組患兒的外周血相關數據變化進行記錄。研究結果表明,FS組患兒的IL-1β、IL-6、NLRP3、TNF-α明顯升高,且相較于正常對照組,具有統計學差異(P<0.05)。具體數據如表1所示。

表1 兩組患兒外周血相關數據變化
2.2 大鼠模型實驗結果
將大鼠分為FS組和FS+NLRP3炎癥小體抑制劑組,對大鼠進行熱水浴模型測試,觀察兩組大鼠的驚厥發作潛時。研究結果表明,FS組大鼠的潛時明顯低于FS+NLRP3炎癥小體抑制劑組,且在數據的對比中具有統計學差異(P<0.05),如表2所示。
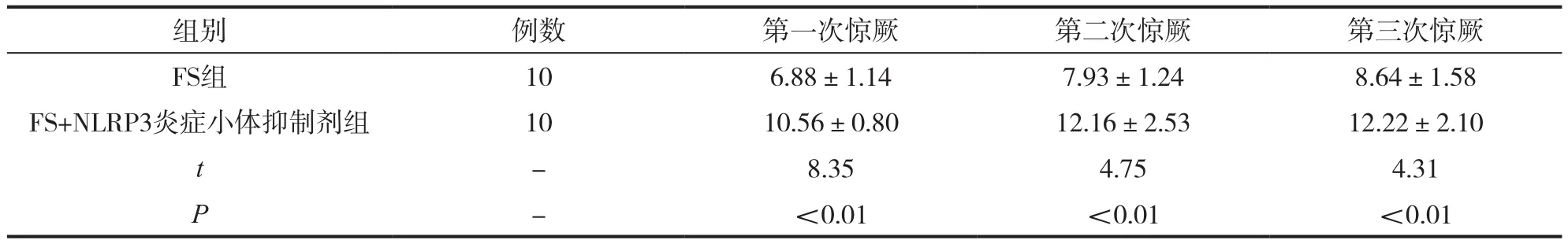
表2 兩組大鼠驚厥行為潛時對比
2.3 兩組大鼠在不同時間的生存率比較
將兩組大鼠在不用時間內的生存率進行比較,研究結果表明,1小時內,兩組大鼠的生存率無明顯差異(P>0.05),在2小時后,兩組大鼠的生存率具有明顯差異,在平均生存時間上也具有統計學差異(P<0.05)。具體數據如表3所示。
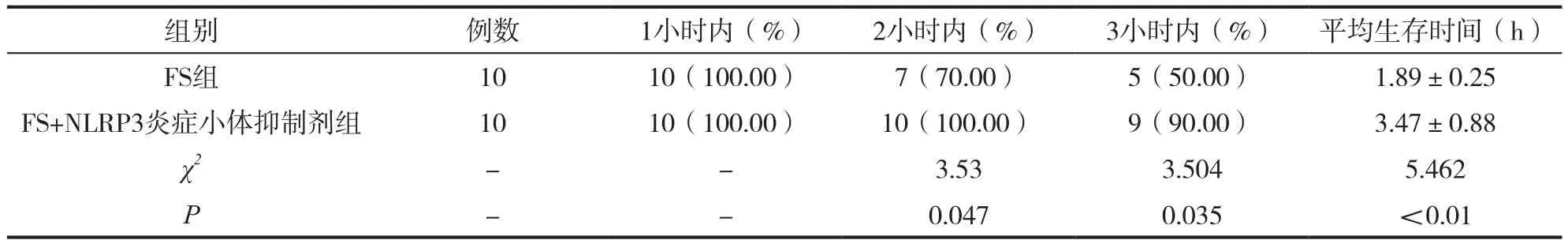
表3 兩組大鼠在不同時間的生存率比較(%)
3 討論
當前關于熱應激損傷的發病機制還不是很完善,這與兒童神經系統的發育功能有著密切的關系,由于神經系統的發育功能不完全,導致神經元的微環境受到了影響[9]。相關研究表明,FS的發生與呼吸性堿中毒有關,隨著患兒體溫的升高,會導致機體通氣過度,提高二氧化碳的濃度,直接引起呼吸性堿中毒[10]。由于高熱所引起的炎癥對幼兒的生活質量造成了較大的影響,高熱相關的因子包括白介素-1β(IL-1β)、白介素-1α(IL-1α)、腫瘤壞死因子α(TNF-α)、白介素6(IL-6)等[11],這些因子的表達在熱驚厥患者中都有明顯的提高。在某項大鼠模型研究中,缺乏IL-1β受體的大鼠更加耐受熱驚厥,說明IL-1β參與到驚厥的發生中。隨后對周齡為2周的大鼠注射紅藻氨酸[12],從而建立熱驚厥模型,結果表明IL-1β在熱性驚厥中有潛在的發生作用。NLRP3炎癥小體是由NLRP3、ASC、pro-caspase-1所組成[13],是一種多聚體的蛋白復合物。在受到高熱的刺激之后,炎癥因子會啟動[14]。細胞受到高熱影響時,細胞當中的識別受體PRRs(Pattern Recognition Receptors)會與結合分子ASC、NLRP3、caspase-1組成完整的炎癥小體。NLRP3炎性小體能使磷酸化caspase-1去磷酸化,活化的caspase-1促進 IL-1β、白介素-18 ( IL-18) 炎性因子前體的成熟,由此可見 NLRP3 炎性小體活化是IL-1β成熟的關鍵。盡管臨床研究及動物實驗均證實IL-1β在熱性驚厥中表達上調,但是目前國內外尚沒有關于NLRP3炎癥小體與小兒熱性驚厥的發作關系研究的報道[15]。
本文基于此,對NLRP3炎癥小體在熱應激損傷中的作用展開了研究。研究結果表明,熱性驚厥組患兒,尤其是復雜性熱性驚厥患兒(CFS)的IL-1β、IL-6、NLRP3、TNF-α有明顯的升高,相較于正常對照組具有統計學差異。在大鼠模型的研究中,FS組大鼠驚厥潛時明顯低于FS+NLRP3炎癥小體抑制劑組,表明有了抑制劑的加成,大鼠的驚厥潛時增加,驚厥次數較少。在不同時間內大鼠生存率的比較中,1小時內兩組大鼠的生存率無明顯統計學差異,在兩小時后,FS+NLRP3炎癥小體抑制劑組的大鼠潛時明顯高于FS組,且在平均生存時間上高于FS組,具有統計學差異。
綜上所述,NLRP3炎癥小體會參與到熱應激損傷中,會對NLRP3炎癥小體進行抑制,并且提高大鼠的生存時間。可提高患兒的IL-1β、IL-6、NLRP3、TNF-α等相關指標,增加大鼠模型的驚厥潛時,且NLRP3炎癥小體的激活與IL-1β有著密切的關系。是熱應激損傷中非常重要的指標之一,需要重視。

