SLE合并惡性淋巴瘤患者血清sIL-2R、HMGB1、25(OH)D3水平變化的意義及其與SLEDAI積分的相關性*
林福安,黃曉璐,趙 婷,郭月麗,陳宏浦△
1.福建醫科大學附屬漳州市醫院風濕免疫科,福建漳州 363000;2.漳州衛生職業學院,福建漳州 363000
系統性紅斑狼瘡(SLE)是一種多系統損害的慢性自身免疫性疾病,由于自身免疫系統紊亂,且長期服用激素和免疫抑制藥物,SLE容易合并其他疾病,如惡性腫瘤,尤其是血液系統腫瘤[1-3]。惡性淋巴瘤(ML)是一種起源于淋巴組織或淋巴結的血液系統惡性腫瘤,當SLE合并ML時因二者臨床表現相似,病情復雜難辨[4],因此,臨床上迫切希望能找到對SLE合并ML有用的臨床早期預警指標或是血清標志物。研究表明,某些細胞因子分泌紊亂可促進腫瘤細胞生長,其中可溶性白細胞介素2受體(sIL-2R)在B淋巴細胞生長、分化及成熟中發揮至關重要作用,參與免疫調節、腫瘤發生及生長,為關鍵的腫瘤生長因子[5-6];高遷移率族蛋白B1(HMGB1)在多種實體腫瘤組織及細胞中表達豐富,與腫瘤的發生、侵襲轉移等生物學行為關系密切[7-8];維生素D作為人體內多種細胞的轉錄因子,可誘導腫瘤細胞分化,抑制腫瘤細胞增殖,加速腫瘤細胞凋亡,以及免疫調節等作用[9-10]。本研究通過觀察SLE合并ML患者血清sIL-2R、HMGB1、25-羥維生素D3[25(OH)D3]水平,分析其與系統性紅斑狼瘡疾病活動指數(SLEDAI)積分的相關性,旨在為SLE合并ML的臨床診療提供依據。
1 資料與方法
1.1一般資料 回顧性選取2015年1月至2015年12月福建醫科大學附屬漳州市醫院收治的30例SLE合并ML患者作為觀察組,另選取同期收治的30例未合并ML的SLE患者作為對照組。納入標準:SLE診斷滿足中華醫學會風濕病學分會2010年發布的《系統性紅斑狼瘡診斷及治療指南》中的SLE診斷標準[11];ML診斷符合2008年世界級衛生組織造血和淋巴組織腫瘤分類中ML診斷標準[12]。排除標準:納入前3個月內接受活性維生素D、糖皮質激素類藥物治療患者;合并其他慢性疾病,如干燥綜合征、類風濕關節炎、系統性硬化癥、炎性肌病等患者;伴有嚴重感染患者;合并嚴重心肝腎疾病患者;伴有嚴重神經系統病變患者;哺乳期或妊娠期婦女。本研究獲福建醫科大學附屬漳州市醫院倫理委員會審核批準(批準號:漳醫倫2015023號)。
1.2方法 抽取所有受試者清晨空腹狀態下靜脈血3 mL,以轉速3 500 r/min、離心半徑9.5 cm高速離心10 min,分離血清,將血清置于-80 ℃環境下保存待檢;以雙抗體夾心酶聯免疫吸附試驗測定sIL-2R、HMGB1、25(OH)D3水平,相應試劑盒均購自上海一研生物科技有限公司,操作嚴格遵循試劑盒說明書進行。
1.3觀察指標 收集兩組的臨床資料,比較兩組臨床資料及血清sIL-2R、HMGB1、25(OH)D3水平,分析SLE合并ML的影響因素,評價SLEDAI積分、sIL-2R、HMGB1、25(OH)D3對SLE合并ML的診斷價值,并進行個體值預測驗證,分析sIL-2R、HMGB1、25(OH)D3與SLEDAI積分相關性。

2 結 果
2.1兩組臨床資料及血清sIL-2R、HMGB1、25(OH)D3水平比較 兩組年齡、性別、體質量指數(BMI)、SLE病程、吸煙史、飲酒史比較,差異無統計學意義(P>0.05);觀察組SLEDAI積分及血清sIL-2R、HMGB1水平明顯高于對照組,25(OH)D3水平明顯低于對照組,差異均有統計學意義(P<0.05)。見表1。
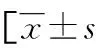
表1 兩組臨床資料及血清sIL-2R、HMGB1、25(OH)D3水平比較或n(%)]
2.2SLE合并ML影響因素的Logistic回歸模型分析 以SLE患者是否合并ML為因變量(否=0,是=1),以SLEDAI積分、sIL-2R、HMGB1、25(OH)D3作為自變量(賦值以各指標均值為界,≤均值=0,>均值=1),構建Logistic回歸模型,分析結果顯示,SLEDAI積分、sIL-2R、HMGB1是SLE合并ML的獨立危險因素,25(OH)D3是SLE合并ML的獨立保護因素(P<0.05)。見表2。
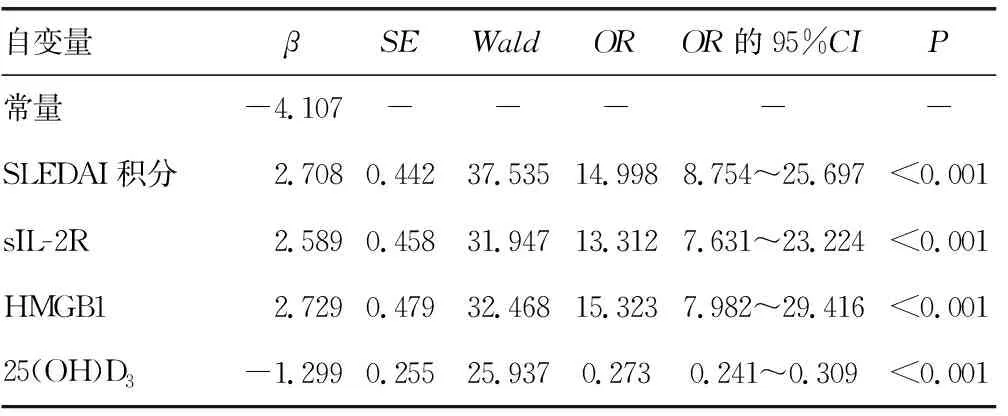
表2 SLE合并ML影響因素的Logistic回歸模型分析
2.3SLEDAI積分、sIL-2R、HMGB1、25(OH)D3對SLE合并ML的診斷價值 以觀察組作為陽性樣本,對照組作為陰性樣本,繪制ROC曲線,結果顯示,SLEDAI積分、sIL-2R、HMGB1、25(OH)D3單獨診斷SLE合并ML的AUC分別為0.728、0.779、0.741、0.711;利用Stata10.0軟件中Predict pre1命令,將SLEDAI積分、sIL-2R、HMGB1、25(OH)D3經Logistic回歸模型擬合生成聯合預測因子,使用roctab sepsis pre1,d命令,列出聯合預測因子取不同值時對應的靈敏度、特異度和預測準確率,取約登指數為最大值時聯合預測因子所對應的數值作為最佳臨界值(即0.045),得到SLEDAI積分、sIL-2R、HMGB1、25(OH)D3聯合診斷SLE合并ML的AUC為0.868,其較各指標單獨診斷的價值明顯提高。見表3、圖1。
表3 SLEDAI積分、sIL-2R、HMGB1、25(OH)D3對SLE合并ML的診斷價值
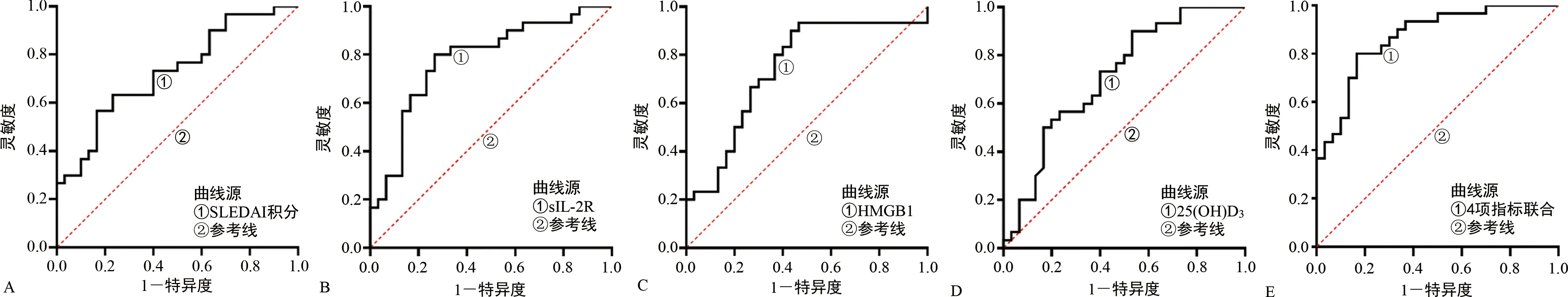
注:A、B、C、D分別為SLEDAI積分、sIL-2R、HMGB1、25(OH)D3單獨診斷SLE合并ML的ROC曲線,E為4項指標聯合診斷SLE合并ML的ROC曲線。圖1 SLEDAI積分、sIL-2R、HMGB1、25(OH)D3診斷SLE合并ML的ROC曲線
2.4個體值預測驗證 將原Logistic方程變形后得到個體的預測概率方程為P=1/{1+e-[-4.107+2.708×SLEDAI積分+2.589×sIL-2R+2.729×HMGB1-1.299×25(OH)D3]},其中e為自然對數的底數,保留3位小數點e=2.718。隨機抽取1例患者,其各自變量取值為SLEDAI積分=1;sIL-2R=0;HMGB1=1;25(OH)D3=0,代入概率預測方程得到概率值P=0.265,大于最佳臨界值,故在預測準確率為85.41%的條件下,該患者會發生ML,且符合臨床實際。
2.5SLE合并ML患者血清sIL-2R、HMGB1、25(OH)D3水平與SLEDAI積分的相關性分析 Pearson相關分析結果顯示,SLE合并ML患者血清sIL-2R、HMGB1水平與SLEDAI積分呈正相關(r=0.740、0.760,P<0.05),25(OH)D3水平與SLEDAI積分呈負相關(r=-0.745,P<0.05),見圖2。
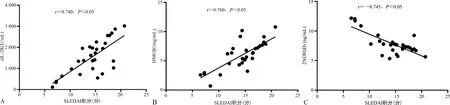
注:A為sIL-2R與SLEDAI積分間關系散點圖;B為HMGB1與SLEDAI積分間關系散點圖;C為25(OH)D3與SLEDAI積分間關系散點圖。圖2 sIL-2R、HMGB1、25(OH)D3與SLEDAI積分間關系的散點圖
3 討 論
近年來,隨著臨床對風濕免疫性疾病研究的不斷深入,逐漸發現風濕免疫性疾病與惡性腫瘤之間存在著越來越多的聯系,特別是關于原發性干燥綜合征合并ML已有諸多報道,但對于SLE與惡性腫瘤,尤其是合并ML報道相對較少。相關研究指出,惡性腫瘤發生、發展過程中,可模擬風濕免疫性疾病表現,致使臨床診治延遲,而風濕免疫性疾病治療期間大量應用細胞毒性藥物及免疫抑制劑,也可明顯增加惡性腫瘤患病風險[13]。國外學者對SLE患者隨訪發現,SLE患者腫瘤發生風險約為普通人群的1.4倍,并認為SLE主要與血液系統腫瘤有關[14]。因此,臨床早期預警、診斷SLE合并ML尤為關鍵。
白細胞介素-2(IL-2)作為CD4淋巴細胞釋放的淋巴因子,可增強自然殺傷細胞活性、促進T細胞增殖及細胞毒性T細胞的殺傷性,但IL-2只有結合IL-2R后才可發揮其生物學功能,當機體受到變應原入侵后,淋巴細胞被激活,大量分泌IL-2R,釋放入血液中形成sIL-2R,故sIL-2R是反映淋巴細胞是否被抗原激活的敏感性標志物[15-16]。sIL-2R作為一種復合性黏蛋白,同時也是一種重要的免疫抑制劑,可減弱機體內分泌效應,抑制已活化T細胞克隆化擴增[17]。本研究中SLE合并ML患者血清sIL-2R水平明顯高于SLE患者(P<0.05),sIL-2R主要由腫瘤細胞生成并釋放入血,其表達水平反映機體免疫狀態,推測sIL-2R可為SLE合并ML診斷提供重要參考。進一步研究顯示,sIL-2R診斷SLE合并ML的AUC為0.779,充分證實上述觀點,說明sIL-2R用于診斷SLE合并ML具有一定診斷效能。此外,本研究中SLE合并ML患者sIL-2R水平與SLEDAI積分呈正相關(r=0.740,P<0.05),提示隨SLEDAI積分增加,SLE患者sIL-2R水平明顯升高。
HMGB1是一種廣泛存在于真核生物細胞內的非組蛋白染色質核蛋白,其過表達可抑制細胞凋亡、誘導細胞分化、促進細胞遷移及增殖等作用[18]。近年來,在腫瘤領域的研究發現,HMGB1在肺癌、結腸癌、胰腺癌、白血病、前列腺癌等惡性腫瘤中均呈現為高表達狀態,與新生血管形成、腫瘤細胞增殖、侵襲轉移及凋亡等密切相關[19-20],這提示HMGB1可能在腫瘤的發生過程中發揮至關重要的作用。本研究中SLE合并ML患者血清HMGB1水平明顯高于SLE患者(P<0.05),其診斷SLE合并ML的AUC為0.741,提示HMGB1對SLE合并ML具有一定診斷效能,可為該病早期預警、診斷提供依據。另有研究指出,HMGB1高水平可抑制細胞凋亡,相反,抑制HMGB1分泌可促進細胞凋亡[21],提示HMGB1與惡性腫瘤病情程度有關。本研究中SLE合并ML患者HMGB1水平與SLEDAI積分呈正相關(r=0.760,P<0.05),說明隨SLE疾病活動度增加,HMGB1水平明顯升高,二者均與ML發病密切相關。
25(OH)D3作為體內維生素D主要存在形式,通常用于測定體內維生素D狀態。現階段有關維生素D的研究不斷增加,發現其除了維持體內鈣磷平衡的作用外,同時還存在諸多潛在的調節其他細胞功能,如血管生成、細胞凋亡、分化及免疫調節等[22-23]。25(OH)D3可在腎臟、淋巴瘤細胞等其他組織中經1-α羥化酶作用下轉化為1,25(OH)2D3,而后者可通過結合維生素D轉錄因子受體發揮作用,進而調節將近200個基因表達[22]。此外,造血系統中維生素D受體表達于各種造血前體、單核細胞、部分胸腺細胞及活化的B、T淋巴細胞[24]。本研究中,SLE合并ML患者血清25(OH)D3水平明顯低于SLE患者(P<0.05),表明維生素D水平在SLE合并ML患者體內明顯下降,分析原因,可能是由于ML患者體內維生素D與造血系統中維生素D受體結合,發揮抑制腫瘤細胞增殖、促進凋亡的作用,導致維生素D消耗明顯增加。同時,25(OH)D3診斷SLE合并ML的AUC值為0.711,且其水平與SLEDAI積分呈負相關(r=-0.745,P<0.05),充分證實維生素D可作為SLE合并ML疾病活動情況判斷的一個標志物,并提示其可能是該疾病治療的一個靶點。
進一步研究顯示,SLEDAI積分、sIL-2R、HMGB1、25(OH)D3聯合診斷SLE合并ML的AUC最大,且經個體值預測驗證,4項指標聯合診斷效能良好。
綜上所述,SLE合并ML患者血清sIL-2R、HMGB1水平明顯升高,25(OH)D3水平明顯下降,且均與SLEDAI積分有關。檢測血清sIL-2R、HMGB1、25(OH)D3水平,有助于早期預警、診斷SLE合并ML,并為臨床診療提供依據。

