卷枝毛霉利用玉米秸稈水解液發酵產油脂研究
楊月萍,黨文瑞,王艷霞,孫 鑫,付文清,張 靖,劉煜琦銘,孫中慧,張 瑤,2*
(1.山東理工大學農業工程與食品科學學院,山東淄博 255000;2.濟南大學文化和旅游學院,山東濟南 250022)
隨著化石資源的日益短缺和可再生能源產品需求的日益增加,產油微生物在細胞內可積累合成大量甘油三酯,因此成為生產生物柴油的重要替代原料[1-4]。此外,少數真菌、微藻、細菌等還能合成對人類健康十分有益的功能性多不飽和脂肪酸,如花生四烯酸(Arachidonic acid)、γ-亞麻酸(γ-linolenic acid)、二十二碳六烯酸(Docosahexaenoic acid)、二十碳五烯酸(Eicosapentaenoic acid)等,這些具有生物活性的脂肪酸已被認定為重要的營養食品資源[5-7]。雖然開發利用微生物合成油脂具有廣闊的前景,但高成本是限制其工業化生產的主要因素。
木質纖維素是自然界中最豐富、最廉價的可再生原料之一,我國僅農作物秸稈每年產量達10 億t,以木質纖維素為原料發酵生產微生物油脂已成為相關產業的終極目標[8-9]。木質纖維素主要由纖維素、半纖維素和木質素組成,其完全水解后可得到大量可溶性單糖,主要有葡萄糖和木糖,而木糖較難被微生物利用[10-13]。此外,在木質纖維素水解處理過程中,一般還會產生乙酸、糠醛等抑制微生物生長的副產物[14-18]。因此,最佳利用木質纖維素發酵產油脂的微生物,需能代謝多種糖類,尤其是木糖,且對水解液中的副產物有一定的耐受性,這樣才能高效利用木質纖維素生產脂質,如若脂質中富含人體所必須的高附加值多不飽和脂肪酸則能產生更高的經濟效益。
產脂真菌卷枝毛霉(Mucor circinelloides)是研究脂質積累機制的模式生物,也曾用于工業化生產γ-亞麻酸[19-21],并能夠代謝木質纖維素水解液中的多種糖類(如葡萄糖、木糖等),是將木質纖維素轉化為功能性脂質的理想微生物之一[22-25]。目前開拓出利用廉價原料發酵生產微生物油脂的方法成為我國未來生物柴油產業及功能性油脂發展的關鍵。本研究初步考察了玉米秸稈稀酸水解的條件,并研究了高產脂質菌株卷枝毛霉WJ11 在玉米秸稈水解液中發酵產油脂的特性,為實現微生物高效轉化農業廢棄原料生產油脂奠定理論基礎。
1 材料與方法
1.1 試驗材料
菌株:卷枝毛霉WJ11(保藏編號CTCC No.M 2014424)由本實驗室保藏。
玉米秸稈,購于山東犇騰農牧機械銷售有限公司。
1.2 試劑及培養基
無水葡萄糖、MgSO4·7H2O、酒石酸銨、CaCl2·2H2O、KH2PO4、Na2HPO4、硫 酸 銨、FeCl3·6H2O、ZnSO4·7H2O、CuSO4·5H2O、Co(NO3)2·6H2O、MnSO4·5H2O、鹽酸、甲醇硫酸、氯化鈉、正己烷、十五烷酸、Ca(OH)2、氫氧化鈉、異丙醇,分析純,中國醫藥(集團)化學試劑有限公司;蛋白胨、酵母浸粉,生化試劑,北京奧博星生物技術有限公司;氯仿,分析純,煙臺遠東精細化工有限公司。
種子培養基:葡萄糖30 g/L,酒石酸銨3.3 g/L,KH2PO47.0 g/L,Na2HPO42.0 g/L,MgSO4·7H2O 1.5 g/L,酵母浸粉1.5 g/L,CaC12·2H2O 0.1 g/L,FeCl3·6H2O 0.008 g/L,ZnSO4·7H2O 0.001 g/L,CuSO4·5H2O 0.000 1 g/L,Co(NO3)2·6H2O 0.000 1 g/L,MnSO4·5H2O 0.0001 g/L[25]。
發酵基礎培養基:除碳源、氮源改變外,其它成分同種子培養基。
1.3 儀器與設備
電熱鼓風干燥箱、恒溫培養箱,上海一恒科學儀器有限公司;HABCONCO 型冷凍干燥機,照生有限公司;霉菌培養箱,上海新苗醫療器械制造有限公司;LE-3002E/02 型電子天平,梅特勒-托利多儀器(上海)有限公司;Agilent 6890N 氣相色譜儀,安捷倫科技有限公司;L530 型水平離心機,湖南湘儀實驗室儀器開發有限公司;實驗室通風柜,豪邁儀器制造有限公司;ZHJH-C1115C 型超凈工作臺,上海智城分析儀器制造有限公司;HWS-28 型蒸汽滅菌鍋,TOMY KOGYD CO.LTD;QL-861 漩渦混合器,其林貝爾儀器制造公司;DK-8D 型電熱恒溫水浴鍋,上海森信實驗儀器有限公司;Thermo707 型超低溫冰箱,REVCO;SHZ-D(Ⅲ)型循環水式真空泵,予華儀器有限責任公司。
1.4 試驗及分析方法
1.4.1 卷枝毛霉的擴大培養
將卷枝毛霉孢子保存液100 μL(107CFU/mL)接種到100 mL 種子培養基中,28 ℃、130 r/min 培養24 h。根據試驗方案改變培養基組成及培養條件,按一定比例接種量將上述種子液轉接到包含100 mL 發酵培養基的1 L 擋板三角瓶中,28 ℃、130 r/min 培養72 h。
1.4.2 玉米秸稈稀酸水解條件優化
固定溫度121 ℃、高壓、固液比1∶15(g/mL)、稀硫酸體積分數2%的條件下,以水解液中還原糖含量作為衡量指標,進行玉米秸稈稀酸水解條件的單因素試驗。環境壓力設置為高壓(0.2 MPa)、常壓(0.101 3 MPa);固液比設置為1∶10、1∶15、1∶20、1∶25(g/mL);水解時間設置為20、30、40、60、80 min,進行單因素試驗。
1.4.3 菌株發酵條件優化
以脫毒處理后的玉米秸稈水解液作為培養基,將擴大培養24 h 的菌體作為種子液,進行單因素試驗。初始pH 設置為5.0、6.0、7.0;接種量設置為5%、10%、15%、20%;葡萄糖添加量設置為2%、4%、6%;氮源種類設置為硫酸銨、蛋白胨、酵母提取物;酵母提取物濃度設置為1、2、3、4g/L。每個試驗組只改變一個因素,其他條件一致。
1.4.4 玉米秸稈稀酸水解液的制備及脫毒處理
取一定質量的玉米秸稈粉末置于250 mL 的三角瓶中,用體積分數2%的稀硫酸充分水解,充分反應結束后,用真空抽濾機將玉米秸稈水解物中的上清液過濾,棄秸稈殘渣。用固體Ca(OH)2粉末調節pH 至10~11 進行脫毒處理,再次過濾取濾液,棄Ca(OH)2固體粉末,用硫酸回調pH 至所需值。滅菌,無沉淀生成。
1.4.5 水解液中還原糖含量的測定
玉米秸稈稀酸水解液中還原糖含量的測定采用3,5-二硝基水楊酸比色法(DNS)[26]。
1.4.6 菌體生物量測定
將發酵液通過布氏漏斗進行過濾,過濾后的菌體用蒸餾水反復清洗,保存于-80 ℃冰箱中,冷凍干燥。使用前后通過差重法確定各培養物的生物量。
1.4.7 菌體油脂含量及產量與脂肪酸含量及組成測定
參考Folch 等[27]脂質提取方法。將適量凍干菌粉置于盛有2 mL HCl(4 mol/L)的水解管中充分裂解,在80 ℃條件下水浴3~5 h,每隔30 min 漩渦震蕩一次。以十五烷酸(C15:0)為內標物,使用2 mL 氯仿和1 mL 甲醇對提取的脂質充分混勻15 min 進行萃取,離心分離,取下層(氯仿層)借助氮氣吹干,采用差重法測定總油脂含量,加入1 mL 鹽酸甲醇(10%)60 ℃下繼續水浴3 h,將脂類轉化為脂肪酸甲酯(FAMEs),使用2 mL 正己烷和1 mL 飽和生理鹽水充分混勻后離心分離保留上層(正己烷層),借助氣相色譜-質譜聯用儀對合成的主要脂肪酸成分及含量進行分析。油脂含量計算公式見式(1)。
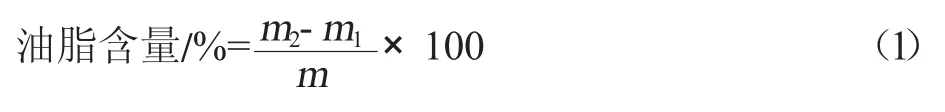
式中,m2為提取且溶劑揮發后提脂瓶的質量,g;m1為潔凈提脂瓶的質量,g;m為稱取的菌體質量,g。
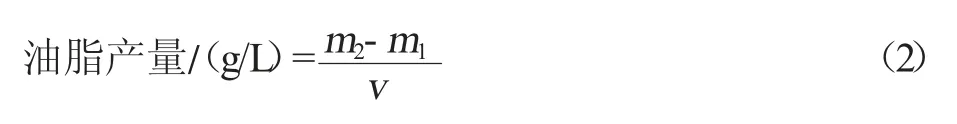
式中,m2為提取且溶劑揮發后提脂瓶的質量,g;m1為潔凈提脂瓶的質量,g;V為發酵液體積,L。
氣相色譜條件:色譜柱VF-5ms(30 m×0.25 mm×0.25 μm);進樣口溫度310 ℃;載氣為高純氮氣;分流比50∶1;柱流速1 mL/min;程序升溫,初始80 ℃,保持2 min,以5 ℃/min 升至240 ℃,以10 ℃/min 升至300 ℃,保持5 min;進樣量1 μL。
質譜條件:離子源EI,電離能量70 eV;離子阱溫度220 ℃;傳輸線溫度280 ℃;全掃描方式;掃描范圍(m/z)50~500;檢索譜庫NIST05。
1.5 數據處理
實驗數據以三次生物學重復試驗的平均值±均值標準誤差(mean±SEM)表示,采用Origin 2018 繪圖并進行數據分析。
2 結果與分析
2.1 玉米秸稈稀酸水解條件的優化
2.1.1 壓力對玉米秸稈水解效果的影響
秸稈預處理方法對水解液組成成分影響較大。為了減少水解液中乙酸、糠醛等抑制劑的釋放,本文選擇較溫和的稀酸預處理方法,即采用體積分數為2%的稀硫酸對玉米秸稈進行水解。早期研究表明,玉米秸稈稀硫酸水解的最佳體積分數為2%[28]。由圖1 可知,當水解時間為20、40、60 min 時,高壓條件下水解的還原糖含量分別為24.4、22.5、20.8 g/L,低壓條件下水解的還原糖含量分別為13.5、13.8、14.2 g/L,采用高壓水解的水解液中的還原糖含量明顯高于常壓水解后水解液中的還原糖含量,因此,玉米秸稈稀酸水解選擇高壓條件。
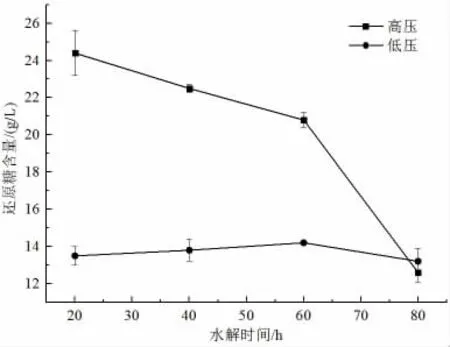
圖1 壓力對玉米秸稈水解效果的影響Fig.1 The effect of pressure on the hydrolysis of corn straw
2.1.2 水解時間對玉米秸稈水解效果的影響
由圖2 可知,當水解時間為20 min 時,水解液中還原糖含量最高達到24.01 g/L。而隨著水解時間的延長,還原糖的含量逐漸減少,這是由于部分還原糖可能轉化為其他副產物而造成含量降低。當水解時間超過60 min后,糖類被進一步分解,導致還原糖含量明顯降低,甚至可能會生成更多的抑制劑,影響后續微生物對水解液的利用。因此,水解時間選擇20 min。
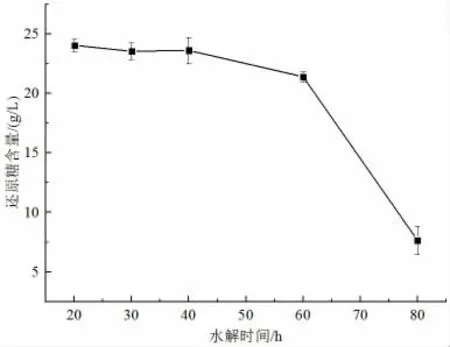
圖2 水解時間對玉米秸稈水解效果的影響Fig.2 The effect of hydrolysis time on the hydrolysis of corn straw
2.1.3 固液比對玉米秸稈水解效果的影響
由圖3 可知,當固液比為1∶10 時,水解液中還原糖含量達到最大值,并且隨著固液比的增大,玉米秸稈水解的還原糖含量逐漸降低。因此,本文中的玉米秸稈稀酸水解試驗的固液比選擇1∶10。
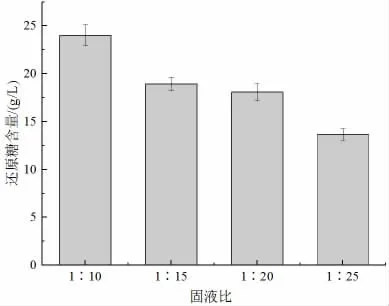
圖3 固液比對玉米秸稈水解效果的影響Fig.3 The effect of solid-liquid ratio on the hydrolysis of corn straw
由以上試驗結果可以看出,在無特殊裝置的條件下,實驗室中玉米秸稈稀酸水解的最佳條件為硫酸體積分數2%,固液比1∶10,121 ℃、高壓下水解20 min。
2.2 卷枝毛霉利用玉米秸稈水解液發酵產油條件優化
2.2.1 水解液脫毒處理對卷枝毛霉發酵產油的影響
經稀酸處理的秸稈水解液一般含有如乙酸、糠醛、5-羥甲基糠醛等抑制物,會影響微生物的生長[18,29]。由圖4 可知,在經過石灰脫毒處理后,發酵菌體的生物量、油脂含量和油脂產量均顯著高于未經脫毒處理的發酵組分,說明用Ca(OH)2處理水解液能夠明顯減少或除去水解液中的抑制性物質,有利于促進菌體生長和脂質積累。
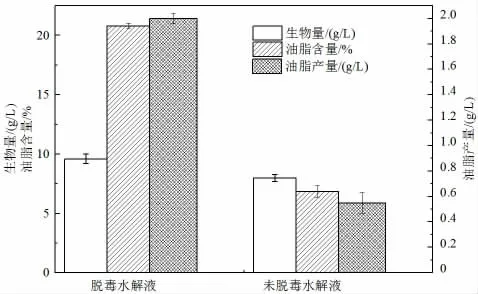
圖4 水解液脫毒處理對卷枝毛霉發酵產油的影響Fig.4 The effect of hydrolysate detoxification treatment on the fermentation of M. circinelloides to produce lipid
2.2.2 發酵時間對卷枝毛霉發酵產油的影響
由圖5 可知,發酵時間為0~60 h 時,隨著發酵時間的延長,菌體的生物量、油脂含量和油脂產量均呈現先升高后降低的趨勢。當發酵60 h 時,菌體生物量、油脂含量、油脂產量均達到最大值,分別為9.6 g/L、20.82%、2.0 g/L。發酵超過60 h,由于發酵液營養物質缺乏,生長環境不適合菌體生長,出現菌體自溶現象,導致生物量減少,油脂產量降低。因此,本研究選擇最佳的發酵時間為60h。
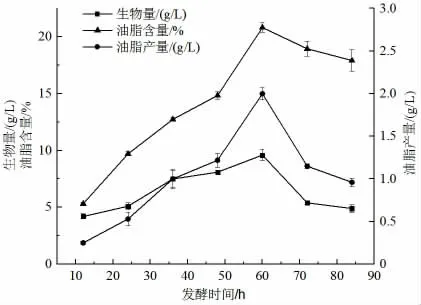
圖5 發酵時間對卷枝毛霉產油效果的影響Fig.5 The effect of fermentation time on the lipid production of M. circinelloides
2.2.3 初始pH 對卷枝毛霉發酵產油的影響
pH 值是影響微生物代謝和產物合成的重要因素[30],它不僅可以影響細胞的通透性,還可以影響培養物質的離子化程度,進而對菌體吸收營養物質產生影響[31]。卷枝毛霉適合生長在微酸性環境中,且菌絲細胞的代謝會產生酸性物質,故試驗設置初始pH 分別為4.0、5.0、6.0、7.0,測定菌體的生物量、油脂含量及油脂產量[32]。由圖6可知,在初始pH 為4.0 時,菌株生長情況較差,所以數據未在圖中顯示。初始pH 為5.0 時,菌體的生物量、油脂含量及油脂產量均達到最大值,分別為10.75 g/L、21.75%和2.34 g/L;而隨著pH 的逐漸上升,菌體的生物量及油脂產量會隨之下降。綜合考慮,卷枝毛霉發酵產油的玉米秸稈水解液培養基最適pH 值為5.0。
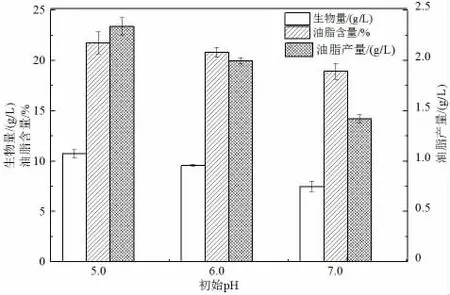
圖6 初始pH 對卷枝毛霉發酵產油的影響Fig.6 The effect of initial pH on the fermentation of M.circinelloides to produce lipid
2.2.4 接種量對卷枝毛霉發酵產油的影響
接種量的大小決定菌體的生長繁殖速度。一般采用較大的接種量可以縮短發酵時間,使產物形成提前到來,并可減少雜菌生長的機會[33]。由圖7 可知,隨著接種量的增大,生物量和油脂產量逐漸提高;當接種量為15%時,菌體的生物量和油脂產量均達到最大值,分別為13.2 g/L 和2.77 g/L;但當接種量超過15%時,會因菌體生長過快,菌體間競爭性作用增強且代謝廢物積累過多而影響產物的合成。綜合菌株油脂總產量作為衡量指標,則最適接種量為15%。
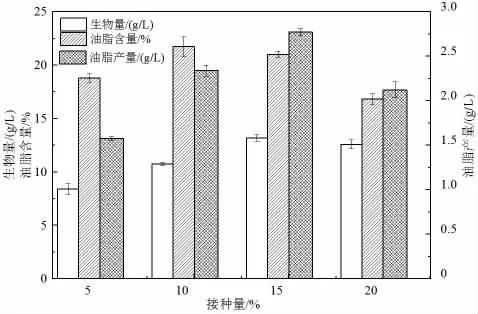
圖7 接種量對卷枝毛霉發酵產油的影響Fig.7 The influence of the inoculum amount on the fermentation of M. circinelloides to produce lipid
2.2.5 葡萄糖添加量對卷枝毛霉發酵產油的影響
碳源是培養基中最重要的組成部分,對發酵產物的形成極為關鍵[34]。玉米秸稈稀酸水解液中的碳源含量不足,致使菌體不能有效積累脂質,適當補充外源碳源可提高菌株的油脂積累。由圖8 可知,在補加葡萄糖濃度為4%時,菌體的生物量、油脂含量和油脂產量均達到最大值,分別為13.4 g/L、32.52%和4.36 g/L。當葡萄糖濃度繼續增大,其生物量、油脂含量及油脂產量均有所降低,可見高濃度的葡萄糖在一定程度上抑制了菌株的生長和脂質積累,這與前期研究結果一致[35]。因此,本研究選擇的最佳葡萄糖添加量為4%。
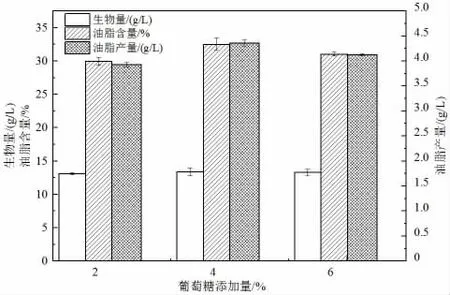
圖8 葡萄糖添加量對卷枝毛霉發酵產油的影響Fig.8 The effect of the amount of glucose added on the fermentation of M. circinelloides to produce lipid
2.2.6 氮源對卷枝毛霉發酵產油的影響
產脂真菌通常在碳源充足、其他營養成分(通常為氮源)缺乏時積累脂質,因而培養基中氮源的種類對于菌體生長和產脂特性很重要[25]。由圖9 可知,當酵母提取物作為氮源時,菌體的生物量、油脂含量及油脂產量分別為13.4 g/L、32.52%、4.35768 g/L,因此本研究選擇的最適氮源為酵母提取物。
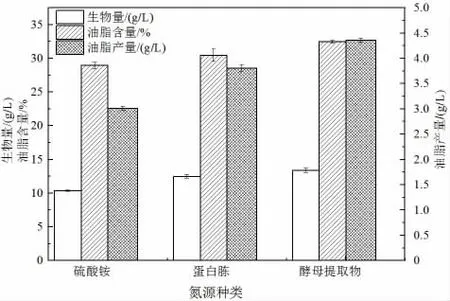
圖9 氮源種類對卷枝毛霉發酵產油的影響Fig.9 The effect of nitrogen sources on the fermentation of M. circinelloides to produce lipid
2.2.7 不同酵母提取物濃度對卷枝毛霉發酵產油的影響
考察不同酵母提取物濃度對卷枝毛霉發酵產油的影響,結果如圖10 所示。菌體生物量隨酵母提取物濃度的增加而逐漸增大;而油脂含量在酵母提取物濃度為2 g/L時達到最大值,隨后隨酵母提取物濃度的增大而逐漸降低,這是由于菌株在氮源受限的條件下將過量的碳源轉化為脂質,氮源過多則導致脂質合成減少。綜合菌株油脂總產量作為衡量指標,最適酵母提取物濃度為2 g/L。
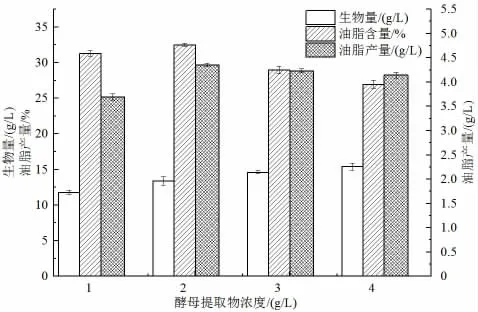
圖10 酵母提取物濃度對卷枝毛霉發酵產油的影響Fig.10 The effect of yeast extract concentration on the fermentation of M. circinelloides to produce lipid
2.3 油脂脂肪酸組分分析
經過上述條件優化后,卷枝毛霉在以Ca(OH)2脫毒處理后的玉米秸稈水解液和4%葡萄糖為基本碳源、2 g/L 酵母提取物為氮源、初始pH 5.0、接種量15%、于28℃、130 r/min 振蕩發酵60 h 最終得到的生物量、油脂含量和油脂產量分別是13.4 g/L、32.52%和4.36 g/L。卷枝毛霉在最優條件下發酵玉米秸稈水解液所產油脂的脂肪酸組成分析結果見表1。氣相色譜分析結果表明,不同發酵時間下卷枝毛霉WJ11 菌株所產的油脂脂肪酸組成主要為棕櫚酸、油酸和硬脂酸,與植物油脂非常接近,這與前期結果一致[25]。其中,棕櫚酸(C16:0)、十八烯酸(C18:1、C18:2、C18:3)等不飽和脂肪酸占總脂肪酸含量的70%以上,可以作為生產生物柴油的良好原料[30]。
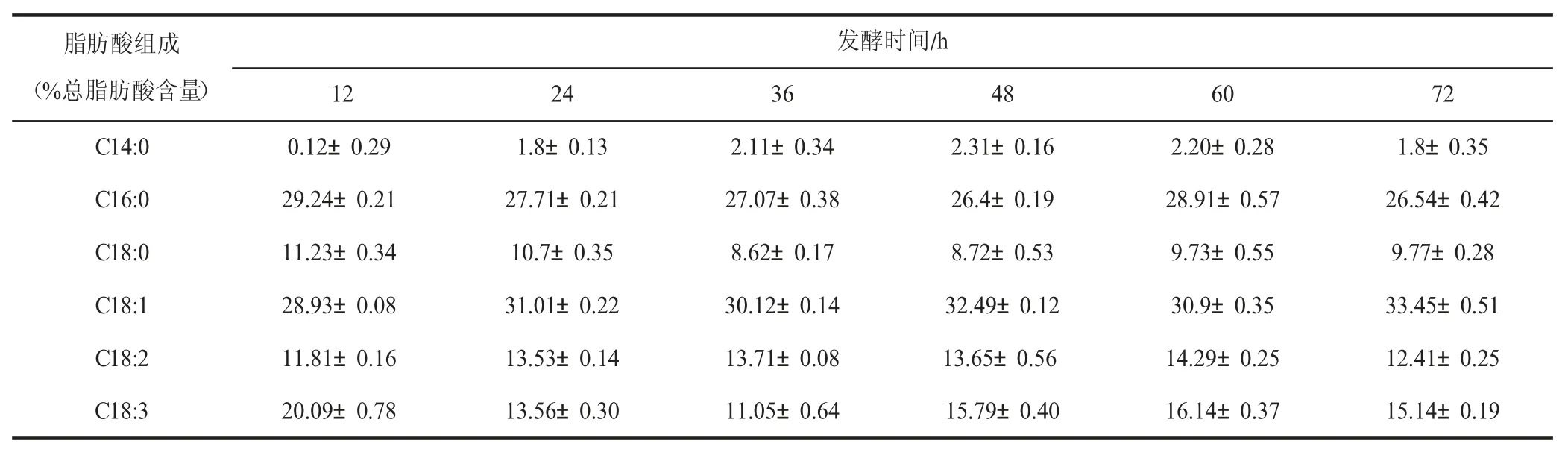
表1 卷枝毛霉發酵所產油脂的脂肪酸組成Table 1 Fatty acid composition of the lipid produced by M. circinelloides fermentation
3 結語
本文研究了卷枝毛霉WJ11 利用玉米秸稈水解液發酵生產微生物油脂的特性。試驗結果表明,玉米秸稈的最佳水解條件為稀硫酸體積分數2%、固液比1∶10(w/v)、121 ℃、高壓下水解20 min。當以Ca(OH)2脫毒處理后的玉米秸稈水解液為主要原料,葡萄糖添加量為4%,酵母提取物2 g/L,接種量15%,pH 5.0,于28 ℃、130 r/min 培養60 h 時卷枝毛霉發酵產油脂效果最好,獲得的生物量、油脂含量和油脂產量分別是13.4 g/L、32.52%和4.36 g/L。經氣相色譜分析表明,所產油脂的脂肪酸組成與植物油脂相似,不飽和脂肪酸占總脂肪酸含量的70%以上,可作為生物柴油的良好原料。

