降調節激素替代周期對既往子宮內膜異常患者FET臨床結局的影響
李儀,高紅,顏曉紅,張志明,李友筑,3*
(1.廈門大學附屬第一醫院生殖醫學科,廈門 361000;2.廈門大學附屬第一醫院乳腺外科,廈門 361000;3.廈門市輔助生殖技術質控中心,廈門 361013)
近年來成熟穩定的胚胎冷凍技術使凍融胚胎移植(FET)成為體外受精治療的常規策略。在預防卵巢過度刺激綜合征、胚胎植入前基因診斷或篩查、子宮內膜病變等方面,FET發揮重要作用[1-2]。FET中妊娠的發生取決于胚胎質量、子宮內膜的容受性以及胚胎與子宮內膜的良好對話,其中子宮內膜容受性尤為重要[3]。因此,子宮內膜的準備方案更需慎重選擇。臨床中FET周期內膜準備方案呈多樣化:(1)自然周期(NC)方案適用于平素月經周期規律正常排卵的女性,因其用藥簡單方便、更經濟而獨具優勢;(2)人工周期(AC)方案適應證廣泛,相比自然周期,激素替代療法(HRT)更靈活可控。降調節激素替代周期通常在月經期(月經第2~3天)或黃體中期(排卵后6~7 d)注射促性腺激素釋放激素激動劑(GnRH-a) 1.875~3.75 mg,約28~30 d后啟用HRT,應用此方案使垂體激素下調、避免自發的卵泡排卵和取消周期的發生。從目前研究來看,FET周期中GnRH-a對臨床結局的影響仍然存在爭議。有研究表明,HRT前是否進行GnRH-a預處理的妊娠結局沒有區別[4-6];也有研究表明,GnRH-a預處理可顯著提高妊娠率[7-8]。
既往研究發現,將降調節FET方案應用于慢性子宮內膜炎、宮腔粘連、子宮內膜異位癥、子宮腺肌病、反復植入失敗、盆腔炎及多囊卵巢綜合征等患者中,均能改善妊娠結局[9],但缺乏子宮內膜異常病史患者的分析。對于既往有子宮內膜厚度不均或炎癥的患者,內膜接受胚胎的能力下降,導致胚胎植入率降低,因此FET方案的選擇尤為重要。育齡期女性卵巢儲備功能下降的比率逐年升高,導致獲取更多可用胚胎的人群逐漸減少,最優化的利用胚胎則需斟酌選擇更合適的移植方案。本研究回顧性分析降調節激素替代周期(GnRH-a+HRT) 方案在既往子宮內膜異常患者FET周期中應用的臨床療效,為日后臨床策略的制定提供一定的指導依據。
資料與方法
一、研究對象
回顧性分析2019年10月至2021年11月在廈門大學附屬第一醫院生殖中心行激素替代周期FET患者的臨床資料。
納入標準:(1)既往子宮內膜病變治療后,如子宮內膜息肉切除術后、子宮內膜不均勻搔刮術后、慢性子宮內膜炎(包括宮腔鏡下診斷內膜炎或病理提示內膜炎)治療后、輕微宮腔粘連分解術后等;(2)FET內膜準備方案為HRT或GnRH-a+HRT方案;(3)患者移植D3卵裂胚或D5/D6囊胚(移植胚胎個數≤2枚,其中移植至少1枚優質胚胎)。
排除標準:(1)女方年齡≥40歲;(2)既往惡性腫瘤病史、盆腔結核病史,合并嚴重子宮內膜異位癥、宮腔積液、輸卵管積液,薄型子宮內膜(轉化日內膜厚度<7 mm)、中重度宮腔粘連、子宮畸形及粘膜下子宮肌瘤等子宮內膜容受性降低的患者;(3)夫妻任一方染色體異常者;(4)反復著床失敗或復發性流產者。
本研究共納入393個周期,依據FET內膜準備方案的不同分為2組:GnRH-a+HRT組(n=332)和HRT組(n=61);再以既往是否有流產史(人工流產或藥物流產加清宮術)進行亞組分析,其中GnRH-a+HRT組又分為流產史組65個周期和無流產史組267個周期,HRT組分為流產史組20個周期和無流產史組41個周期。
二、研究方法
1.FET內膜準備方案:(1)GnRH-a+HRT方案:月經第2~4天或排卵后黃體中期經陰道超聲檢查后,注射醋酸亮丙瑞林(上海麗珠)1.875 mg/3.75 mg或醋酸曲普瑞林(達必佳,輝凌,德國) 1.875 mg/3.75 mg,給藥25~30 d后復查生殖激素及超聲檢查,血清生殖激素達到垂體降調節水平(FSH<5 U/L,LH<5 U/L,E2<170 pmol/L),經陰道超聲提示子宮內膜厚度<5 mm、雙側卵巢見多個直徑約5~6 mm大小的卵泡時,開始服用雌二醇/雌二醇地屈孕酮片(芬嗎通,拜耳,法國)紅色片4 mg/d,持續用藥一周后復查子宮內膜厚度及形態,酌情加用戊酸雌二醇(補佳樂,拜耳,法國)3~6 mg/d,雌激素使用第12~14天復查超聲及血清E2、孕酮(P)水平,當E2>600 pmol/L、P<3.5 nmol/L、內膜厚度達到8 mm以上時確定轉化時間,E2水平低或內膜薄時繼續調整雌二醇用量,逐漸增量或酌情改用芬嗎通紅色片1 mg/d置陰道,雌激素給藥時間至少維持12 d。(2) HRT方案:月經第2~3天開始服用雌激素,無降調節過程,雌激素用藥的調整及移植后黃體支持方法同GnRH-a+HRT方案。
2.胚胎移植:IVF/ICSI以及胚胎冷凍和復蘇等操作均按本中心常規進行[10]。移植當日無宮腔積液且子宮內膜厚度達到8 mm以上時,選擇1~2枚復蘇后的可用胚胎進行移植,至少包括1枚優質胚胎(優質卵裂胚:受精第3天卵裂球數目>6細胞,雙原核受精,碎片指數<20%;優質囊胚指按 Gardner評分標準復蘇后評分>3BB的囊胚)。
3.黃體支持:兩組黃體支持的用藥相同,即轉化日改芬嗎通紅色片為黃色片即雌二醇地屈孕酮片1片/次,bid,同時加用地屈孕酮(達芙通,雅培,美國)10 mg/次,bid,口服。移植后加用陰道用黃體酮凝膠(雪諾同,默克,英國)90 mg/d,戊酸雌二醇維持原劑量,并繼續黃體支持至移植后11~13 d測血清人絨毛膜促性腺激素(HCG),其水平升高者繼續用藥至移植后25~28 d行陰道B超檢查。
4.子宮內膜分型:A型:子宮內膜呈三線征,即子宮內膜外層和宮腔中線將子宮內膜分為三部分,內膜外層和宮腔中線之間為低回聲區;B型:內膜呈均一的等回聲,宮腔線清晰,呈一致的強回聲;C型:宮腔線不可見,內膜呈均質強回聲;A~B型及B~C型:指內膜形態介于兩型之間。
5.臨床妊娠判斷:D3卵裂胚移植后12~14 d、D5囊胚移植后10~12 d檢測血清HCG,若HCG陽性(>25 U/L)繼續黃體支持,定期復查HCG水平;移植后25~28 d陰道B超提示宮內或宮外可見孕囊回聲,則判定為臨床妊娠;HCG值增長不明顯或逐漸降低至正常水平,且移植后25~28 d陰道超聲未見孕囊,則判定為生化妊娠。流產是指小于28周妊娠丟失,活產指分娩≥28周的活產胎兒。
6.觀察指標:比較不同內膜方案組的基本資料、轉化日子宮內膜形態、轉化日內膜厚度、轉化日血清生殖激素水平(E2及P)、移植胚胎個數、移植胚胎級別及兩組的胚胎種植率、生化妊娠率、臨床妊娠率、流產率和活產率。胚胎種植率=B超下的孕囊數/移植胚胎總數×100%;生化妊娠=指生化妊娠周期數/移植周期數×100%;臨床妊娠率=臨床妊娠周期數/移植周期數×100%;流產率=流產周期數/臨床妊娠周期數×100%;活產率=活產周期數/移植周期數×100%。
三、統計學分析

結 果
一、兩組患者的基本資料
本研究共納入393個周期,其中GnRH-a+HRT組332個周期,HRT組61個周期。
兩組不同內膜準備方案患者間的平均年齡、不孕年限、體質量指數(BMI)以及不孕類型等基本資料的差異均無統計學意義(P>0.05)(表1)。
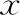
表1 兩組患者的基本資料[(-±s),n(%)]
二、兩組患者的移植狀況
統計結果顯示,兩組患者的轉化日內膜厚度、轉化日內膜形態比例、轉化日血清E2及P水平比較均無顯著性差異(P>0.05),兩組患者間的平均移植胚胎數以及移植不同時期胚胎(D3卵裂胚/D5囊胚)的比例亦均無顯著性差異(P>0.05)(表2)。
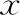
表2 兩組患者的移植情況比較[(-±s),n(%)]
三、兩組患者妊娠結局比較
統計結果顯示,GnRH-a+HRT組的胚胎種植率及臨床妊娠率均顯著高于HRT組(P<0.05),GnRH-a+HRT組的活產率高于HRT組、生化妊娠率和流產率低于HRT組,但差異均無統計學意義(P>0.05)(表3)。

表3 兩組患者妊娠結局比較(%)
四、有無流產史患者間的妊娠結局比較
以既往是否有流產史進行亞組分析,GnRH-a+HRT組中有流產史65個周期、無流產史267個周期;HRT組中有流產史20個周期、無流產史41個周期。在GnRH-a+HRT組中,與有流產史患者比較,無流產史組的胚胎種植率顯著降低、臨床妊娠率顯著升高(P<0.05);活產率和流產率雖然分別升高和降低,但差異尚無統計學意義(P>0.05)(表4)。
在HRT組中,無流產史組的胚胎種植率、臨床妊娠率、流產率均低于流產史組,活產率高于流產史組,但差異均無統計學意義(P>0.05)(表5)。

表4 GnRH-a+HRT組中各亞組妊娠結局比較(%)

表5 HRT組中各亞組妊娠結局比較(%)
討 論
影響FET成功的主要因素是胚胎發育潛力及子宮內膜接受胚胎的能力[11]。胚胎植入過程極其復雜,目前研究尚未完全闡明,主要包括胚胎的定位、黏附、植入及胎盤形成,其機制涉及炎性因子、免疫反應、能量代謝等。長效GnRH-a最初應用于子宮內膜異位癥或子宮腺肌病患者的體外受精周期中,包括長方案的促排卵周期或降調節的FET周期[12]。目前GnRH-a在FET內膜準備中應用廣泛,其適用人群亦不斷增加,如多囊卵巢綜合征、薄型子宮內膜、反復種植失敗、盆腔炎等,但療效仍存爭議。既往研究發現,GnRH-a+HRT方案應用于子宮內膜異位癥患者,亦或非子宮內膜異位癥人群的妊娠結局均優于其他內膜準備方案[13-14]。但對于反復種植失敗或合并子宮腺肌病的患者,GnRH-a+HRT方案在臨床妊娠率和胚胎種植率方面無明顯優勢[15-17]。以上研究結論的不一致不排除入組人群、疾病的嚴重程度、子宮內膜形態、胚胎質量以及降調節啟動時間差異[18]的影響。同樣在月經周期規律的患者中,相比HRT方案,也未發現GnRH-a+HRT方案對妊娠結局的額外益處[4]。因此需考慮降調節作用于內膜的可能機制,并將其應用于相應的人群。
多數研究一致認為,子宮內膜較薄(<7 mm)導致較低的持續妊娠率和活產率[19-20];移植D5或D6囊胚,與D3卵裂期胚胎相比,能得到更高的持續或累積妊娠率[21]。本研究對子宮內膜既往病變患者FET周期進行回顧性分析,比較GnRH-a+HRT組與HRT組的妊娠結局,兩組患者的一般情況比較無顯著性差異,同時轉化日內膜厚度及分型、轉化日E2及P水平、移植胚胎情況比較均無顯著性差異。在妊娠結局比較中,與HRT組相比,GnRH-a+HRT組的胚胎種植率及臨床妊娠率均顯著升高(P<0.05)。回顧既往研究結論,GnRH-a可能通過以下機制來改善FET的妊娠率:(1)抑制下丘腦-垂體-卵巢軸(HPO軸)使垂體達到降調節狀態,降低類固醇激素水平,防止異位子宮內膜的增生[22];(2)增加內膜中胞飲突、整合素αvβ3及同源框基因10(HOXA-10)的表達,加強子宮內膜與胚胎之間的有效對話,提高內膜容受性[23];(3)改善母體內環境,抑制免疫反應,減少促炎因子及自然殺傷細胞的作用,促進母胎免疫耐受[24]。因此,對于既往有子宮內膜息肉切除、子宮內膜炎等患者,推薦FET周期,采用降調節激素替代方案,改善盆腔環境,抑制內膜炎性因子的表達,提高胚胎植入率,從而獲得更好的妊娠結局。本研究中,雖然GnRH-a+HRT組的活產率高于HRT組(44.28% vs. 27.87%),生化妊娠率(8.13% vs. 13.11%)、流產率(14.53% vs. 22.73%)均低于HRT組,但差異尚無統計學意義(P>0.05);考慮其原因可能在于本研究納入病例時間為2019年至2021年,期間因新冠疫情,部分患者無法前往我院復診開藥,FET周期均為激素替代方案,患者自身無黃體生成,導致停藥后流產率的增加,進而對兩組患者流產率及活產率結果產生影響。
人流或清宮術可能損傷子宮內膜基底層,造成宮腔粘連、內膜厚度不均或內膜反復炎癥,將既往有無流產史做為依據進行亞組分析,發現GnRH-a+HRT組的無流產史患者的臨床妊娠率(52.43% vs. 49.23%)顯著高于有流產史的患者(P<0.05);HRT組中有無流產史患者間的妊娠結局指標均無顯著性差異(P>0.05)。其原因可能有以下兩點:(1)無流產史患者無內膜損失的病史,往往內膜容受性更好,而損傷后內膜的修復較困難,因此GnRH-a+HRT方案對流產術后妊娠率的提高不顯著,GnRH-a對損傷后子宮內膜的影響機制及療效尚需進一步的研究探討;(2)本中心HRT組病例較少,分析結論可能存在偏差。
本中心以往數據提示,FET周期GnRH-a+HRT方案的妊娠率最高,大部分情況醫生會選擇用此方案解凍移植,因此HRT方案病例較少,造成兩組樣本量懸殊較大;由于病例數的局限,本文也尚未對內膜異常的具體類型進行統計分析,這是本研究的局限之處,后續將進行前瞻性研究來探討不同異常類型內膜的妊娠結局。
綜上所述,GnRH-a+HRT周期能改善既往子宮內膜異常患者的FET妊娠結局,提高胚胎種植率、臨床妊娠率,因此制定FET方案前應重視患者既往內膜的病史以及宮腔操作史。但本研究為回顧性病例分析,研究結論存在一定程度的局限,后續仍需大樣本、多中心的前瞻性對照研究來進一步證實。

