腦膠質瘤MRI平掃及強化特征分析
曲 龍,黃景新
(廣州市第一人民醫院南沙醫院 放射科,廣東 511457)
腦膠質瘤屬于顱內原發性腫瘤,在臨床中較為常見,具有易反復發作、邊界模糊等特征。由于大部分腦膠質瘤是多發,極易累及周邊組織、器官等,引起腦組織缺氧、水腫等[1-2]。目前,臨床對于腦膠質瘤主要采取手術、放化療等方式治療,不同級別的患者預后不同,高級別腦膠質瘤病灶生長速度較快,浸潤性和侵襲性較強,預后普遍較差[3]。腦膠質瘤屬于生長相對緩慢的腫瘤疾病,患者均會伴隨不同程度的顱內壓增高,因膠質瘤的生物學行為不同,相對于其他緩慢生長的良性腫瘤,該腫瘤可切除治療,但是臨床預后一般。有研究表明,在治療前及早對腦膠質瘤患者分級作出準確診斷,可指導臨床更有針對性地展開治療工作,對于降低死亡率具有一定的積極意義[4]。MRI(核磁共振)具有較高的分辨率,可以多序列、多參數、多方位成像,獲得清晰的神經血管圖像,明確腦膠質瘤的病灶位置、邊界、水腫程度等[5]。基于此,為探究腦膠質瘤診斷中MRI平掃及強化特征,本文對本院2018年9月至2021年6月收治的68例腦膠質瘤患者展開研究,報道如下。
1 資料與方法
1.1 一般資料
本次研究對象來源于本院2018年9月至2021年6月收治的68例腦膠質瘤患者 (醫院倫理委員會已審批),男性30例、女性38例;年齡在27-72歲,平均(49.62±5.14)歲;病程在 4-20 個月,平均(12.62±2.84)個月;病灶直徑在1.2-2.3cm,平均(1.82±0.64)cm;BMI(體質量指數)23-32kg/m2,平均(27.62±1.54)kg/m2。 納入標準:①均經病理活檢穿刺診斷為“腦膠質瘤”。②年齡>18周歲,男、女不限。③未接受過手術、放化療等對癥治療。④溝通、視聽能力均正常。⑤家屬均已在知情同意書上簽字。排除標準:①置入心臟起搏器、支架者。②哺乳期、妊娠期女性。③對本研究所用造影劑過敏者。④腎、肝功能衰竭者。⑤合并腦梗死等其他腦部疾病者。⑥存在既往腦部創傷史者。⑦合并心血管疾病者。⑧同期參與其他研究者。⑨合并狂躁癥、焦慮癥等疾病者。
1.2 方法
MRI檢查方法:采用3.0T超導MRI檢查儀(型號:西門子 VERIO 3.0T、西門子SKYRA 3.0T)檢查。協助患者采取仰臥位,放置頭部線圈 (型號:NV-16),從頭頂部掃描直至顱頂部,橫斷位FSE-T1WI、FSE-T2WI、FSE-T2WI Flair軸位掃描、矢狀位FSE-T2WI掃描,FSE-T2WI Flair,T1+增強, 彌散,MRA,MRS。 T1W:TE 是 8ms,TR 是 500ms,層間隔1mm,層厚 5mm,矩陣是 256×256,T2W、T2FLAIR:TE 是 95ms,TR 是 4500ms, 層厚 5.5mm;T1+C:TE是 2.59ms,TR 是 1700ms,層厚 1mm;DWI(擴散加權成像)掃描以多次激發SE-EPI為主,TE是93ms,TR是 6000ms,b值 (擴散敏感因子) 是 0、1000mm2。將所獲得的圖像傳輸至后臺工作站,自動分析原始數據。
所有患者圖像均由一名主治醫生、一名高年資住院醫師以雙盲法閱片并作出診斷,對于存在異議的地方,再次討論或者邀請主任醫師參與討論,確定最終診斷結果。
1.3 觀察指標
對比低級別組、高級別組病灶周邊水腫程度、ADC值 (表觀彌散系數)、NAA/Cr(氫質子波譜)、Cho/Cr(膽堿/肌酸)、Cho/NAA(膽堿/N-乙酰天門冬氨酸),以上測量數據最終記錄值是連續測量3次的平均值。
1.4 統計學方法
以SPSS26.0軟件檢驗,正態分布計量資料(ADC 值、NAA/Cr、Cho/Cr、Cho/NAA)同組組內數據計算以配對樣本t檢驗為主,不同組間數據計算以獨立樣本t檢驗為主,通過“±s”表示,計數資料(水腫程度)采用卡方檢驗及秩和檢驗,單元格期望頻數<5,連續校正檢驗,以“[n/(%)]”表示,P<0.05 表示存在統計學差異。
2 結果
2.1 腦膠質瘤分級
68例患者經MRI檢查:12例I級,占17.65%(12/68);18 例 II級,占 26.47%(18/68);21 例 III級,占 30.88%(21/68);17 例 IV 級,占 25.00%(17/68)。
2.2 低級別組、高級別組病灶周邊水腫程度對比
低級別組無水腫率 (53.33%)、輕度水腫率(40.00%)高于高級別組(2.63%、34.21%),低級別組中度水腫率(6.67%)、重度水腫率(0)均低于高級別組(31.58%、31.58%),P<0.05,見表 1。
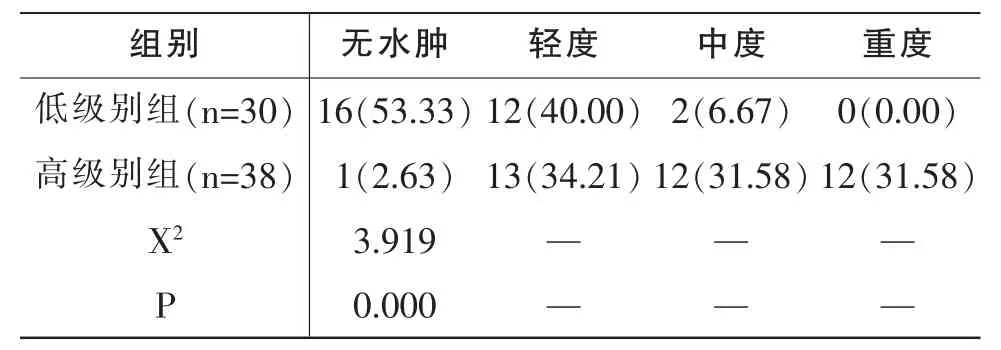
表1 低級別組、高級別組病灶周邊水腫程度對比[n/(%)]
2.3 低級別組、高級別組ADC值對比
低級別組ADC值高于高級別組,P<0.05,見表2。
表2 低級別組、高級別組ADC值對比(±s)
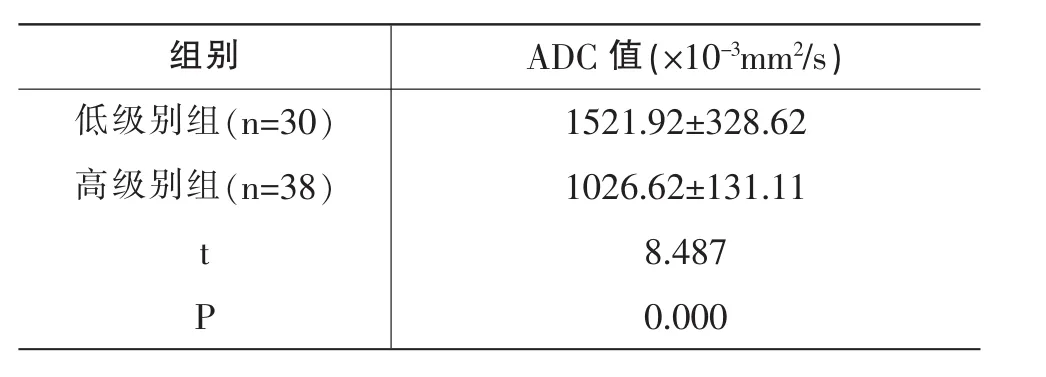
表2 低級別組、高級別組ADC值對比(±s)
組別 ADC 值(×10-3mm2/s)低級別組(n=30) 1521.92±328.62高級別組(n=38) 1026.62±131.11 t 8.487 P 0.000
2.4 低級別組、高級別組NAA/Cr、Cho/Cr、Cho/NAA對比
低級別組Cho/Cr、Cho/NAA均低于高級別組,低級別組NAA/Cr高于高級別組,P<0.05,見表3。
表3 低級別組、高級別組NAA/Cr、Cho/Cr、Cho/NAA對比(±s)
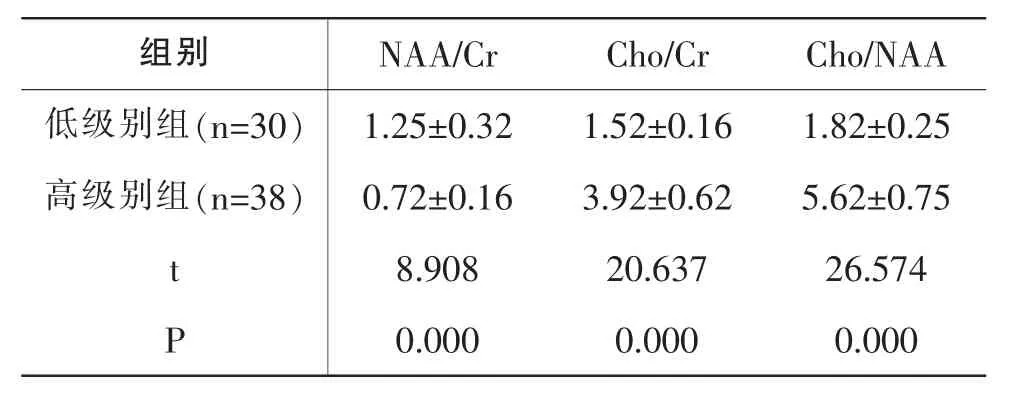
表3 低級別組、高級別組NAA/Cr、Cho/Cr、Cho/NAA對比(±s)
組別 N A A/C r C h o/C r C h o/N A A低級別組(n=3 0) 1.2 5±0.3 2 1.5 2±0.1 6 1.8 2±0.2 5高級別組(n=3 8) 0.7 2±0.1 6 3.9 2±0.6 2 5.6 2±0.7 5 t 8.9 0 8 2 0.6 3 7 2 6.5 7 4 P 0.0 0 0 0.0 0 0 0.0 0 0
2.5 平掃及強化掃描特征
68例患者經MRI檢查,15例膠質母細胞瘤,占22.06%(15/68)。膠質母細胞瘤多見于兒童,將近50%以上的患者病灶直徑大于7.5cm,瘤體內部存在明顯出血、鈣化、囊變、壞死等,鈣化現象極為常見,在整個瘤體中均存在。MRI掃描,T2WI是高信號,T1WI是低信號,周圍水腫明顯,增強掃描后可見花環狀特征。17例少突膠質細胞瘤,占25.00%(17/68)。MRI掃描后,T2WI是高信號,T1WI是低信號,可見明顯囊變、鈣化灶,瘤體周圍存在輕中度水腫,增強掃描后可見斑點狀強化或者線條狀強化。13例混合性膠質瘤,占19.12%(13/68)。MRI掃描后,T2WI是高信號,T1WI是等低信號,增強掃描后病灶無明顯強化。病灶周邊水腫明顯,增強處理后,實性成分強化明顯,病變部位的囊性成分較多,囊壁光滑度良好。9例室管膜瘤,占13.24%(9/68)。MRI掃描后,T2WI是高信號,T1WI是低信號,增強掃描后強化不明顯。瘤體無明顯水腫,增強掃描后可見不規則環狀強化。囊壁光滑、薄,可見明顯環狀強化。4例脈絡叢乳頭狀瘤,占5.88%(4/68)。脈絡叢乳頭狀瘤多見于成年人,需要與腦膜瘤相鑒別,腦膜瘤與脈絡叢乳頭狀瘤最大的區別在于腦膜瘤的邊緣光滑。脈絡叢乳頭狀瘤MRI掃描可見T2WI以及T1WI是分葉狀等信號,腦室系統擴大明顯,增強掃描處理后,可見均勻性增強。
3 討論
現如今,臨床針對腦膠質瘤患者的治療手段主要涉及手術、放療化療以及中藥等。盡管治療方式多樣化,發病率與死亡率均較高,說明積極改善腦膠質瘤患者的臨床預后與延長其生存時間是目前重點關注的問題。腦膠質瘤是由于脊髓、大腦中膠質細胞癌變所致,是先天家族遺傳以及后天接觸外界致癌因素所致[6]。腦膠質瘤多發生于40歲以上的中老年人群,流行病學調查顯示,在全身腫瘤中腦膠質瘤占到了5%[7]。腦膠質瘤根據WHO(世界衛生組織)惡性程度分為四種等級,其中I-II級是低級別腫瘤,III-IV級是高級別腫瘤[8]。低級別的腦膠質瘤惡性程度相對較低,病灶侵襲、浸潤程度較輕,經過對癥治療,患者生存率較高[9]。但高級別的腦膠質瘤惡性程度較高,疾病進展速度較快,尤其是IV級腦膠質瘤患者,即便是經過手術結合放化療等對癥治療,生存期也不足16個月[10]。腦膠質瘤的臨床癥狀與病灶影響的腦部功能以及腫瘤的占位效應有關,大部分腦膠質瘤患者均存在不同程度視物模糊、癲癇、頭痛等癥狀。當病灶組織逐漸增大時,周圍神經組織會受到侵犯,患者會出現言語功能失調、四肢無力、自理能力減退等,給社會、家庭帶來了沉重負擔。隨著腦膠質瘤患者惡性程度的加重,治療方式及患者預后均會受到影響。
臨床在手術治療前,應對腦膠質瘤患者病情作出準確診斷。常規X線、CT等影像學技術難以對腦膠質瘤患者病情作出定性、定位診斷,診斷難度較大,準確率較低,漏診率、誤診率均較高,存在一定的局限性。MRI與X線、CT等影像學技術比較,分辨率較高,不需要重建即可獲得多序列成像、三維斷面成像,在多種腫瘤中具有較高的診斷價值。但MRI也存在一定不足,例如價格昂貴,部分患者、家庭難以接受,這也是MRI并未在基層醫院推廣開來的原因之一。
本研究顯示,68例患者經MRI檢查,15例為膠質母細胞瘤,占22.06%。17例為少突膠質細胞瘤,占25.00%。13例為混合性膠質瘤,占19.12%。9例為室管膜瘤,占13.24%。4例為脈絡叢乳頭狀瘤,占5.88%。低級別組無水腫率(53.33%)、輕度水腫率(40.00%)高于高級別組(2.63%、34.21%),低級別組中度水腫率 (6.67%)、重度水腫率 (0)均低于高級別組(31.58%、31.58%),P<0.05。 表明低級別的腦膠質瘤患者病灶周邊組織水腫較輕,以無水腫或者輕度水腫居多,而高級別的腦膠質瘤患者水腫程度較重,以中度水腫和重度水腫居多。另外,低級別組ADC值高于高級別組,P<0.05。表明低級別的腦膠質瘤ADC值相對較高。分析如下:MRI診斷中ADC值的大小主要反映細胞外間隙的大小。低級別腦膠質瘤由于病灶惡性程度較低,細胞外有較多的自由活動水分子,擴散速度較快,ADC值較高[12]。高級別腦膠質瘤由于大量的癌細胞堆積、浸潤,導致細胞外水分子活動空間縮小,水分子活動受限,從而導致ADC值偏低。大量研究證實,惡性腫瘤細胞中ADC值均比良性腫瘤的低[13]。低級別腦膠質瘤血管內皮增殖不明顯、沒有有絲分裂,但病灶內部細胞之間的構成,卻不像白質纖維髓鞘那樣有高度的方向性。 在朱季子等(2019)[14]研究中,低級別組 ADC 值(1.23±0.26)×10-3mm2/s高于高級別組 (0.86±0.14)×10-3mm2/s,P<0.05,與本研究結果接近,證實了高級別腦膠質瘤患者通過MRI檢查,ADC值更低,臨床可將ADC值降低作為腦膠質瘤患者病情惡化、加重的標志。研究還顯示,低級別組Cho/Cr、Cho/NAA均低于高級別組,低級別組NAA/Cr高于高級別組,P<0.05。出現差異的原因,可能是高級別的腦膠質瘤患者病灶組織侵襲、浸潤能力更強,導致細胞膜轉換速率更高。 在張格等(2020)[15]研究中,低級別組Cho/NAA(1.8±0.4)均低于高級別組(5.4±2.1),而低級別組 NAA/Cr(1.2±0.2)高于高級別組(0.7±0.3),P<0.05,與本研究結果接近,證實了本次研究結果的可靠性、準確性、代表性。
腦膠質瘤患者的星形細胞瘤、膠質母細胞瘤以及少枝膠質細胞瘤圖像中,三種不同瘤體T1WI序列中圖像呈現等信號或者低信號,且T2WI序列顯示高信號,鑒于膠質瘤病理特征存在不一致性,因此對該項疾病進行鑒別診斷需要借助 MRI進行增強掃描[16-17]。星形細胞瘤強化方式主要分為三類,即為不均勻斑點、片狀輕中度以及斑片狀顯著強化等。臨床研究顯示,腦膠質瘤強化程度和信號均勻程度與患者的病理分級存在密切聯系。例如,腫瘤病理分化高的膠質瘤瘤體細胞繁殖速度相比其他細胞比較快,易出現壞死以及囊性異常等現象。本研究中發現的少突膠質瘤患者瘤體顯示出現明顯的囊性改變、鈣化灶等情況,和少突膠質瘤膨脹性生長存在密切的相關性,因此使其鈣化發生率較大[18]。鈣化表現T1WI、T2WI圖像中均顯示是低信號,其次,在增強序列中偏良性瘤體明顯增強,未見顯著的強化現象,與此同時依據上述進行增強強化,若患者的腫瘤四周發生明顯的水腫,T1WI呈現低信號,T2WI呈現高信號,方便鑒別水腫與瘤體。另外,膠質母細胞瘤作為星形細胞瘤中最為常見的惡性類型,瘤體的生長速度非常快,1年內的生存率<15%,惡性腫瘤行增強掃描中的圖像呈現多種多樣化,存在均勻一致性增強,呈現不均勻或者其他強化表現,加上膠質母細胞瘤MRI強化特征多呈現“花環狀”強化,胼胝體常常受累,中線存在明顯的結構偏移[19]。但需要注意的是,50%~80%的星形細胞瘤與少突膠質細胞瘤均會伴隨不同程度的基因突變,但原發性膠質母細胞瘤出現突變的幾率較小,需依據不同階段腦膠質瘤MRI影像學特點區分強化情況,進而對不同腦膠質瘤進行有效鑒別與診斷[20]。
本研究存在一定不足,例如樣本病例數較少、病例均來源于同一家醫院,研究時限較短,對結果的代表性、一般性、有效性有所影響,因此仍需擴大樣本例數、增加不同醫院腦膠質瘤病例、延長研究時限,為評估MRI在腦膠質瘤診斷護理中的應用價值提供更多參考依據。
綜上所述,MRI可以對腦膠質瘤患者病情作出準確診斷,明確分級程度,提供腦血流、ADC值等多種影像學參數,為臨床醫生制定治療方案提供科學的參考依據。

