糖誘導型啟動子調控ALD6基因表達降低黃酒中的高級醇生成量
康新玥,魏敏,江森,王歡,郭學武,2,肖冬光,2,武曉樂,2,陳葉福,2*
1(天津科技大學 生物工程學院,天津,300457)2(工業發酵微生物教育部重點實驗室(天津科技大學),天津,300457)
GB/T 13662—2018《黃酒》中定義黃酒是以稻米、黍米、小米、玉米、小麥、水等為主要原料,經加曲和/或部分酶制劑、酵母等糖化發酵劑釀制而成的發酵酒。黃酒酒度較低,酒體醇香,富含蛋白質、氨基酸等多種有益人體健康的物質,深受消費者喜愛[1]。近年來,隨著消費水平的提高,消費者不僅關注風味口感,還越來越關注健康,而黃酒中的高級醇含量在發酵酒中較高,是限制黃酒行業發展的制約性因素之一[2]。黃酒中的高級醇主要包括異戊醇、異丁醇、正丙醇、苯乙醇等。適量的高級醇賦予黃酒以醇厚感,但是高級醇含量過高不僅影響其風味口感,而且會對人體產生不適感甚至毒害作用,使飲用者飲后易醉、易暈眩且不利人體健康,其含量過低也會導致黃酒風味寡淡,酒體不豐盈[3-6]。因此,調控黃酒中的高級醇含量對于黃酒行業的發展意義重大。
目前研究表明,黃酒等發酵酒中的高級醇主要由釀酒酵母代謝產生,其生成途徑主要是氨基酸分解代謝途徑和糖代謝途徑。在釀酒酵母中降低脫羧酶(PDC酶系)、醇脫氫酶(ADH酶系)的活性同時提高醛脫氫酶(ADL酶系)的活性,可以達到降低高級醇生成量的目的。乙醛脫氫酶屬于釀酒酵母丙酮酸脫氫酶旁路(pyruvate dehydrogenase bypass,PDB)中的酶,氧化乙醛生成乙酸[7]。本實驗室前期研究表明過表達乙醛脫氫酶基因ALD6可降低52.8%的高級醇,但ALD6基因的過表達也提高了酵母的乙酸生成量(為出發菌株的3.6倍),這在一定程度上影響了酵母的生長和發酵性能,且乙酸含量過高會對酒體協調性產生不利影響[8]。
常用的啟動子主要有組成型和誘導型2種,組成型啟動子大多為強啟動子,某些基因不需要過強的表達量,否則會導致產物毒性或代謝負擔,對生長代謝有負面影響[9]。誘導型啟動子則是在特定培養條件下才有誘導基因表達的能力,可以通過調節誘導條件來掌控基因表達的水平,Phxts是受葡萄糖濃度誘導的HXT系列啟動子,對不同濃度葡萄糖的響應程度及親和力存在差異[10],可達到根據不同糖濃度動態調控ALD6基因表達的目的。黃酒發酵是雙邊發酵,發酵過程中的糖濃度是動態變化的,因此,本研究采用動態調控策略[11-12],選用6種HXT系列的糖誘導型啟動子(Phxt1、Phxt2、Phxt3、Phxt4、Phxt5、Phxt7)過表達ALD6基因構建重組菌株,在具有降低高級醇效果的同時,降低其對酵母生長和發酵產生的不利影響,為生產舒適健康的黃酒提供思路。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與質粒
本研究所用菌株與質粒見表1。
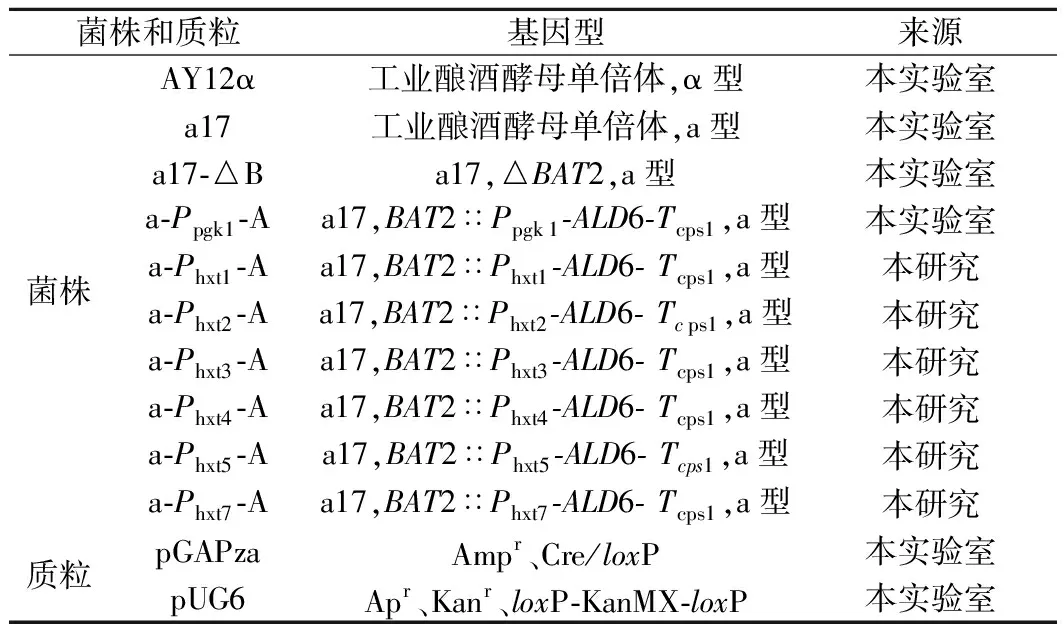
表1 菌株和質粒Table 1 Strains and plasmids
1.1.2 培養基
酵母浸出粉胨葡萄糖(yeast extract-peptone-dextrose,YEPD)培養基(g/L):酵母浸粉10、蛋白胨20、葡萄糖20,115 ℃,滅菌20 min。
LB培養基(g/L):酵母浸粉5、蛋白胨10、NaCl 10,121 ℃,滅菌20 min。
半乳糖誘導培養基(g/L):半乳糖10,蛋白胨20,酵母浸粉10,121 ℃,滅菌20 min。
一級種子培養基(g/L):將玉米糖化清液糖度調至8° Bx,酵母浸粉5。
二級種子培養基(g/L):將玉米糖化清液糖度調至12° Bx,酵母浸粉5。
1.2 儀器與設備
22331Harmburg型PCR擴增儀,德國Eppendorf公司;PowerPacTM型電泳儀,美國Bio-Rad公司;Bioscreen全自動凝膠成像儀,上海謂載商貿發展有限公司;7890A型氣相色譜、1100型高效液相色譜,安捷倫科技;StepOne實時熒光定量PCR,美國AB公司。
1.3 實驗方法
1.3.1 重組菌株的構建
根據美國國家生物信息中心(National Center of Biotechnology Information,NCBI)報道的釀酒酵母的基因序列使用Primer 5.0軟件設計PCR引物,用于構建重組菌株及驗證。通過查閱文獻及在NCBI上確定誘導型啟動子的序列用于構建不同啟動子過表達ALD6基因的重組菌株。引物序列見表2。

表2 PCR引物Table 2 PCR primers

續表2
本實驗在前期改造菌株a-Ppgk1-ALD6的基礎上更換誘導型啟動子,以誘導型啟動子Phxt3為例說明用啟動子Phxt3過表達ALD6基因構建重組菌株a-Phxt3-A的過程,實驗均以a-Ppgk1-ALD6(該菌株在BAT2位點過表達ALD6基因,其中啟動子為Ppgk1,終止子為Tcps1)基因組為模板,分別使用引物對B3-U/D、A3-U/D和P3-U/D進行PCR擴增,獲得上同源臂BA、ALD6-Tcps1-BB和啟動子Phxt3片段;以質粒PUG6為模板,使用引物K3-U/D進行PCR擴增,得到KanMX片段。通過醋酸鋰轉化法將BA,ALD6-Tcps1-BB,Phxt3,KanMX片段全部導入酵母細胞,酵母自身通過胞內DNA assembly實現多片段的組裝,并由同源臂介導的同源重組將目的基因表達整合到過表達位點[13],同源重組過程如圖1所示。
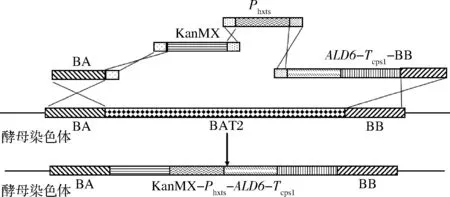
圖1 Phxts啟動子過表達ALD6釀酒酵母菌株同源重組過程Fig.1 Homologous recombination process of overexpression ALD6 with Phxts promoter in Saccharomyces cerevisiae
在含有300 μg/mL G418抗性的YEPD培養基上篩選重組菌株。以提取重組菌株的基因組DNA為模板,以菌株a-Ppgk1-ALD6基因組為陰性對照,用驗證引物YZ-BAT2-U/D、YC-U/YA-D、H3-U/D對轉化子進行驗證。其余菌株驗證引物前2對均與舉例引物相同,第3對引物為對應序號標記驗證引物。
通過醋酸鋰轉化法將pGAPza質粒導入重組菌株,挑取轉化子于半乳糖培養基中培養12 h,稀釋涂布于YEPD培養基。將長出的單菌落在YEPD培養基和含300 μg/mL G418抗性的YEPD培養基進行點板,挑出在G418抗性培養基上不生長而在YEPD培養基上生長的菌株,提取其基因組進行PCR驗證。若以該基因組為模板PCR擴增KanMX片段,不能得到1 600 bp左右的條帶,而以轉化前重組菌株的基因組為模板能擴增得到該基因片段,即說明菌株成功去除KanMX篩選標記。
1.3.2 過表達基因轉錄水平測定
將酵母接種于5 mL YEPD液體試管,180 r/min、30 ℃培養12 h,然后取500 μL轉接于5 mL YEPD液體試管,相同條件培養4 h后,采用由TaKaRa公司提供的試劑盒Yeast Processing Reagent (for total RNA preparation) Code No.9089,按操作說明書收集菌體、提取總RNA;然后進行RNA逆轉錄、去除DNA;最后采用儀器Applied Biosystems 7300/7500 Real Time PCR System,以UBC6基因為內參基因進行Real Time PCR實驗,測定待測菌株的mRNA水平。本實驗RNA的逆轉錄、去除DNA以及Real Time PCR實驗所用試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)由TaKaRa公司提供[14]。
1.3.3 生長曲線測定
首先用接種環在斜面刮取一環酵母菌株于5 mL YEPD液體培養基試管中,180 r/min,30 ℃,培養12 h。振蕩混勻菌液后,分別取10、20、30和40 μL菌液轉入含有1 mL液體YEPD的EP管中。然后取300 μL加入100孔深孔板,取300 μL YEPD液體培養基做空白對照,30 ℃培養24 h,之后每隔0.5 h測其在600 nm處的吸光度值。以培養時間為橫軸,OD600為縱軸,繪制菌株的生長曲線。
1.3.4 發酵實驗
發酵種子液培養:取酵母菌接種到裝有5 mL一級種子培養基的試管,30 ℃靜置24 h,然后將其全部接入含有45 mL二級種子培養基的150 mL三角瓶,30 ℃靜置20 h。
大米清液制備:
大米→蒸煮→液化→糖化→過濾滅菌→接菌發酵
操作要點:大米蒸煮后加3 000 mL蒸餾水、耐高溫α-淀粉酶500 μL、麥曲150 g,70 ℃水浴90 min。糖化酶500 μL,60 ℃水浴8 h,過濾得大米糖化清液。每瓶142 mL分裝至250 mL三角瓶。按種子培養的方法培養酵母種子液,然后接種7.5 mL菌液于上述瓶中密封發酵。
傳統黃酒發酵工藝流程[4]:
大米→蒸煮→攤晾→拌曲→接菌→補水發酵
操作要點:大米和水按質量比1∶1蒸煮0.5 h。攤晾冷卻1 h。大曲的用量為大米的15%(質量分數),拌勻裝入500 mL三角瓶。接菌700萬個/g,米和水按質量比1∶1補加水,混勻密封,30 ℃發酵7 d。
1.3.5 檢測方法
按照GB/T 13662—2018《黃酒》中斐林試劑法測定還原糖,酒精計比重法[15]測定酒精度,根據稱重確定CO2排放量。
采用高效液相色譜法測定發酵液中乙酸含量[7]:Aminex HPX-87H色譜柱,柱溫60 ℃,進樣量10 μL,流動相為5 mmol/L H2SO4,流速0.6 mL/min,檢測器為示差折光檢測器。
采用氣相色譜法測定餾出液高級醇的生成量[16]:氣相色譜儀Agilent 7890C,進樣口溫度200 ℃,檢測器溫度200 ℃。進樣量1 μL,分流比10∶1。載氣為高純度N2,流速2.0 mL/min。起始柱溫50 ℃,保持8 min,再以5 ℃/min的升溫速度升溫至120 ℃,保持5 min。
2 結果與分析
2.1 糖誘導型啟動子過表達ALD6基因釀酒酵母的構建
2.1.1ALD6基因過表達菌株的構建與驗證
利用6種HXT系列糖誘導型啟動子Phxt1、Phxt2、Phxt3、Phxt4、Phxt5和Phxt7構建過表達ALD6的重組菌株a-Phxt1-A,a-Phxt2-A,a-Phxt3-A,a-Phxt4-A,a-Phxt5-A和a-Phxt7-A,挑選轉化子進行PCR驗證。以a-Phxt3-A菌株的構建為例,構建過程如1.3.1所述,對重組菌株a-Phxt3-A的驗證結果如圖2所示。用引物YZ-BAT2-U/D、YC-U/YA-D、H3-U/D對轉化子進行驗證,上游驗證引物YZ-BAT2-U/D,得到2 694 bp的條帶;中游驗證引物H3-U/D,得到3 430 bp的條帶;下游驗證引物YC-U/YA-D,得到1 691 bp的條帶,對照均無條帶。由圖2可知,PCR驗證結果與預期一致,說明菌株構建成功。之后通過1.3.1的方法去除重組菌株KanMX抗性標記。
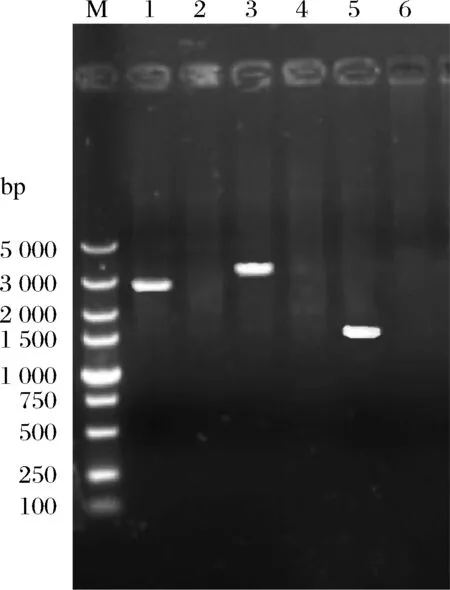
圖2 重組菌株a-Phxt3-A的PCR定點驗證Fig.2 PCR verification of the recombinant strain a-Phxt3-A注:M:DL5 000 bp Marker;泳道1、3和5分別為重組菌株a-Phxt3-A的上、中和下游驗證,泳道2、4和6為其陰性對照
2.1.2 基因表達水平的測定
按照1.3.2對ALD6基因表達量進行定量分析,結果如圖3所示。
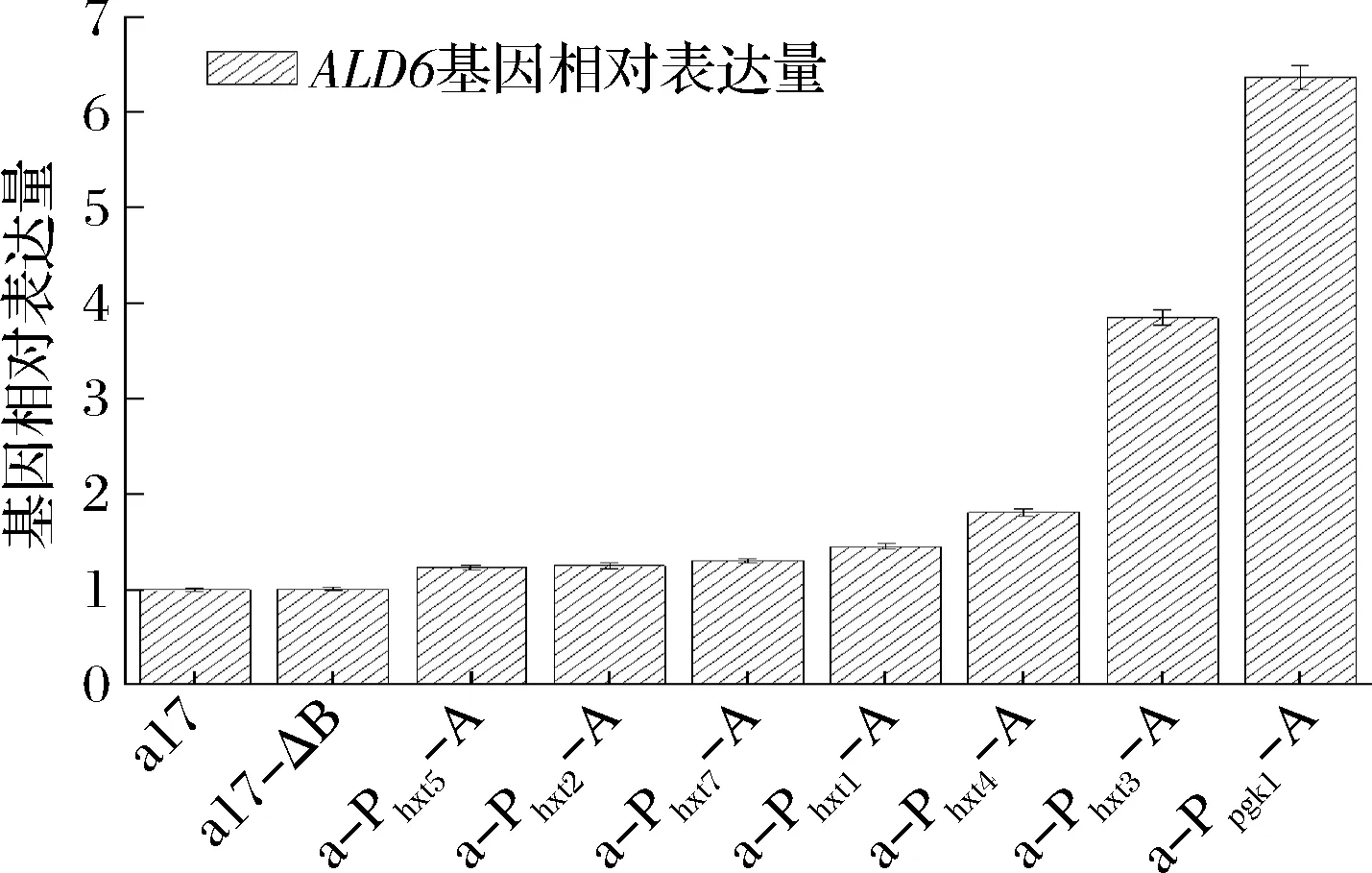
圖3 出發菌株和重組菌株的ALD6基因表達量結果Fig.3 Result of ALD6 expression level in the original and recombinant strains
其中a-Ppgk1-A、a-Phxt3-A、a-Phxt4-A、a-Phxt1-A、a-Phxt7-A、a-Phxt2-A和a-Phxt5-A中ALD6基因表達量分別是出發菌株的6.37、3.85、1.81、1.45、1.3、1.25、1.22和1.05倍,誘導型啟動子Phxt3對ALD6基因的表達產生的效果僅次于組成型強啟動子Ppgk1。本實驗使用普通YEPD培養基作為培養條件(葡萄糖濃度在20 g/L左右),若改變培養基條件,糖誘導型啟動子調控ALD6基因表達的強度可能也會改變。因此圖3中的ALD6基因的相對表達量僅能證明誘導型啟動子過表達ALD6基因重組菌株構建成功。
2.2 出發菌株和重組菌株的生長性能
2.2.1 YEPD培養基條件下的生長曲線
按照材料與方法1.3.3測定各菌株在YEPD培養基中的生長曲線,結果如圖4所示,相較于出發菌,過表達ALD6的重組菌株生長對數期的生長速率和穩定期時的生物量均略低,說明過表達ALD6基因可能影響酵母生長。而采用誘導型啟動子過表達ALD6菌株的生長性能比a-Ppgk1-A稍好,這表明誘導型啟動子的強度弱于組成型啟動子Ppgk1,其調控ALD6表達對酵母的生長性能影響相對較小。此條件下的生長曲線可說明糖誘導型啟動子Phxts在YEPD培養基的條件下表達強度弱于組成型啟動子Ppgk1,由于Phxts啟動子對葡萄糖濃度的響應強度不同,此培養條件與黃酒發酵條件下的糖濃度有很大差別,故后續采用大米清液體系測定各菌株生長性能。
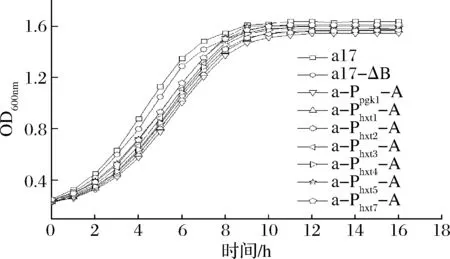
圖4 出發菌株和重組菌株的生長曲線Fig.4 Growth curve of the original and recombinant strains
2.2.2 大米清液體系中的生長性能
傳統黃酒發酵屬于半固態發酵,無法直接測定發酵過程中各菌株的生長性能,為測定在黃酒發酵條件中各菌株的生長性能,按1.3.4大米清液體系模擬傳統黃酒發酵體系,調節初始葡萄糖濃度70 g/L左右,發酵時每隔2 h取樣檢測600 nm處吸光度,以OD600值來衡量菌株在大米清液體系中的生長性能。由圖5可知,過表達ALD6基因的重組菌株在0~12 h的生長速率均低于出發菌株,說明過表達ALD6基因影響酵母生長。最終重組菌株a-Ppgk1-A生物量顯著低于其余菌株,a-Phxt1-A略低于出發菌,但重組菌株a-Phxt2-A、a-Phxt3-A、a-Phxt4-A、a-Phxt5-A和a-Phxt7-A最終生物量與出發菌株沒有顯著差異,再次驗證了在大米清液體系中,采用誘導型啟動子(Phxt2、Phxt3、Phxt4、Phxt5、Phxt7)調控ALD6基因的過表達可相對減弱其對酵母生長性能的影響。
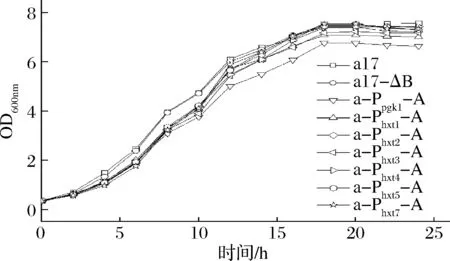
圖5 出發菌株和重組菌株在大米清液體系中的生長曲線Fig.5 Growth curve of the original and recombinant strains in supernatant of rice wine fermentation
2.3 出發菌株和重組菌株的發酵性能
將出發菌株a17和重組菌株a17-△B、a-Ppgk1-A、a-Phxt1-A,a-Phxt2-A,a-Phxt3-A,a-Phxt4-A,a-Phxt5-A和a-Phxt7-A按照1.3.4的方法進行傳統黃酒發酵,發酵結束后測定各菌株的CO2排放量、酒精度和發酵液中還原糖剩余量。如表3所示,采用誘導型啟動子Phxts過表達ALD6基因的菌株還原糖余量相較于出發菌稍高,但低于重組菌株a-Ppgk1-A,且對酒精生成量和CO2排放量幾乎沒有影響。而重組菌株a-Ppgk1-A還原糖余量最高,CO2排放量和酒精度均低于出發菌和其他重組菌株,說明組成型啟動子Ppgk1過表達ALD6基因對菌株發酵性能影響最大,與本實驗室前期研究結果一致。綜上所述,過表達ALD6基因對酵母發酵性能會產生影響,但采用誘導型啟動子過表達ALD6基因可相對改善這一現象。
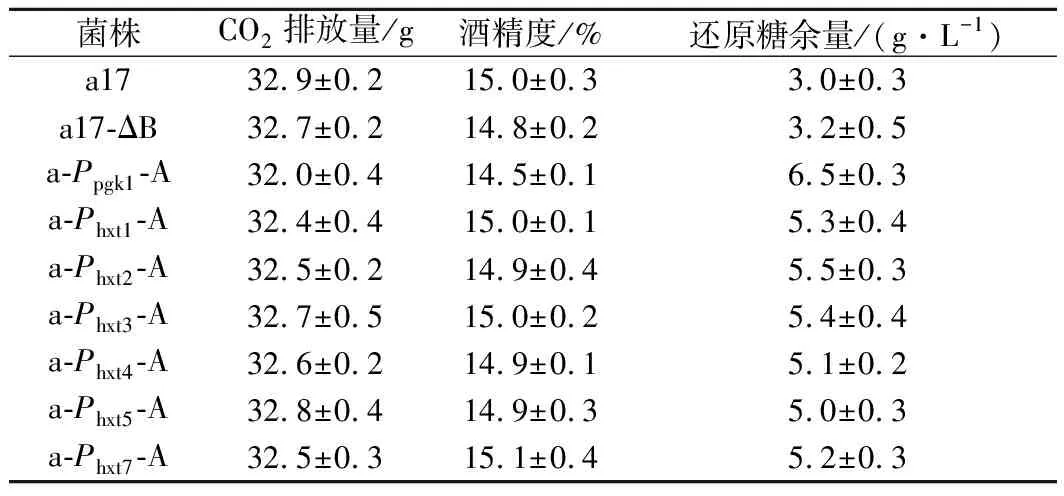
表3 出發菌株和重組菌株基本發酵性能的比較Table 3 Fermentation performances of the original and recombinant strains
2.4 出發菌株和重組菌株的乙酸和高級醇生成量
2.4.1 出發菌株和重組菌株的乙酸生成量
乙醛脫氫酶氧化乙醛產生乙酸,本研究檢測了傳統黃酒發酵條件下所得發酵液中乙酸的生成量(圖6)。重組菌株a-Phxt5-A、a-Phxt2-A、a-Phxt7-A、a-Phxt1-A、a-Phxt4-A、a-Phxt3-A和a-Ppgk1-A的乙酸生成量分別是出發菌株a17的1.24、1.29、1.4、2、2.88、3和4.44倍。其中重組菌株a-Ppgk1-A的乙酸生成量最高,達到1.11 g/L,表明在傳統黃酒發酵體系中,組成型強啟動子Ppgk1調控ALD6基因表達的強度要高于糖誘導型啟動子Phxts,在糖誘導型啟動子中,重組菌株a-Phxt3-A乙酸生成量最高,達到0.75 g/L。從乙酸的生成量可大致說明在此傳統黃酒發酵體系中糖誘導型啟動子調控ALD6基因表達的強度為Phxt3>Phxt4>Phxt1>Phxt7>Phxt2>Phxt5,與2.1.2以YEPD培養基為培養條件時,基因表達水平測定結果基本一致,調控ALD6基因表達水平越高,則乙酸生成量也越高。

圖6 出發菌株和重組菌株的乙酸生成量Fig.6 Acetic acid production of the original and recombinant strains
綜上,當乙酸含量較高時,對酵母生長性能產生不利影響,通過誘導型啟動子調控ALD6基因的表達,可相應調節乙酸產量,進而降低對酵母生長的影響。原因可能是乙酸的上升,酵母細胞不能維持胞質膜電位平衡,導致細胞酸化,影響細胞代謝[17]。
2.4.2 出發菌株和重組菌株的高級醇生成量
按照傳統發酵工藝發酵結束后,測定出發菌株和重組菌株餾出液中高級醇的生成量,如圖7所示。與出發菌株a17相比,重組菌株的高級醇產量均有所下降。其中a-Ppgk1-A、a-Phxt3-A、a-Phxt4-A、a-Phxt7-A、a-Phxt1-A、a-Phxt2-A、a-Phxt5-A和a17-ΔB總高級醇分別下降52.36%、42.56%、37.84%、30.74%、22.29%、19.26%、16.72%和11.48%。重組菌株a-Ppgk1-A高級醇產量降低最多,苯乙醇、異戊醇、異丁醇、正丙醇分別降低45.67%、56.16%、48.55%、52.41%,總高級醇由592.31下降到280.65 mg/L。重組菌株a-Phxt3-A次之,苯乙醇、異戊醇、異丁醇、正丙醇分別降低37.03%、45.45%、38.69%、41.63%,總高級醇由592.31下降到340.47 mg/L。與誘導型啟動子Phxts相比,強啟動子Ppgk1過表達ALD6基因的菌株降低高級醇效果更為顯著,可能因為黃酒發酵過程中誘導型啟動子調控ALD6基因的表達不如組成型啟動子穩定,或者其表達強度弱于組成型啟動子[18]。
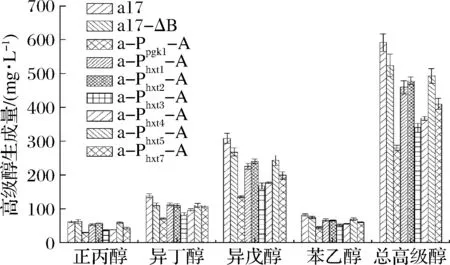
圖7 出發菌株和重組菌株的高級醇生成量Fig.7 Higher alcohols production of the original and recombinant strains
在6種HXT系列糖誘導型啟動子中Phxt3過表達ALD6基因的菌株降高級醇效果最顯著,這是因為黃酒主發酵過程中葡萄糖質量濃度一般在25~75 g/L,Phxt3是中糖誘導的啟動子,故此糖度有利于啟動子Phxt3調控ALD6的表達[19]。Phxt4與Phxt7過表達ALD6菌株降低高級醇效果次之,這可能因為傳統黃酒補水發酵的最初階段發酵液中的葡萄糖濃度較低,在此階段誘導了啟動子Phxt4和Phxt7調控ALD6基因的表達,但隨著原料的糖化發酵液中糖濃度提高,又抑制了其表達[20]。而Phxt2和Phxt5可能是因為其本身強度較弱使得ALD6基因表達相對較低,因此最后降低高級醇效果相對較弱。Phxt1過表達ALD6菌株降低高級醇效果最弱,這是因為啟動子Phxt1最適糖質量濃度為90~130 g/L,黃酒發酵過程中無法達到該濃度[21]。
重組菌株高級醇生成量降低的原因可能是高級醇的前體物質醛類可以被乙醛脫氫酶氧化生成有機酸,故醛類還原產生高級醇有所減少[22-23]。結合圖6、7,隨著重組菌株乙酸的上升,高級醇生成隨之降低,所以重組菌株高級醇降低的另一原因可能與其乙酸含量顯著上升有關,高濃度乙酸抑制細胞代謝,影響了酵母的生長速率,因此,過表達ALD6可能是通過增加乙酸產量,抑制了酵母的生長性能,進而降低了高級醇含量。
3 結論
本研究在釀酒酵母中選用6個HXT系列糖誘導型啟動子Phxt1、Phxt2、Phxt3、Phxt4、Phxt5和Phxt7過表達乙醛脫氫酶基因ALD6構建6個重組菌株a-Phxt1-A、a-Phxt2-A、a-Phxt3-A、a-Phxt4-A、a-Phxt5-A、a-Phxt7-A,對比了其與實驗室前期構建重組菌株a-Ppgk1-A、出發菌a17的生長和發酵性能、乙酸及高級醇生成量,過表達ALD6基因使酵母產乙酸增多,影響酵母的生長性能,但是糖誘導型啟動子較Ppgk1可以適當減弱其對酵母產生的負面影響。同時,在傳統黃酒發酵體系中重組菌株還原糖余量均高于出發菌株,Ppgk1過表達ALD6基因對菌株產酒精能力影響較顯著,而Phxts幾乎不影響菌株的發酵性能。與出發菌株a17相比,重組菌株的高級醇產量均有所下降,其中a-Ppgk1-A、a-Phxt3-A、a-Phxt4-A、a-Phxt7-A、a-Phxt1-A、a-Phxt2-A、a-Phxt5-A總高級醇分別下降52.36%、42.56%、37.84%、30.74%、22.29%、19.26%和16.72%。綜上所述,誘導型啟動子Phxt3過表達ALD6基因的重組菌株a-Phxt3-A降高級醇效果最好且對酵母生長和發酵性能的影響相對較小。本研究采用動態調控策略利用糖誘導型啟動子初步解決了ALD6基因過表達對酵母生長和發酵的影響,后續還需要擴大發酵體系,優化發酵工藝進一步驗證HXT系列糖誘導型啟動子調控ALD6基因表達及其降高級醇的效果。

