代謝改造釀酒酵母生產番茄紅素
李方迪,李由然,張梁,丁重陽,顧正華,石貴陽,徐沙*
1(江南大學 糧食發酵工藝與技術國家工程實驗室,江蘇 無錫,214122)2(江南大學 生物工程學院,江蘇 無錫,214122)
番茄紅素,一種四萜類化合物,被廣泛應用于保健品、醫藥等行業,因其卓越的抗氧化性被熟知。臨床研究證明,番茄紅素在預防心血管疾病、前列腺癌、乳腺癌等方面都有顯著功效[1],可以降低心肌梗塞的風險,降低血壓,并防止低密度脂蛋白膽固醇的氧化[2]。一般來說,番茄紅素不能由人體自身合成,只能從外界獲取,因此具有極高的商業價值。過去番茄紅素的生產方式多為植物提取,近些年來環保高產的微生物發酵法逐漸成為主流。微生物發酵不僅可以解決植物種植占用大量土地的問題,還可以解決化學合成不環保的弊端,更重要的是,發酵產生的番茄紅素是天然產物,其異構性和活性與從自然界中提取的活性成分一致[3],因此,番茄紅素生產的前景廣闊。
常用于番茄紅素生產的細胞工廠有大腸桿菌、谷氨酸棒狀桿菌、釀酒酵母、解脂亞洛酵母等。大腸桿菌由于其生長快、培養條件簡單、基因操作工具成熟等優點,是最早開發的番茄紅素生產底盤細胞。重組大腸桿菌通過引入番茄紅素合成途徑和發酵條件優化,生產出2.7 g/L番茄紅素,是迄今為止使用基因工程大腸桿菌報告的番茄紅素產量最高水平[4]。然而仍然存在一些爭議,大腸桿菌在發酵過程中釋放一些內毒素,從而引起食品安全問題,與其相對的,酵母因其較高的食品安全性脫穎而出,經過代謝改造,番茄紅素在解脂亞洛酵母中可以積累到175 mg/g DCW[5]。LI等[6]研究表明,甲羥戊酸(mevalonate,MVA)途徑的代謝產物,包括番茄紅素在菌體中的積累會抑制菌體生長,脂質體(lipid droplets,LDs)的積累可以緩解產物毒性,同時由于番茄紅素的結構易溶于脂,增大LDs含量有利于提高其在胞內的積累。三酰甘油(triacylglycerol,TAG)是在真核細胞中含量最高的儲能物質,在脂肪酸消耗期間可保證膜脂的供給,且其毒性相對游離脂肪酸較低[7],這給胞內脂肪酸提供了儲存方式。增加胞內脂質含量有多種方法,如過表達脂肪酸(fatty acid,FA)及TAG合成途徑相關基因[8-9],釀酒酵母自身存在MVA途徑、丙烷脫氫(propane dehydrogenation,PDH)途徑與TAG途徑(圖1),分別是番茄紅素合成的前體代謝途徑、乙酰輔酶A(coenzyme A,CoA)胞內合成途經與三酰甘油TAG合成的途徑。TAG途徑以乙酰CoA為前體物質,經由限速酶Acc1羧化生成丙二酰輔酶A,進而轉化生成脂肪酰輔酶A,進一步轉化為磷脂酸(phosphatidic acid,PA),由關鍵酶Pap1催化生成甘油二酯(diacylglycerol,DAG),最后由Dga1進一步酰化生成TAG。三酰甘油是釀酒酵母中LDs的主要組成成分,Ldp1會附著于脂滴表面,顯著增大脂滴的體積。乙酰輔酶A供應和產物形成途徑中能量耦合和氧化還原輔因子平衡的整體分析對于高效細胞工廠的設計至關重要[10]。陳符江等[11]異源表達來自腸道沙門氏菌的胞質乙酰輔酶A合成酶acs1,并設計L641P氨基酸取代來防止乙酰化,從而解除了Acs1受到乙酰輔酶A乙酰化賴氨酸殘基的抑制,這些修飾顯著增加了線粒體外Acs1的活性,胞內乙酰輔酶A含量提高了2.19倍。此外,CHEN等[12]通過敲除ypl062w位點,使胞內的乙酰輔酶A增加了1倍。TRIKKA等[13]在釀酒酵母中敲除了exg1位點,將類胡蘿卜素的產量提高了接近8倍。聚腺苷酸聚合酶(Pap1)催化向幾乎所有mRNA添加poly(A)尾的反應[14],MEINKE等證明,poly(A)尾的添加促進了mRNA從核轉運至胞質的過程,結合于poly(A)尾的蛋白質與mRNA 5′端之間的相互作用可提高翻譯效率。
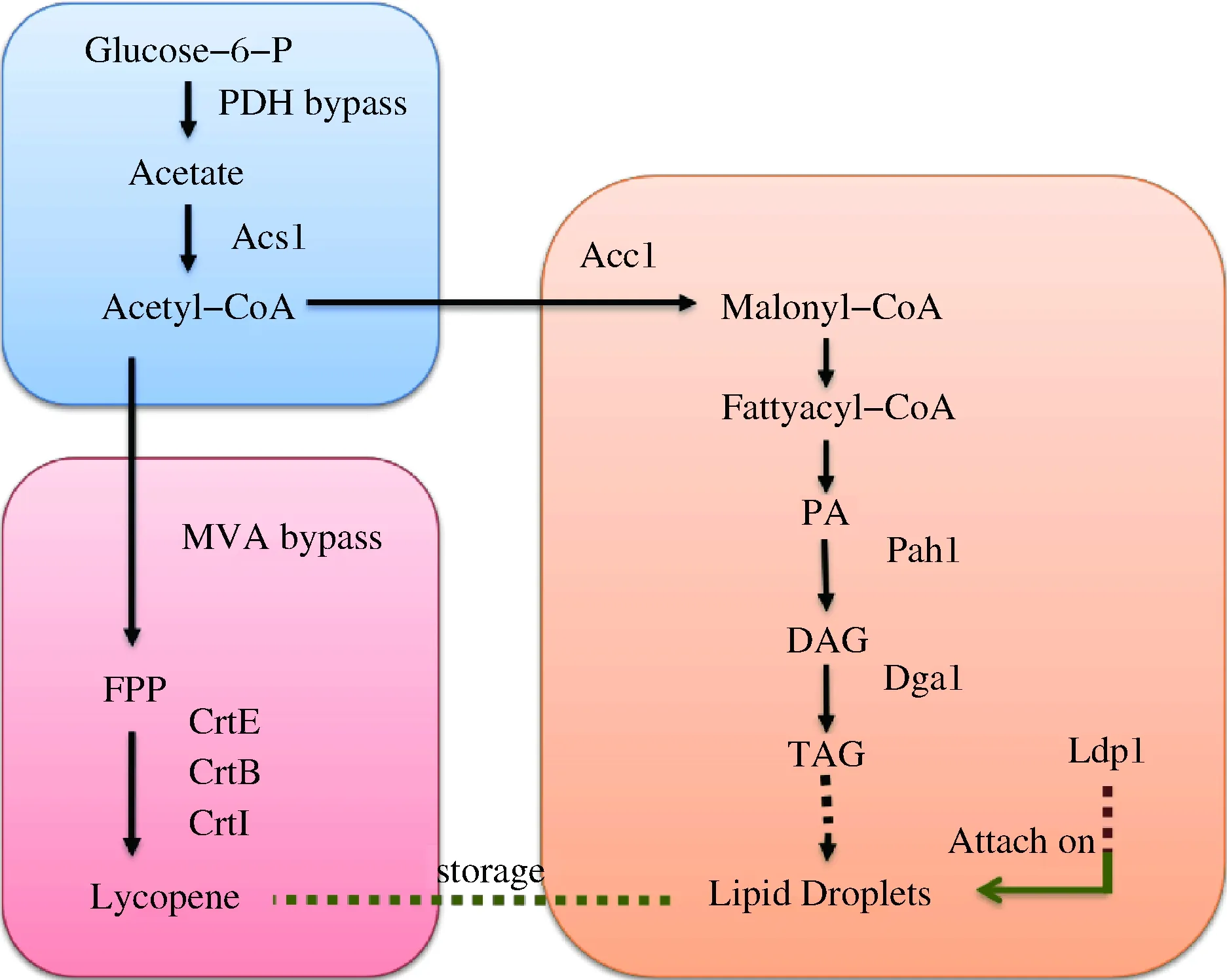
注:Acs1-醋酸鹽-輔酶A連接酶1;Acc1-乙酰輔酶A羧化酶;Pah1-磷脂酸磷酸酶;Dga1-二酰基甘油O-酰基轉移酶;Ldp1-脂質體定位蛋白; CrtE-香葉基香葉基二磷酸合酶; CrtB-八氫番茄紅素合酶; CrtI-八氫番茄紅素去飽和酶圖1 釀酒酵母胞質中胞質乙酰輔酶A合成途徑、番茄紅素合成途徑及脂質代謝途徑Fig.1 Metabolic pathway of lycopene,acetyl coenzyme A and lipids in S. cerevisiae
本文以釀酒酵母YPH499為底盤細胞,過量表達關鍵基因dga1、pah1[15],以及與脂滴形成關聯緊密的ldp1基因[16]。TAG途徑與MVA途徑均主要發生在細胞質中,而該途徑的前體乙酰輔酶A主要存在于線粒體中,這就導致前體供應成為一個亟待解決的問題。本文將來自三孢布拉霉的acs1基因敲入釀酒酵母內,這是一個定位于胞質內的丙酮酸脫氫酶,研究表明敲入該基因可使胞質乙酰CoA的含量增加50%以上[10];同時敲除ypl062w位點,該位點的缺失可提高所有萜類的產量[12]。本文中涉及到多個基因過表達,在較高的轉錄需求下,強化pap1基因(多核苷酸腺苷酸轉移酶)表達是必要的,這一點在后續的實驗結果中也得到了證實。選取本實驗室的YthmgⅠ為出發菌株,該菌株在YPH499的基礎上敲除了gal80,同時過表達了thmg1基因。經過代謝改造,番茄紅素在重組菌內的單位產量顯著提高。
1 材料與方法
1.1 材料
1.1.1 菌株、質粒和引物
本文使用的所有菌株詳見表2,質粒見表3,引物詳見表4。
1.1.2 培養基
本實驗培養大腸桿菌所用培養基為LB(Luria-Bertani)培養基(g/L):酵母粉5,蛋白胨10,NaCl 10;培養釀酒酵母所用培養基為DYPD(g/L):酵母粉20,蛋白胨40,葡萄糖20;誘導ura3抗性標記丟失所用培養基為5-FOA-YNB(yeast nitrogen base):體積分數1%的五氟乳清酸母液,體積分數1%的氨基酸補足母液,葡萄糖20 g/L,酵母氮源基礎培養基7 g/L;固體培養基另添加18 g/L瓊脂粉。
1.1.3 母液配制
五氟乳清酸溶液:取1 g五氟乳清酸固體粉末于50 mL EP管內,加入10 mL二甲基亞砜于55 ℃隔水融化,過膜分裝,于-20 ℃避光保存;
氨基酸補足母液(μg/mL):亮氨酸100,賴氨酸100,色氨酸80,尿嘧啶30,組氨酸30;
抗生素母液:氨芐青霉素、卡那霉素、硫酸諾爾斯菌素、潮霉素母液濃度分別按照100、100、100、500 mg/mL配制,添加于培養基時均按照0.1%的體積比。
1.1.4 酶與試劑盒
本實驗所用酶與試劑盒見表1。菌株、質粒和引物見表2~表4。

表1 工具酶與試劑盒Table 1 Tool enzymes and kits

表2 菌株Table 2 Strains

表3 質粒Table 3 Plasmids
1.2 實驗方法
1.2.1 重組菌表達盒的構建
本實驗選取來自三孢布拉霉(Blakesleatrispora)的acs1L641P,來自產脂酵母(Rhodosporidiumtoruloides)的ldp1以及來自釀酒酵母YPH499的pah1、dga1、pap1。前二者經密碼子優化后送由上海生工公司合成,后者以YPH499基因組為模板進行PCR擴增。
以GAL1,10pr-acs1L641P-ADH1ter表達盒構建為例:(1)提取YPH499基因組,以其為模板PCR擴增得到GAL1、10pr、ADH1ter以及靶點ypl062w連帶其左右同源臂;(2)通過融合延伸PCR將GAL1、10pr、acs1L641P、ADH1ter連接在一起,而后利用TA連接的方法將上述融合片段連接19T(simple)載體,菌落PCR驗證;(3)利用TA連接將靶點ypl062w連帶其左右同源臂連接載體Vector 19T(simple),反向PCR擴增連帶左右同源臂的載體片段;(4)挑取步驟(2)驗證正確的菌落接入液體培養基,于37 ℃,200 r/min過夜培養后提取質粒并酶切純化得到目的片段,將該片段與步驟(3)擴增出的載體過夜連接后轉化大腸桿菌JM109,菌落PCR驗證。
以同樣方法構建其他表達盒。
1.2.2 Sg質粒的構建
利用網站E-Crisp設計sgRNA并將其設計入引物中(表4),以實驗室保藏質粒302、149為模板分別擴增出啟動子與發卡結構的對應片段,然后重疊延伸PCR將兩片段融合,酶切后連接BTS’質粒。

表4 引物Table 4 Primers

續表4
1.2.3 篩選及重復轉化
本研究利用的CRISPR-Cas9基因編輯系統是一個雙質粒系統,Cas9蛋白和sgRNA分別由2個游離質粒在釀酒酵母菌株中表達以進行相應基因座的敲除整合。以YthmgⅠ為底盤細胞,利用醋酸鋰轉化法將Cas質粒、sg質粒與線性化重組片段轉入細胞,利用同源重組的機制完成整合,利用抗生素硫酸諾爾斯菌素與潮霉素進行重組菌株篩選,將完成轉化的菌液涂布至諾爾斯-潮霉素雙抗DYPD平板上,倒置于30 ℃培養箱至長出轉化子,經菌落PCR初步篩選,再通過基因組測序驗證后獲得整合表達菌株。
由于轉化完成后的質粒依然在底盤細胞內殘留,這會影響再次轉化,故在進行下一步操作前丟棄原有質粒是必要的。本研究根據ura3標記篩選原理,將無抗培養傳代后的改造菌株涂布至5-FOA-YNB平板進行篩選,倒置于30 ℃培養箱至長出轉化子,挑取單菌落接種于DYPD液體培養基搖培以待再次轉化。
1.2.4 重組菌發酵實驗
挑取轉化完成的平板上的菌落接至DYPD培養基中,30 ℃,200 r/min培養至對數生長中期,即OD值0.6~0.8,以10%的接種量接至含15 mL培養基的25 mL小搖瓶中,30 ℃,200 r/min搖培至96 h。定時取樣對重組菌生長趨勢及合成番茄紅素水平進行測定。
1.2.5 生長趨勢測定及番茄紅素提取
取1.5 mL菌液備用。其中1 mL菌液離心棄上清液,ddH2O洗滌2次后烘至恒重,稱量計算干重。另0.5 mL菌液同樣離心洗滌,添加菌體等體積的玻璃珠與1 mL三氯甲烷;振蕩破碎3 min,冰浴1 min,重復2~3次,4 ℃低溫離心后錫紙包裹,于4 ℃冰箱內靜置過夜萃取。隔天吸取萃取液至新EP管中,氮氣吹干,精確添加1 mL正己烷復溶,用酶標儀測定番茄紅素產量。
1.2.6 番茄紅素測定
本研究使用酶標儀進行番茄紅素測定,測定波長為472 nm,每個樣品取4個平行。番茄紅素標品用于定量分析,精確稱取1.5 mg番茄紅素標品用正己烷定量于15 mL棕色容量瓶,充分溶解,加入體積分數1%的2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)作為抗氧化劑,4 ℃冰箱保存備用。預實驗結果證明番茄紅素樣品在0~20 mg/L線性最好,故選取該范圍制作標準曲線及樣品測定。
1.2.7 胞外代謝物的檢測
發酵液中葡萄糖、乙醇的濃度利用高效液相色譜進行測定。以Bio-RadHPX-87H為色譜柱,5%的稀硫酸作為流動相,流速為0.8 mL/min,柱溫50 ℃,示差檢測器。
1.2.8 熒光顯微鏡檢
番茄紅素主要積累于釀酒酵母胞內的脂閥上,會于熒光顯微鏡綠色激發光下發出熒光。將轉化番茄紅素表達盒的重組菌株涂布諾爾斯-潮霉素雙抗平板,30 ℃培養箱倒置培養4 d后挑取紅色單菌落制片,置熒光顯微鏡100×物鏡下,分別于明場下與綠色激發光下觀察其圖像。
2 結果與分析
2.1 代謝改造表達盒的構建
構建脂質途徑改造表達盒如圖2-a所示,前體及轉錄途徑相關表達盒如圖2-b所示。本研究以YthmgⅠ[17]為出發菌株,對gal10位點敲入ldp1同時敲除gal10,得到重組菌株LFD5,單獨敲除gal10得到LFD6;在gal7位點敲入pap1同時敲除gal7,得到LFD7,單敲除gal7得到LFD8;在exg1位點敲入GAL1,10pr-pah1-ADH1ter同時敲除exg1,得到LFD9;敲入ADH1ter-dga1-GAL1,10pr-pah1-ADH1ter同時敲除exg1,得到LFD10;單敲除exg1得到LFD11;在gal1位點敲入acc1同時敲除gal1,得到LFD13;單敲除gal1得到LFD14。

a-GAL啟動子控制TAG途徑關鍵基因的表達;b-GAL啟動子控制關鍵基因pap1和acs1L641P的表達圖2 代謝改造途徑表達盒Fig.2 Metabolic engineering pathway expression box
以LFD10為出發菌株,對gal10位點敲入ldp1同時敲除gal10,得到重組菌株LFD12。以LFD12為出發菌株,在ypl062w位點敲入GAL1,10pr-acs1L641P-ADH1ter同時敲除ypl062w,得到重組菌LFD15,單敲除ypl062w得到LFD16;分別以LFD12、LFD15為出發菌株,于gal7位點敲入pap1同時敲除gal7,得到重組菌LFD17、LFD18。
2.2 釀酒酵母脂質體合成途徑的改造
將脂質途徑改造重組菌LFD5、LFD6、LFD9、LFD10、LFD11、LFD12、LFD13、LFD14,進行發酵培養,取發酵96 h時的樣品進行分析測定,結果如圖3所示。

圖3 重組菌搖瓶發酵的番茄紅素產量Fig.3 Lycopene production in shake flask fermentation of recombinant strains注:LFD5:as YthmgⅠ;Δgal10∷ldp1;LFD6:as YthmgⅠ;Δgal10∷non-marker;LFD9:as YthmgⅠ;Δexg1∷GAL1, 10pr-pah1-ADH1ter;LFD10:as YthmgⅠ;Δexg1∷GAL1,10pr-pah1,dga1-ADH1ter;LFD11:as YthmgⅠ;Δexg1∷non-marker;LFD12:as YthmgⅠ;Δgal10∷ldp1;Δexg1∷GAL1, 10pr-pah1, dga1-ADH1ter;LFD13:as YthmgⅠ;Δgal1∷acc1;LFD14:as YthmgⅠ;Δgal1∷non-marker
就過表達單個基因而言,LFD5的產量最高,但仍不及出發菌株。雖然各基因單一表達時對番茄紅素產量提升的效果并不顯著,但組合表達后,重組菌LFD12(過表達dga1、pah1、ldp1)的產量大大提高,為45.76 mg/g DCW,是YthmgⅠ的1.5倍。選取產量較高的重組菌,利用熒光顯微鏡對細胞形態進行觀察,結果如圖4所示。菌體熒光亮度與番茄紅素單位細胞產量呈正相關,胞質內出現較為明亮的綠色小點。

圖4 熒光顯微鏡觀察重組菌于綠色激發光下(a)與明場下(b)的圖像Fig.4 Fluorescence microscopy images of recombinant strains under green excitation light (a) and bright field (b)
2.3 胞內乙酰輔酶A合成酶及轉錄翻譯相關基因的過表達
對重組菌LFD12(基于YthmgⅠ組合過表達脂質相關基因)、LFD15(基于LFD12過表達乙酰CoA合成基因)、LFD18(基于LFD15加強轉錄翻譯基因)敲入番茄紅素表達盒后進行發酵,結果如圖5所示。可以看出LFD18的產量最高,單位產量109.26 mg/g DCW,是出發菌株YthmgⅠ的3.36倍。
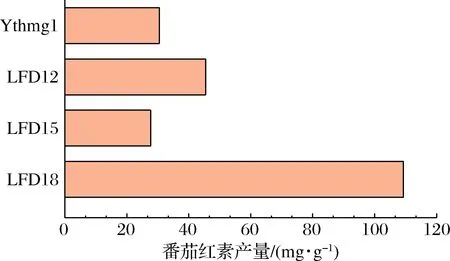
圖5 重組菌搖瓶發酵的番茄紅素產量Fig.5 Lycopene production in shake flask fermentation of recombinant strains注:LFD12:as YthmgⅠ;Δgal10∷ldp1;Δexg1∷GAL1, 10pr-pah1, dga1-ADH1ter;LFD15:as LFD12;Δypl062w∷GAL1, 10pr-acs1L641P-ADH1ter;LFD18:as LFD15;Δgal7∷pap1
分別對LFD12、LFD15、LFD18進行熒光鏡檢,結果如圖6所示,LFD18的熒光最為明亮,這與番茄紅素產量相符。

圖6 熒光顯微鏡觀察重組菌于綠色激發光下(a)與明場下(b)的圖像Fig.6 Fluorescence microscopy images of recombinant strains under green excitation light (a) and bright field (b)
為了進一步探究過表達pap1的效果,分別對YthmgⅠ、LFD7(基于YthmgⅠ過表達pap1)、LFD18(基于LFD15過表達pap1)敲入番茄紅素表達盒后進行搖瓶發酵實驗,定期取樣至96 h進行分析測定,繪制曲線圖,結果如圖7所示。可看出,通過代謝改造敲入的基因越多,過表達pap1對產量的提升越為顯著。
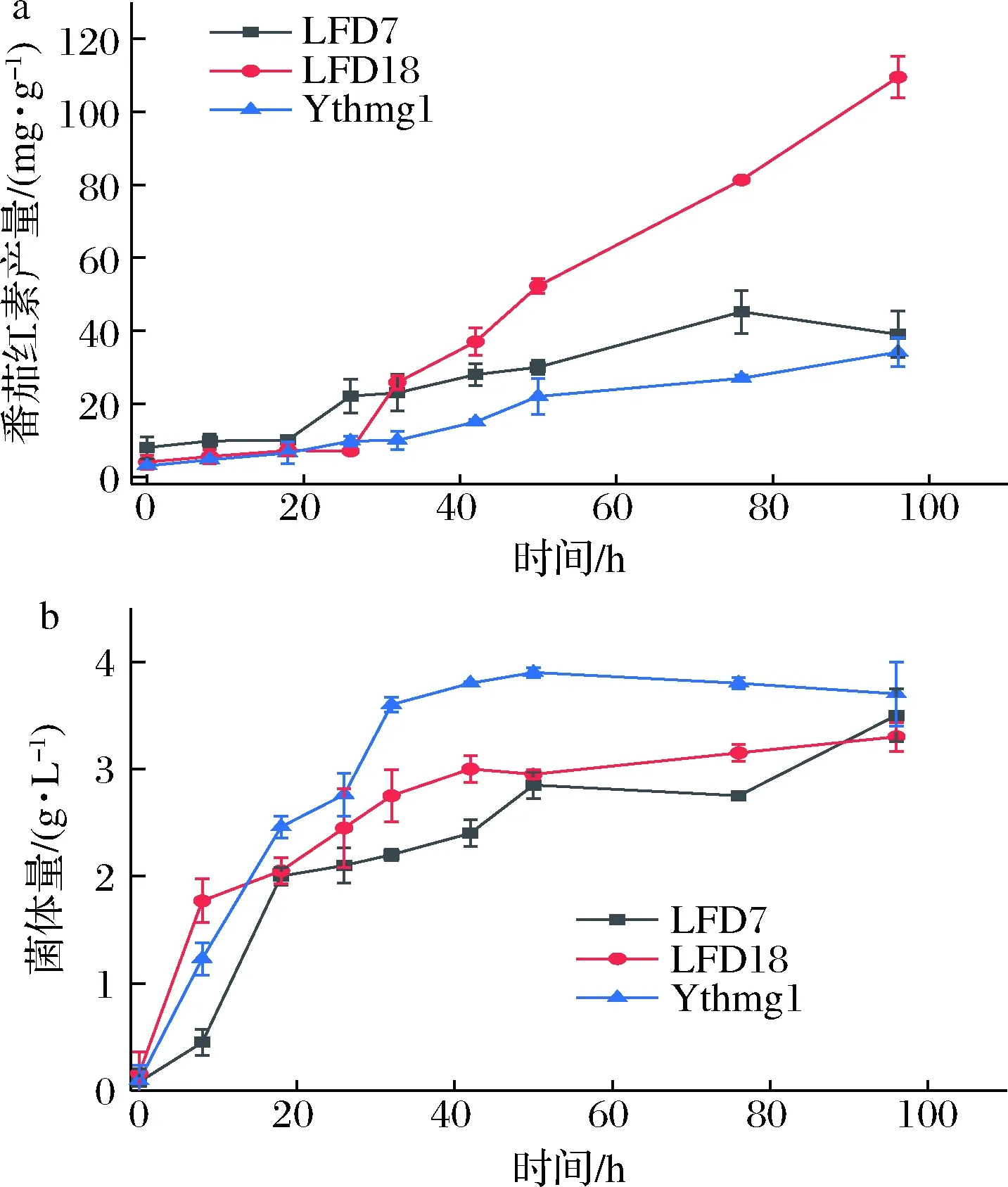
a-番茄紅素產量;b-菌株生長曲線圖7 使用不同出發菌株過表達pap1的效果Fig.7 Typical profiles observed for lycopene production and cell growth注:LFD7: as YthmgⅠ; Δgal7∷pap1; LFD18: as YthmgⅠ; Δexg1∷GAL1,10pr-dga1, pah1-ADH1ter; Δgal10∷ldp1; Δypl062w∷GAL10pr-acs1L641P-ADH1ter; Δgal7∷pap1
2.4 發酵罐發酵培養
本研究使用上海迪必爾5 L發酵罐,發酵菌株為LFD18,發酵條件為:溫度30 ℃,轉速500 r/min;使用的培養基為DYPD,從發酵45 h開始以20 g/h的速度恒速流加補充葡萄糖;發酵時長為96 h。對番茄紅素產量、菌體生長情況以及胞外代謝產物進行測定,結果如圖8所示。
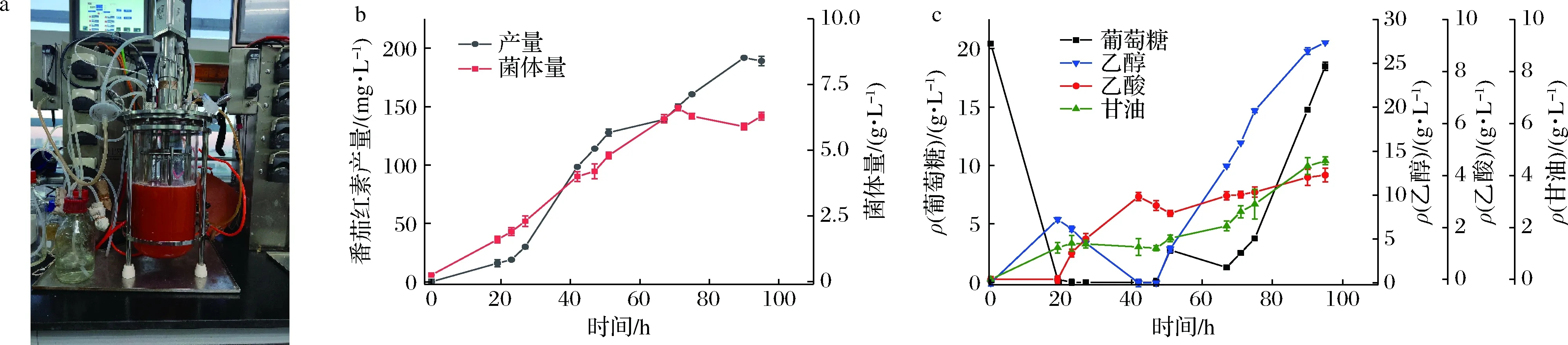
a-LFD18在發酵罐中補料發酵96h;b-LFD18的生長曲線和番茄紅素產量;c-LFD18發酵液中葡萄糖、乙醇、乙酸酯和甘油的濃度圖8 葡萄糖補料發酵LFD18的番茄紅素產量、菌體量及副產物測定Fig.8 Determination of lycopene yield, biomass and by-products of LFD18 during glucose fed-batch fermentation
番茄紅素產量最終達到191.77 mg/L,單位產量為30.44 mg/g DCW。葡萄糖在0~23 h被快速耗盡,同時產生一定量乙醇;葡萄糖耗盡后,乙醇作為碳源被消耗,菌體生長減緩,番茄紅素快速積累,同時生成乙酸。自45 h恒速流加葡萄糖后,乙醇重新開始積累,菌體繼續緩慢生長,至60 h后達到穩定。發酵總過程隨著菌體生長出現一定的甘油積累,累積速度與菌體生長呈現不完全的正相關,且在發酵過程中幾乎不被消耗。
3 結論與討論
TAG途徑與MVA途徑共用乙酰CoA作為前體,而2個途徑的產物積累時間不盡相同:本實驗構建的番茄紅素表達盒由GAL啟動子啟動,其產物積累會發生在葡萄糖濃度降低時;而菌體中脂質積累在氮源耗盡且碳源充足時較為顯著[18],可以實現2條代謝途徑的有序分流,亦可避免短時間內代謝通量過大耗盡乙酰CoA庫,有利于維持菌體內部代謝的動態平衡。本實驗利用GAL啟動子組合過表達脂質途徑相關基因后,番茄紅素產量提升至45.76 mg/g DCW,是原菌株產量的1.7倍,說明提高菌體內脂質含量有利于番茄紅素積累。觀察顯微鏡像可見,菌體熒光強度與脂質改造過表達基因數目正相關。
MA等[15]在釀酒酵母中同時過表達TAG途徑的關鍵基因pah1、dga1、acc1后胞內TAG含量增加了59%,番茄紅素產量提升了110%;此外還敲除了fld1,該策略顯著增加了番茄紅素積累,但是縮短了釀酒酵母的壽命。ZHU等[16]研究表明,ldp1在釀酒酵母中過量表達時,Ldp1定位于脂滴表面促進了巨大脂滴形成,這表明Ldp1在酵母脂滴動力學方面有著重要作用。SHI等[19]通過在釀酒酵母中過表達來自腸道沙門氏菌的乙醛脫氫酶基因ald6、乙酰輔酶A合成酶基因acs以及乙醇脫氫酶基因adh211,顯著增加了代謝通量,番茄紅素產量相較改造前提高了12%。SHIBA等[20]組合表達來自三孢布拉霉的ald6和acs1L641P將乙酸合成乙酰輔酶A的轉化率提高了3倍,使得紫穗槐二烯的產量提高了4倍。本實驗在脂滴改造的基礎上進一步加強乙酰CoA的表達,番茄紅素產量相較過表達acs1L641P前并無提高,而在脂質改造及乙酰CoA改造的基礎上進一步強化轉錄相關基因pap1后番茄紅素產量提高了2.6倍,單位產量達到109.26 mg/g DCW,鏡檢可見菌體熒光明顯增強,說明基因過表達應輔以轉錄強化,保證對應基因的高效表達。
SHI等[19]使用7 L發酵罐,分別使用葡萄糖與乙醇作為碳源,通過兩階段補料方法對代謝改造釀酒酵母進行發酵,番茄紅素總產量達到3.28 g/L,相較搖瓶發酵產量310 mg/L提高了11倍。本實驗結合脂質工程與代謝工程,構建了番茄紅素高產釀酒酵母菌株,搖瓶發酵產量為360.66 mg/L;通過發酵罐恒速流加葡萄糖培養96 h,產量為191.77 mg/L,相較搖瓶反而有所降低。菌體在發酵后期退化較為嚴重,猜測一是由于發酵后期葡萄糖流加速度過大導致乙醇大量積累,抑制了菌體生長;二是YPH499菌株本身較容易退化,不適宜大體系發酵培養。后續可以再實行發酵培養基優化、分批補料優化等策略,進一步提高重組菌的番茄紅素產量。

