內鏡下黏膜切除術及黏膜剝離術治療早期胃癌和癌前病變的效果分析
公茂春
(蒙陰縣人民醫院 山東 臨沂 276200)
臨床常見消化道惡性腫瘤為早期胃癌(EGC):病變僅在黏膜層、黏膜下層存在,無淋巴結轉移現象。隨著內鏡技術發展,EGC及癌前病變檢出率逐年增加[1]。目前分析此病的病因無定論,常見因素有[2-3]:遺傳、不良飲食及不良作息等,患病后呈胃灼熱、反酸及上腹部不適等,若疾病持續進展則危及生命,故建議以減緩不適、切除病灶為目標,早期給予對癥治療很重要。部分學者證實[4],內鏡下黏膜切除術(EMR)是治療此病的常見方法,具侵襲小、術后疼痛輕微等優勢,切除病灶、避免疾病復發,但存有并發癥多、預后不良及應激性強等缺陷,對患者生存質量造成影響,缺乏研究深度及廣度、臨床應用受限[5]。基于上述背景,本文以本院2021年1月-2021年12月收治的68例EGC及癌前病變患者為主體,分析ESD術用于EGC及癌前病變治療中的價值,匯總報告如下:
1 資料與方法
1.1 基線資料
選取本院2021年1月-2021年12月收治68例EGC及癌前病變患者為對象,科學組(34例):男女例數20:14,年齡60-79歲,均值(68.23±2.41)歲;病灶直徑1.3-2.9cm,均值(2.23±0.38)cm;其中胃體、胃底賁門及胃竇部各16例、14例及4例;EGC有19例,癌前病變15例;BMI值19-26kg/m2,均值(23.34±0.26)kg/m2;參照組(34例):男女例數22:12,年齡61-80歲,平均(68.36±2.52)歲;病灶直徑1.4-3.0cm,均值(2.34±0.41)cm;病變部位:胃體、胃底賁門及胃竇部各15例、15例及4例;其中EGC有18例,癌前病變16例;BMI值18-25kg/m2,均值(23.29±0.23)kg/m2。P>0.05可比較。患者知情、倫理委員會審批。
【納入標準】①與《腹腔鏡胃惡性腫瘤手術操作指南(2007年版)》相符[6],經胃鏡及病理檢查確診;②呈胃灼痛、反酸等癥狀;③淋巴結未轉移、未侵犯固有肌層;④病變范圍≤3cm;⑤年齡60-80歲;⑥完整資料;
【排除標準】①其他部位惡性腫瘤;②手術禁忌;③潰瘍性結腸炎;④凝血異常、免疫缺陷;⑤認知異常;⑥中途轉院。
1.2 方法
參照組(EMR術):協助完善術前檢查,待全麻后、觀察胃結構美藍染色,明確腫瘤部位及大小,腎上腺素注射于病灶基底,病灶隆起、高頻圈套器將病變黏膜切除。較大病灶則用透明帽切除,透明帽安裝在內鏡頭端,圈套器置入透明帽凹槽內,帽內對病灶吸引,圈套器切除病灶。病灶直徑>2cm,則分片切除,出血創面用氬離子凝固,送檢病變組織。
科學組(ESD術):協助患者完善術前檢查,待全麻后,內鏡探查胃部結構、病變,給予美藍染色,對病變大小、位置明確。透明帽加在內鏡頭端,插管全麻后,以內鏡明確病變實際位置、美藍染色為基點,利用氬氣刀標記距離病灶5mm位置。在標記處的黏膜下,混合靚胭脂5ml、腎上腺素1ml、0.9%濃度氯化鈉注射液100ml后完成多點注射,病灶抬舉0.8cm、沿標記用IT刀切開黏膜邊緣,病變組織剝離,IT刀剝離病灶下方黏膜,剝離時對黏膜下注射反復完成,抬舉病灶,若病灶較大,圈套器切除,剝離時有創面出血、血管裸露,IT刀電凝止血,止血鉗鉗夾血管、電凝止血,創面深,則鈦夾夾閉止血,送檢病變組織待檢。
內鏡操作由經驗較豐富的醫師執行,術后兩組常規給予抗生素。
1.3 觀察指標[7]
炎癥反應:采集兩組空腹靜脈血4ml,離心待檢,血液分析儀(深圳晶美有限公司)檢測血清抗凋亡因子(Livin)、血清表皮生長因子(EGF)及超敏C反應蛋白(hs-CRP),謹遵醫囑記錄數值。
胃黏膜萎縮程度:抽取患者空腹靜脈血3ml,按3500r/min速率取上層血清,離心待檢,酶聯免疫吸附法(ELISA)檢測胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、及PGⅠ/PGⅡ,謹遵說明書記錄數值。
手術指標:記錄手術時間、術中出血量、切除病灶面積及住院時間。
病變切除情況:統計整塊切除(內鏡下整塊切除病灶、獲得單塊標本)、完全切除(達完全切除標準,無淋巴結轉移)及基底病灶殘余(病理檢查示腫瘤病灶在原切除及周圍1cm)的例數。
并發癥:統計出現盆腔感染、術中穿孔及皮下氣腫的例數。
1.4 統計學方法
2 結果
2.1 炎癥反應
術前比較炎癥反應無差異,P>0.05;術后相較參照組,科學組Livin、EGF及hs-CRP指標更低(P<0.05),見表1。
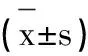
表1 炎癥反應比較
2.2 胃黏膜萎縮程度
術前比較胃黏膜萎縮程度無差異,P>0.05;術后較參照組,科學組PGⅠ指標、PGⅠ/PGⅡ比值更高,PGⅡ指標更低(P<0.05),見表2。
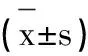
表2 胃黏膜萎縮程度比較
2.3 手術指標
相較參照組,科學組手術指標更優異(P<0.05),見表3。
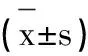
表3 手術指標比較
2.4 病變切除情況
較參照組,科學組整塊切除率、治愈性切除率高,基底病灶殘余率低(P<0.05),見表4。

表4 病變切除情況比較[(n),%]
2.5 并發癥
相較參照組,科學組(5.88%)并發癥率(23.53%)更低(x2=4.22,P<0.05)。
3 討論
早期胃癌(EGC)常在胃部發生,胃竇部及胃體部為好發部位,早期存有隱匿癥狀,難以被發現,可能出現上腹不適,疾病進入進展期,對患者生命安全造成嚴重威脅[8]。目前分析導致胃癌患病的風險是胃部慢性疾病、遺傳及不良飲食習慣,上述因素增加疾病患病率,且癌前病變也對患者生活質量造成嚴重影響,因此臨床需引起重視。有文獻報道[9],ESD術用于EGC及癌前病變治療中可行,分析:其為新型手術,IT刀切除病灶,一次性剝離病變黏膜,通常未殘留病灶,切于黏膜下層、確保剝離逐步完成,一次性切除較大組織,延伸切除范圍并提供清晰的切除視野,術中操作便捷、徹底切除病灶,具有微創、并發癥少及預后良好等優勢[10],故被廣泛用于臨床。
本研究示:①科學組Livin、EGF及hs-CRP值低于參照組(P<0.05),分析:患病后機體釋放炎癥因子、加重病情,故ESD術切除病灶組織、保留正常組織功能,減緩炎癥程度;②科學組PGⅠ、PGⅠ/PGⅡ比值高于參照組,PGⅡ值低于參照組(P<0.05),分析:上述指標對胃黏膜萎縮程度可直觀反映,ESD術可盡快恢復胃部細胞、腺體細胞,糾正胃蛋白酶原異常;③科學組手術指標優于參照組(P<0.05),分析:ESD術雖能提高病變切除率,但病灶切除廣、操作難度高等,延長手術時間,但術中出血量少、縮短療程;④科學組較參照組整塊切除率、治愈性切除率高,基底病灶殘余率低(P<0.05),分析:ESD術可提高病灶切除率,避免疾病殘余及復發、改善預后;⑤科學組較參照組并發癥率更低(P<0.05),分析:病變位置、深度及大小是引起術中穿孔的誘因,為了避免發生穿孔,ESD術前提供內鏡檢查,明確病灶侵犯深度,切除前在黏膜下充分注射,隆起病灶、促進手術順利操作,降低并發癥風險。但本研究仍有缺陷:如觀察年限短、所選病例不足及設計方案簡單等,通過對比可明確ESD術治療優勢,為縮短療程提供可靠保證,但仍無法忽視研究的偏畸性,后續建議考慮上述不足、進一步展開研究,保證治療方案的有效性、可靠性,為患者疾病康復提供可靠保障。
綜上所述,ESD術治療EGC及癌前病變患者能改善炎癥反應、減輕胃黏膜萎縮程度,將病變徹底切除、提高手術效果,減少并發癥、優勢顯著。

