經食道超聲引導經胸鑲嵌手術治療新生兒危重肺動脈瓣狹窄及閉鎖
趙婉玉,吳臣玉,李維君,鐘德琳,趙思玲,邱 紅
(云南省阜外心血管病醫院/昆明醫科大學附屬心血管病醫院 超聲科,云南 昆明 650102)
新生兒室間隔完整的危重肺動脈瓣狹窄(critical pulmonary stenosis,CPS)及危重肺動脈閉鎖(critical pulmonary atresia,CPA)為動脈導管依賴的先天性心臟病,可發生嚴重的低氧血癥及心功能不全。常規外科手術需心臟停跳及轉體外循環,對于新生兒風險較大,
X線下經皮瓣膜球囊擴張成形術存在輻射及造影劑損傷風險[1]。近年來不斷有研究探索外科雜交鑲嵌技術治療CPS/CPA[2-4],即經右室流出道插管行瓣膜球囊擴張術,已取得較好臨床效果。本研究利用經食道超聲心動圖(transesophageal echocardiography,TEE)術中全程引導監測下,實施經胸球囊肺動脈瓣成形術(transthoracic balloon pulmonary valvuloplasty,TBPV),其中共實施CPS 2例、CPA3例,總結該技術的方法學,安全性、可行性,現報告如下。
1 資料與方法
1.1 資料
自2017年8月-2022年3月連續收集云南省阜外心血管病醫院進行手術的5例CPS及CPA危重新生兒,其中男3例(60%),女2例(40%),年齡4~28(11.60±8.50)d,體重2.3~4.2(3.30±0.72)kg。5例CPS患兒均存在氧飽和度低,波動在40%~87%之間,其中2例診斷為CPS,3例診斷為CPA,5例新生兒的診斷、入院基本情況見表1。

表1 5例新生兒的診斷、入院基本情況
GPS及CPA納入標準:(1)肺動脈瓣跨瓣壓差(pressure gradient,PG)≥40 mm Hg或肺動脈閉鎖;(2)告知家屬知情同意并簽署知情同意書。排除標準:(1)肺動脈瓣下漏斗部狹窄;(2)先天性瓣下或瓣下狹窄;(3)合并需要外科手術處理的疾病[5]。
1.2 儀器與方法
1.2.1 儀器
Philips7 PQC彩色多普勒超聲診斷儀,配備新生兒食道超聲探頭S8-3t探頭,頻率1.7~10.0 mHz。
1.2.2 操作方法
常規麻醉、氣管插管,胸骨正中切口,在右室流出道縫荷包,植入動脈鞘管后,分別在以下超聲不同切面監測肺動脈瓣球囊擴張。
術前TEE檢查:采用TEE40°大動脈短軸切面,評估肺動脈瓣葉增厚情況,瓣葉活動度及反流,測量肺動脈瓣環直徑及其跨瓣壓差,評估主肺動脈及左右肺動脈發育情況、右室流出道有無梗阻,評估三尖瓣反流程度,評估左、右室功能及右室發育情況。
術中TEE監測:采用TEE40°大動脈短軸切面,監測導絲進入肺動脈,沿導絲送入球囊,選擇球囊直徑一般為肺動脈瓣環的1.2~1.5倍,定位導管的位置,即球囊中部位于肺動脈瓣口,在TEE監測下充盈球囊,擴張肺動脈瓣,評估肺動脈瓣口血流變化情況及肺動脈壓差變化,是否出現肺動脈瓣反流及三尖瓣反流,肺動脈瓣跨瓣壓差低于30 mmHg認為擴張成功,如多次擴張,肺動脈瓣壓差仍然保持在30~40 mmHg,觀察是否存在右室流出道激惹、痙攣,操作方法見圖1。
隨訪:出院后在門診復查經胸超聲心動圖,評估肺動脈瓣跨瓣壓差,瓣膜返流程度以及有無其它并發癥。
1.3 統計學方法
采用 SPSS23.0統計學軟件分析,計量資料用均數±標準差表示,計數資料以n(%)表示,組間比較采用配對t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 手術情況
3例患兒術前TEE顯示肺動脈膜性閉鎖,2例患兒術前TEE顯示肺動脈瓣增厚,測量球囊擴張前肺動脈瓣峰值壓差為81~108(94.5±13.5)mmHg,肺動脈瓣環內徑7.0~9.0(8.40±0.80)mm,三尖瓣不同程度反流,右室發育正常,均無右室流出道明顯梗阻,無肺動脈瓣反流,無主肺動脈及左右肺動脈發育不良。所有患兒均成功實施球囊擴張術,術中使用球囊直徑8.0~10.0(9.60±0.80)mm,球瓣比均為1.1~1.2,術中TEE全程實時監測,術后即刻評價肺動脈跨瓣壓差,擴張后下降至8~31(15.40±8.52)mmHg,差異有統計學意義(P<0.01)。術后肺動脈瓣反流均為少中量以內,三尖瓣反流明顯減少。1例患兒因合并壞死性小腸結腸炎家屬決定放棄治療,其余均順利出院,見表2。
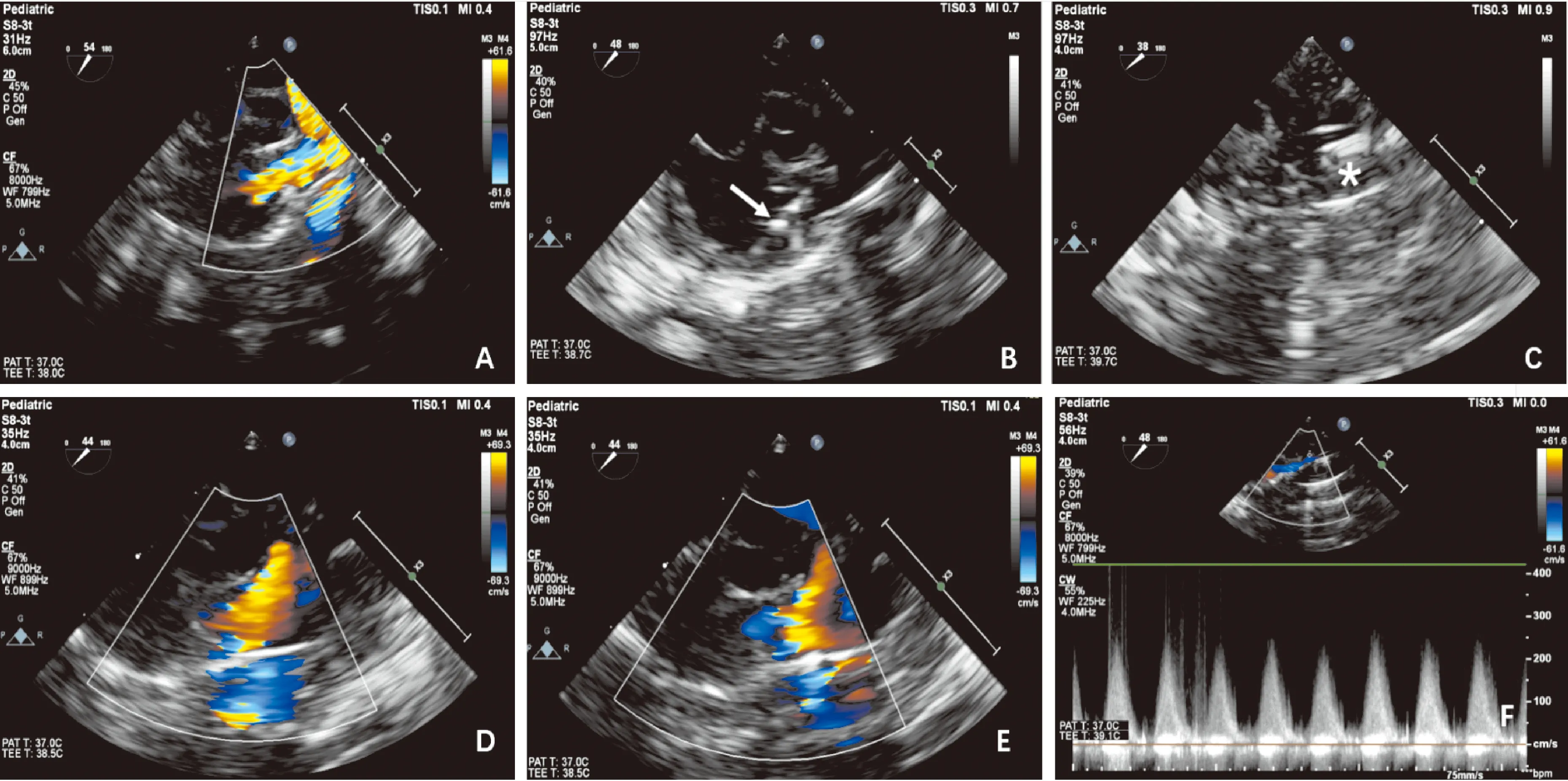
圖1 術中經食管超聲引導及評估CPS瓣膜球囊擴張
注:A:血流通過狹窄的肺動脈瓣口進入主肺動脈后呈五彩鑲嵌色;B:球囊導管通過肺動脈瓣口;C:球囊充盈;D:球囊擴張術后肺動脈前向血流通暢;E:球囊擴張術后肺動脈瓣少量反流;F:肺動脈瓣前向血流速度減低,峰值壓差減低(*球囊;→導絲)
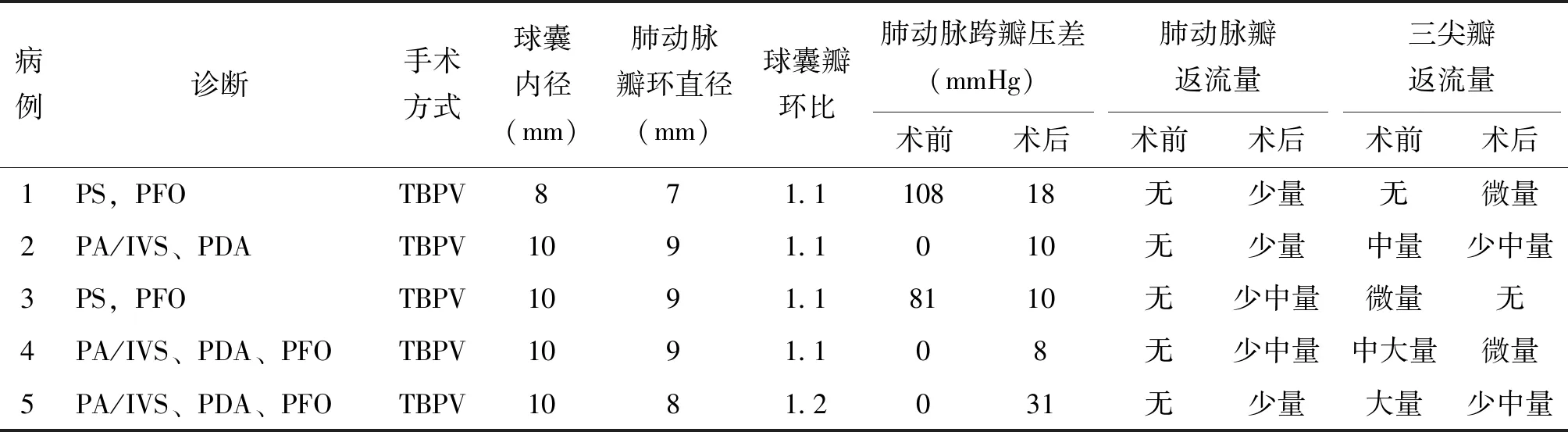
表2 5例新生兒的手術情況
2.2 隨訪情況
4例患兒均在門診隨訪,1例失訪,隨訪時間16~225(78.60±80.33)d,患兒均存活。肺動脈跨瓣壓差9~16(9.09±5.14)mmHg,仍明顯低于術前,接近術后即刻(與術前相比P<0.001,與術后即刻相比P>0.05),RV/LV橫徑由術前(0.56±0.11)增高至(0.63±0.04)(P<0.05),證明肺動脈瓣狹窄改善后促進右室發育,見表3。
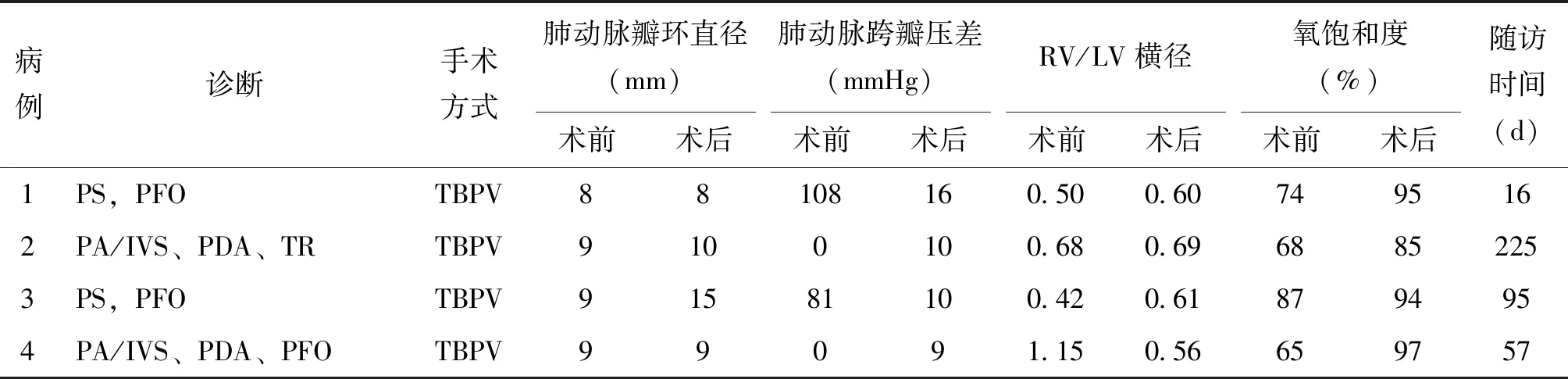
表3 4例新生兒的隨訪結果
3 討論
介入和外科治療相互鑲嵌治療模式開始應用在醫學領域[6-9]。手術實施過程中完全超聲引導監測,是一種相對安全的手術方式,尤其對新生兒更加適合。本研究完全TEE引導新生兒CPS/CPA的鑲嵌手術有效降低了肺動脈瓣跨瓣壓差,研究認為該手術是安全、有效的。
在TBPV操作中,術前TEE需評估肺動脈瓣增厚程度、瓣葉活動度及是否伴有反流。手術操作重點是多次詳細評估肺動脈瓣環大小,測量跨瓣壓差,評估右室流出道是否肥厚、梗阻,評估三尖瓣反流。其中球囊大小尺寸選擇依據超聲測量瓣環大小,多項研究認為球瓣比為1.2~1.4,此范圍即可有效擴張瓣膜,有可預防瓣膜反流[10,11]。存在明顯右室流出道肥厚及梗阻是手術的禁忌癥,尤其術中容易導致右室流出道激惹或痙攣,超聲引導中準確定位球囊中段位于瓣口中央亦是關鍵點,有文獻認為對于新生兒球囊上2/3位于瓣口,擴張球囊盡量離開右室流出道可減少流出道撕裂風險。本研究中CPS選擇的球瓣比均為1.1或1.2 手術壓差下降明顯。
手術實施過程中可實施多次球囊擴張,擴張次數以瓣口壓差降低至30 mmHg為標準[12,13],當獲得較好的壓差減少即可減少三尖瓣的反流[14,15]。本研究患兒球囊擴張次數平均2~3次,均表現手術即刻三尖瓣反流明顯減少。
超聲心動圖在經胸肺動脈瓣球囊擴張成形術治療新生兒CPS、CPA中起著重要作用,參與了術前病例評估、術中實時全程引導監測和術后療效評價。且圍術期并發癥發生率低,中期隨訪再狹窄發生率低,避免放射線危害。因此,純超聲引導下經胸肺動脈瓣球囊擴張成形術是治療新生兒CPS、CPA安全有效的方法。
由于開展樣本量少,經驗尚不足,需要擴大樣本進行進一步累計經驗及其不足。雖然如此,超聲引導雜交手術中肺動脈瓣球囊擴張對于危重新生兒具有明顯優勢,可作為瓣膜微創治療技術應用于臨床。

