黃芪甲苷通過Toll-like 受體通路對HepG2 高脂細胞脂質積累的抑制作用
楊柳 熊小平 馬國斌 李昱 胡林 丁海強 曾圣強 王洪
高脂血癥是指人體內的血脂水平過高,嚴重危害人的身體健康,可引起各種急、慢性并發癥[1]。尤其是植入心臟支架的患者,更應嚴格控制血脂水平[2,3]。近幾十年來,如何有效降脂的問題越來越受到研究者的關注。目前,在臨床常規治療中應用的降脂藥物種類較多,西藥主要有他汀類、貝特類藥物[4]以及煙酸類及其衍生物等,以及較新的前蛋白轉化酶枯草溶菌素9(PCSK9)抑制劑等[5]。與此同時,傳統中醫藥因其毒性副作用小且具有降低血脂效應已成為研究的熱點[6]。黃芪(AS-Ⅳ為黃芪提純的單體)具有益氣固表之功效。可降低心腦血管壁的壓力,減輕胰島素抵抗[7]。已被描述用于治療高脂血癥,在高脂血癥患者中具有減輕血脂代謝紊亂,保護心肌作用[8,9]。然而,關于AS-Ⅳ的降脂作用、其潛在的分子機制和相關信號通路的數據有限。
Toll-like 受體(TLRs)信號通路在高脂血癥患者中有廣泛的跨細胞膜表達[10],不易受環境因素的影響。其中Toll 樣受體2(TLR2)和TLR4 與高脂血癥有關[11],當TC 和TG 升高時,TLR2 和TLR4 基因表達上調,此外,國內報道OXLDL/Beta2GPI/ANTI-Beta2GPI 復合物可通過TLR4 途徑激活人臍靜脈內皮細胞(HUVEC),表達與動脈粥樣硬化相關的活性分子[12]。結合黃芪臨床上的作用和之前的研究結果,作者有理由猜測AS-Ⅳ通過影響TLRs 信號通路參與多靶點降低血脂的過程。黃芪作為祖國中醫藥對降脂藥物的重要補充,還有進一步研究機制的拓展空間。
HepG2 為人源性肝癌細胞系,由于其保留了與人體生物代謝相關的完整酶,能正常表達mRNA 轉錄水平和脂質代謝相關的蛋白質水平,因此在評價中藥降脂活性方面,被多項研究采用[13]。所以,體外培養的HepG2 細胞系是降脂藥物的新藥篩選和藥效評價的重要模型。基于此,本研究以該細胞模型為干預對象,研究不同濃度的AS-Ⅳ的作用從而來驗證作者的假想。
1 材料與方法
1.1 材料
1.1.1 細胞株 人肝細胞癌細胞株HepG2。
1.1.2 藥物配置 AS-Ⅳ:購自中國藥品生物制品檢定所(純度≥98%,中國北京)。配置:將其溶解在二甲基亞砜(DMSO)中,使原液濃度為2 mmol/L。
1.1.3 主要試驗儀器 細胞培養箱(Thermo Fisher Scientific,US);超凈工作臺(蘇凈安,中國);實時熒光定量PCR 儀(Applied Biosystems 7500 Fast,USA);移液槍(Eppendorf)。
1.1.4 主要試劑 Dulbecco 培養基(Gibco Life Technologies,Grand Island,NY,USA);0.25%胰蛋白酶(Gibco Life Technologies);10% 胎牛血清;油酸;DMSO(USA);RIPA 細胞裂解液;引物序列(sinotec,CHINA);QuantNva? SYBR? Green PCR Kit試劑盒(QIA-GEN,GERMANY);BCA 蛋白定量試劑盒(Themo,USA)。
1.2 方法
1.2.1 細胞培養 將HepG2 肝癌細胞株細胞在混合10%胎牛血清的低碳水化合物Iscove 改良而成的杜爾貝克培養基(USA,NY)中進行孵育,并在37℃條件下,培養基每隔一天更換一次,使用0.25%胰蛋白酶 (Gibco Life Technologies) 消化和傳代細胞。
1.2.2 脂肪堆積細胞造模(高脂細胞模型) 選用油酸最終濃度250 μmol/L 誘導HEPG2 細胞脂肪堆積,同時處理12 h,棄培養基,PBS清洗2次,每孔加入1 ml 4%多聚甲醛固定30 min,PBS 潤洗2 次,加入終質量濃度為2 mg/L 油紅O 染色40 min,PBS 潤洗3 次,置于激光共聚焦顯微鏡下觀察并拍照;每孔加入1 ml 異丙醇溶解,將孔內溶液全部轉于1.5 ml EP 管中,取1 ml 異丙醇溶液作對照,于510 nm 波長處測定吸光度,以吸光度反映脂滴含量。
1.2.3 實驗分組 隨機分為AS-Ⅳ低、中、高(0.05、0.1、0.2 mmol/L)劑量組,對照組,抑制劑組[TLR4 抑制劑TAK-242(最終濃度為1 μmol/L)],AS-Ⅳ+抑制劑組。
1.2.4 藥物干預 在96 個孔板中接種5000 個細胞/孔密度的對數生長期HEPG2 細胞,在37℃的CO2培養箱中培養。使細胞粘連在一起。在培養基中培養24 h后,在處理組中加入不同濃度的AS-Ⅳ,并在37℃下再培養細胞使用8 個重復孔。沒有使用AS-Ⅳ,而加入等量的培養基的細胞被用作每個板的對照組。
1.2.5 細胞內血脂水平測定 測定細胞內血脂水平采集細胞沉淀溶于0.3 ml PBS,超聲破裂冰浴條件下(功率300 W,5 s/次,間隔30 s,重復3 次),勻漿。制備好的細胞試樣采用酶標儀進行吸光度測定。
1.2.6 細胞增殖能力的測定方法CCK-8法使用CCK-8 細胞活力測試試劑盒(CK04;Dojindo Laboratories,Japan)測定HepG2 細胞的活力。每孔10 μl CCK-8 溶液加入到培養基中。使用光譜儀(Multiskan FC;Thermo Fisher Scientific,Germany)在450 nm 處測量吸光度值(a)。使用以下公式計算存活細胞的百分比:細胞活力(%)=(實驗孔A/對照孔A)×100%。
1.2.7 RT-PCR 檢測TLR,TRAF6 和MyD88 mRNA 等表達 ①按說明提取核糖核酸。PCR 反應系統:2×SYBR Green PCR Master Mix 10。設置內參,RNA 逆轉錄成 cDNA 在PCR 管中配制逆轉錄反應液反應體系為20 μl: RNaseFree Water 4 μl,補足20 μl,攪拌均勻,短暫離心后,放入PCR 儀中。反應條件為42℃、45 min,85℃、5 min。②進行PCR 擴增。反應條件為:94℃預變性10 min;然后94℃變性15 s,60℃退火1 min,共40 個循環。對目的基因相對表達量進行分析。③擴產產品。PCR 條帶采用Quantityone 軟件進行半定量分析,重復以上結果3 次,取平均值。設計引物見表1。
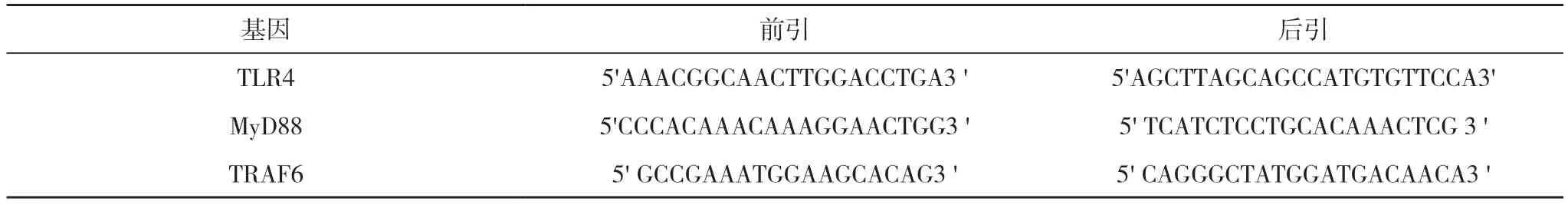
表1 引物序列
1.2.8 WB 法檢測各組TLR4、MyD88、TRAF6 等蛋白的表達 ①所得細胞PBS 洗滌2 次,再加入適量的RIPA300 μl(內加入100×PMSF),加 入RIPA后轉移到離心管,放置冰塊,提取粗蛋白;最后對蛋白濃度進行測定。之后將蛋白儲存于-80℃。取一部分蛋白,煮沸10 min,儲存于-20℃/-80℃待用。②用等量蛋白樣本(50 μg)作SDS-PAGE 凝膠電泳,封閉后,除去封閉液。③加入密閉液稀釋后的MYD88(1∶1000)、TLR4(1∶500)、TRAF6(1∶1000)、TBST 漂洗濾膜4 次,10 min/次。將HRP 標記的二抗(1∶4500)在室溫下搖晃、孵化2 h,然后用TBST 將薄膜充分洗凈,通過一臺凝膠成像裝置進行成像。作為內參蛋白的GAPDH表達、MyD88 的測定、TLR4 和TRAF6 水平的測定等用于統計分析。
1.3 統計學方法 采用SPSS21.0 統計學軟件進行統計分析。計量資料以均數±標準差()表示,采用Mann-Whitneytest。P<0.05 表示差異具有統計學意義。
2 結果
2.1 各組HepG2 細胞增殖能力比較 實驗結果顯示,AS-Ⅳ介入HEPG2 細胞的細胞增殖抑制率呈劑量依賴性,根據細胞生長抑制率作圖得到劑量反應曲線,求出AS-Ⅳ的半抑制濃度(IC50)值為2.107 mmol/L,獲得 AS-Ⅳ低、中、高給藥劑量分別為0.05、0.1、0.2 mmol/L。
2.2 AS-Ⅳ對HepG2 細胞內血脂水平的影響 AS-Ⅳ在中高劑量下,能明顯降低血脂水平。與對照組相比,AS-Ⅳ低劑量組TG、TC、LDL 水平無明顯變化,差異無統計學意義(P=0.33>0.05);TG、TC、LDL 水平在AS-Ⅳ高劑量組中顯著下降,差異具有統計學意義(P<0.05);AS-Ⅳ中劑量組TG、TC、LDL 水平顯著降低,差異具有統計學意義 (P<0.05)。見圖1。

圖1 對 HepG2 細胞內血脂水平的影響
2.3 實時熒光定量PCR 方法測定TLR4、MyD88、TRAF6 mRNA 表達檢測結果 PCR 分析結果顯示:AS-Ⅳ高、中、低劑量組,對照組,抑制劑組以及AS-Ⅳ+抑制劑組分別在1、2、3、4、5、6 泳道。用Image J 軟件分析后得出高,AS-Ⅳ中劑量組中TLR4、MyD88、TRAF6 mRNA 表達差異具有統計學意義(P<0.05),而AS-Ⅳ低劑量組和對照組差異無統計學意義(P>0.05)。提示上述mRNA 表達水平隨AS-Ⅳ干預濃度的降低而逐步提高。說明中、高劑量AS-Ⅳ干預有效,但是低劑量AS-Ⅳ干預作用不明顯。抑制劑組與對照組比較差異具有統計學意義(P<0.05);AS-Ⅳ+抑制劑組與對照組比較差異具有統計學意義(P<0.05)。提示AS-Ⅳ通過抑制相關TLR4、MyD88、TRAF6 mRNA 表達來干預血脂調節。見圖2。

圖2 實時熒光定量PCR 方法測定TLR4、MyD88、TRAF6 mRNA 表達檢測結果
2.4 WB 法測定TLR4、MyD88、TRAF6 蛋白表達檢測結果 Western blot 條帶結果分析見圖3。對照組對于Toll-like 信路相關的分子蛋白(TLR4、MyD88、TRAF-6) 均有表達,其中表達量相對較少的是MyD88。AS-Ⅳ高劑量組中相關分子蛋白的表達均顯著下降,比較差異具有統計學意義 (P<0.05)。AS-Ⅳ中劑量組中相關分子蛋白表達均顯著減低,比較差異具有統計學意義 (P<0.05)。AS-Ⅳ低劑量組與對照組的蛋白質表達比較,差異無統計學意義(P>0.05)。在Toll-like 信號通路重要節點蛋白分子的表達中,明確AS-Ⅳ能有效阻斷Toll-like 依賴信號通路相關蛋白的表達。和PCR 結果相似,AS-Ⅳ低劑量組幾乎沒有起到相應的作用。抑制劑組與對照組比較差異具有統計學意義 (P<0.05);AS-Ⅳ+抑制劑組與對照組比較差異具有統計學意義(P<0.05)。和PCR 結果類似,提示AS-Ⅳ通過抑制相關TLR4、MyD88、TRAF6 蛋白來干預血脂調節。
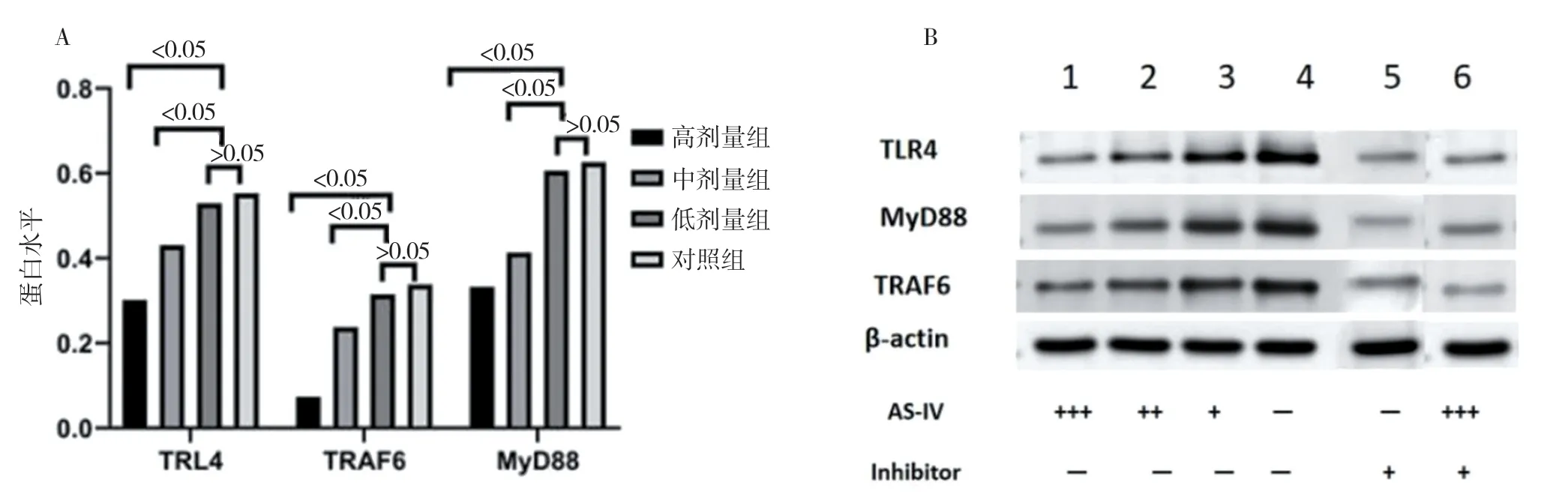
圖3 WB 法測定TLR4、MyD88、TRAF6 蛋白表達檢測結果
3 討論
高脂血癥在當今世界中對人類危害巨大,目前降血脂藥物種類繁多,中醫藥在此方面有獨特優勢,但是,大多數詳細的機制仍不清楚。中藥現代化研究的優勢是多組分、多靶點和多種藥理作用,也是關鍵問題[14]。本研究的目的即在于揭示AS-Ⅳ在HepG2 高脂細胞模型中降低血脂的作用機制。
藥理研究表明,黃芪具有降血脂、利尿等功效[15]。本研究使用HepG2 高脂細胞模型來驗證AS-Ⅳ對高脂血癥的干預作用。研究發現與對照組比較,AS-Ⅳ低劑量組TG、TC、LDL 水平無明顯統計學差異,AS-Ⅳ中、高劑量組則能顯著降低TG、TC、LDL 水平。這與很多學者應用大鼠模型研究等得出結論一致[16,17]。并且隨著分子生物學技術的發展,代謝綜合征中的TLR-4、MF-KB 等信號途徑在脂代謝紊亂中的價值也得到重視[18]。最重要的結果(圖2,圖3)提示,AS-Ⅳ高、中劑量組TLR4、MyD88、TRAF6 表達和對照組有統計學差異,低干預濃度的AS-Ⅳ和對照組沒有統計學差異。提示中、高劑量AS-Ⅳ濃度干預可降低血清中mRNA或蛋白表達的水平。這表明,AS-Ⅳ通過下調該通路中TLR4、MyD88、TRAF6 的表達而達到降低血脂的作用。這其中可能的原因有,首先,TLRs 被認為是近幾年研究顯示的一種損害誘導炎癥的主要因素。TLR2和TLR4 在各種生理和病理條件下具有共同的配體和相似的功能[19,20]。無論是細胞學實驗,還是動物研究,在胰島素抵抗和2 型糖尿病的發生和發展過程中,慢性炎癥的作用已經得到了證實[21]。Laureline 等[22]發現TLR4 缺乏預防間歇性缺氧(IH)誘發的胰島素抵抗。而眾所周知,血脂、肥胖和2 型糖尿病聯系起來,胰島素抵抗是一個樞紐,顯然,降低胰島素抵抗能有效的降低血脂[23]。
其他研究者發現,膳食中的飽和脂肪酸和棕櫚酸能夠激活TLR2 和(或)TLR4,并導致NF-κB 活化[24]。而同時TLR4-MyD88 的過度激活可能導致了更嚴重的脂肪代謝障礙,顯然抑制 TLR4-MyD88能夠逆轉過度激活。
最后,TRAF6 在細胞內屬于重要的適配蛋白TRAF 家族,具有獨特的受體結合能力。TRAF6 參與下游效應蛋白Toll/IL-1 信號級聯,TLR4/MyD88 信號通路[25]。說明抑制TRAF6,在一定程度上逐步放大抑制信號,信號通路被激活完成。
這一發現與之前的一些研究一致,即通過藥理抑制TLR4,膽固醇濃度和TG 濃度在正常小鼠血清中顯著降低[26]。另外,一些流行病學調查顯示,HMGB-1(TLR4 配體之一)可作為胰島素抵抗和肥胖的重要診斷標志物[27]。而與之對應的是,使用抗HMGB-1 中和抗體可以有效減輕肥胖小鼠的心臟損傷[28]。
此外,AS-Ⅳ低劑量組幾乎沒有發現顯著對高脂細胞模型的作用,這可能說明AS-Ⅳ在低劑量下作用不明顯。在黃芪建中湯對脾胃虛寒型胃潰瘍模型大鼠JAK2/STAT3 信號通路作用下,白敏等[29]發現了黃芪建中湯的功效,而高劑量的組分更明顯地影響了這一通路。這與作者的研究類似。這可能的原因是中,高劑量的AS-Ⅳ才能有效的抑制該通路相關基因的表達。抑制劑組與對照組相比有統計學差異;AS-Ⅳ+抑制劑組與對照組相比有統計學差異,提示AS-Ⅳ可能通過抑制相關TLR4,MyD88,TRAF6mRNA,蛋白來干預血脂調節。
總之,本次研究表明,AS-Ⅳ可以作用于Toll-like受體通路,通過下調HepG2 模型中TLR4、MyD88、TRAF6 的表達而達到降低血脂的作用。其作用可能通過抑制TLR4 和MyD88 的激活以及TRAF6 的放大作用等來降低脂肪代謝紊亂,減輕胰島素抵抗達進而達到目的(機制示意圖見圖4)。本研究重點分析AS-Ⅳ對HEPG2 高脂細胞模型Toll-Like 通路的影響,旨在對臨床高脂血癥中AS-Ⅳ的應用進行補充和提高。
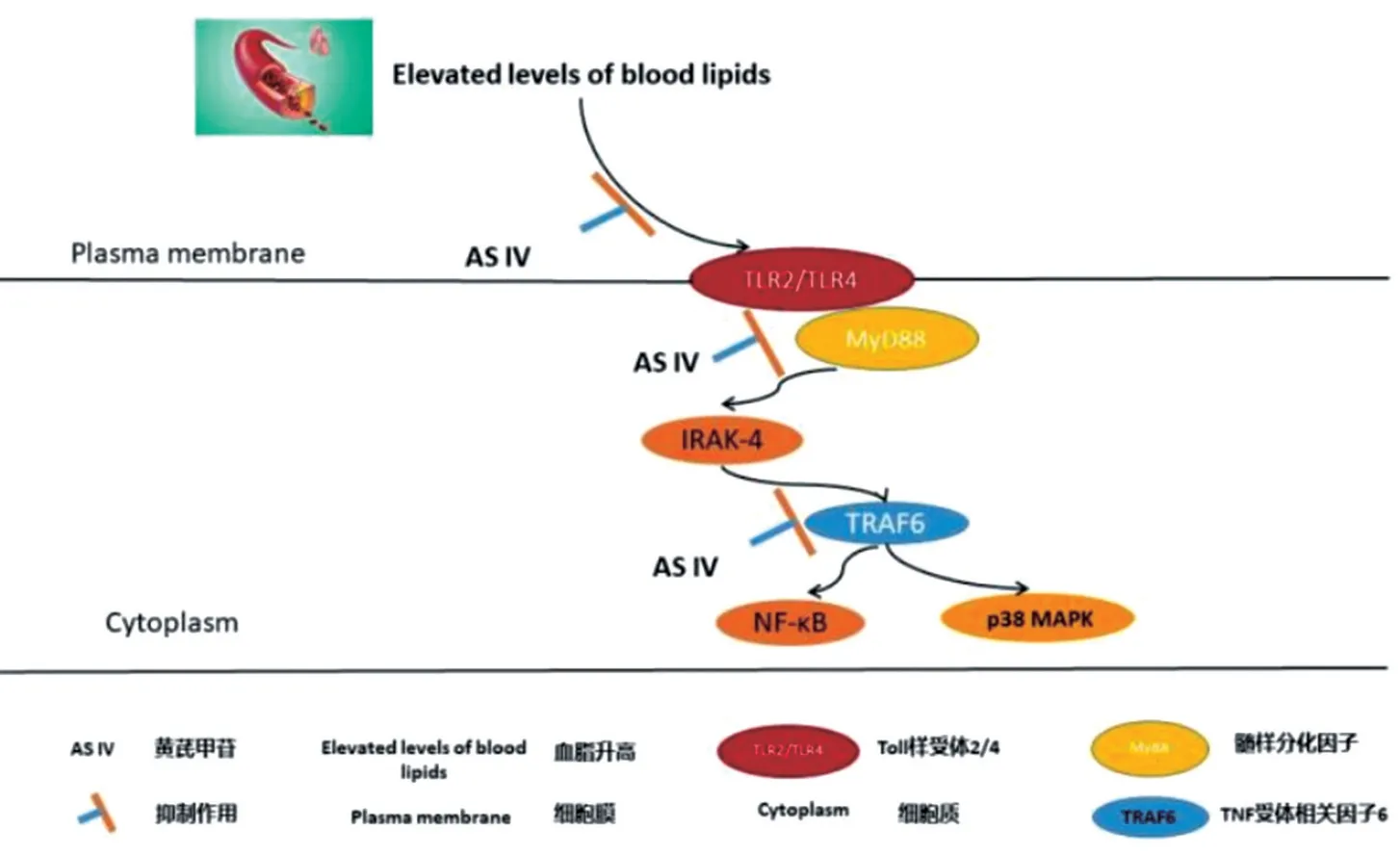
圖4 AS-Ⅳ通過Toll-like 通路下調TLR,MyD88 以及TRAF6 降低血脂的可能機制

