烏蝦醬長期發酵過程中細菌群落演替及對生物胺形成的影響
鄧義佳,王潤東,張宇昊,李學鵬,季廣仁,勵建榮,*
(1.西南大學食品科學學院,重慶 400715;2.渤海大學食品科學與工程學院,遼寧 錦州 121013;3.川渝共建特色食品重慶市重點實驗室,重慶 400715;4.錦州筆架山食品有限公司,遼寧 錦州 121007)
蝦醬又名“蝦膏”,是我國沿海地區、新加坡和馬來西亞等東南亞國家常用的調味料,以烏蝦、蜢子蝦和對蝦加工副產品為原料,添加15%~25%的食鹽自然發酵而成[1-2]。蝦醬的品質與發酵周期密切相關,隨發酵時間延長,蝦醬形態和風味逐漸優化,經過3 a以上的長期發酵,蝦醬可呈現均勻的深褐色糊狀,有醇類、醛類和酯類等風味物質形成,具有獨特口感和極佳風味[3-5]。
微生物群落是蝦醬品質提升的關鍵因素,分離菌株如乳桿菌屬(Lactobacillus)、交替假單胞菌(Pseudoalteromonas)和葡萄球菌屬(Staphylococcus)促進蛋白質分解形成呈味氨基酸,增加蝦醬鮮味[6],調節產酸細菌如腐生葡萄球菌(S. saprophyticus)、木糖葡萄球菌(S. xylosus)和格氏乳球菌(Lactococcus garvieae)相對豐度能夠抑制蝦醬腥臭和氨味形成[7]。然而,自然發酵蝦醬中微生物群落復雜多樣,通過純培養識別的微生物種類僅占實際種群總量的極少部分,且目前僅針對短期發酵蝦醬中的細菌多樣性進行探索[8-9],對于長期發酵過程中細菌群落演替規律尚不清楚。此外,發酵食品中普遍存在脫羧酶陽性菌群,它們能夠轉化食品中的游離氨基酸,降解為腐胺、尸胺、組胺、精胺和亞精胺等生物胺。消費者誤食過量的生物胺,產生頭痛、惡心和痙攣等癥狀,造成嚴重的食品安全隱患[10]。研究發現,腸球菌屬(Enterococcus)、乳桿菌屬和乳球菌屬是豆腐乳中組胺合成菌群[11],假單胞菌(Pseudomonas)、弧菌(Vibrio)和葡萄球菌與腌制海鱸魚中尸胺積累密切相關。近年來,國內外學者指出蝦醬中也存在生物胺超標問題,即使添加茶多酚等抑胺劑也無法降低其含量[12-13]。因此,闡明蝦醬長期發酵過程中細菌群落演替與生物胺的關聯、挖掘關鍵菌群成為解決蝦醬產品中生物胺超標問題的新策略。
本研究以發酵1、2、3、8 a的烏蝦醬(學名糠蝦醬)為研究對象,使用色差儀和描述性定量分析(quantitative descriptive analysis,QDA)法感官評價不同發酵階段的蝦醬品質;采用Illumina MiSeq高通量測序分析不同發酵階段蝦醬中細菌群落結構及多樣性變化規律;運用高效液相色譜(high performance liquid chromatography,HPLC)檢測蝦醬長期發酵過程中6種常見生物胺含量變化;經Pearson相關性分析探究細菌群落結構對生物胺形成的影響,識別形成生物胺的特征菌群,為精準防控長期發酵蝦醬中生物胺積累提供標靶菌群信息。
1 材料與方法
1.1 材料與試劑
烏蝦醬 遼寧省錦州筆架山食品廠。將捕撈的烏蝦修剪洗凈后放入發酵罐(陶罐高0.57 m、口徑0.50 m、質量75 kg),加入蝦體質量16%的食鹽攪拌均勻后,用草蓋封口置于室外自然發酵,溫度控制在10~30 ℃。選取發酵1、2、3、8 a的烏蝦醬各(200±10)g,并隨機從同一年份的不同發酵缸中收集3 份平行樣品,使用無菌采樣袋(230 mm×140 mm)運送至渤海大學水產品貯藏加工與安全控制實驗室,于4 ℃冷藏備用。
DNeasy PowerSoil Kit(細菌基因組DNA提取試劑盒)德國Qiagen公司;聚合酶鏈式反應(polymerase chain reaction,PCR)擴增試劑盒 生工生物工程(上海)股份有限公司;AMPure XP 核酸純化試劑盒 美國貝克曼庫爾特有限公司;腐胺(≥98.4%)、尸胺(≥98.1%)、組胺(≥98.3%)、酪胺(≥99.5%)、精胺(≥97.2%)、亞精胺(≥99.2%)、丹磺酰氯、脯氨酸、乙酸銨(均為色譜純) 美國Sigma-Aldrich公司;乙腈、甲醇、丙酮、碳酸氫鈉、氫氧化鈉(均為分析純) 遼寧省沈陽化學試劑廠。
1.2 儀器與設備
Illumina MiSeq高通量測序儀 美國Illumina公司;QIAcube HT高通量核酸純化儀 德國Qiagen公司;Biofuge Stratos冷凍高速離心機、Nanodrop 2000紫外-可見分光光度計 美國Thermo Fisher Scientific公司;FireReader XS凝膠成像系統 英國UVItec公司;Qubit 2.0熒光計 美國Life Technologies公司;GI54DS立式高壓蒸汽滅菌鍋 福建省致微(廈門)儀器有限公司;StepOne Plus實時熒光定量PCR儀 新加坡ABI公司;LC-2030高效液相色譜一體機 日本島津公司;Millipore超濾系統 美國Millipore公司;CR-10 Plus色差儀 日本Konica Minolta公司。
1.3 方法
1.3.1 蝦醬色澤測定
對不同發酵階段的蝦醬外觀拍照記錄,采用色差儀對蝦醬色澤差異進行分析。
1.3.2 蝦醬感官評價測定
采用QDA對不同發酵期的蝦醬進行感官評價。評定小組為20 名經過感官培訓后的成員,根據樣品的風味特征(蝦味、鮮味、腥味、咸味、酸味、氨氣味、發酵味)進行評分,使用10 分制評分感官強度(0 分表示沒有,10 分表示極度強烈)。
1.3.3 細菌群落結構分析
1.3.3.1 蝦醬中細菌群落總DNA提取
采用細菌基因組DNA提取試劑盒提取不同發酵階段蝦醬中細菌總DNA,隨后取50 ng DNA使用1%瓊脂糖凝膠電泳進行質量檢測,分析DNA的完整性和相對濃度。
1.3.3.2 DNA的擴增與純化
采用細菌通用引物341F/806R(341F:CCTAYGGGRBGCASCAG;806R:GGACTACNNGGGTATCTAAT)對16S rDNA V3-V4可變區片段進行PCR擴增,第1輪擴增程序為:95 ℃預變性3 min,98 ℃變性10 s,55 ℃退火30 s,69 ℃延伸30 s,共循環30 次,最后68 ℃再延伸3 min。第1輪PCR產物用AMPure XP核酸純化試劑盒純化,再用Qubit 2.0定量。第2輪擴增程序為:95 ℃預變性3 min,98 ℃變性10 s,58 ℃退火30 s,72 ℃延伸30 s,共循環15 次,最后72 ℃再延伸5 min。產物進行純化后經PCR儀定量,用Illumina MiSeq高通量測序儀測序。
1.3.3.3 測序數據分析
原始測序數據經拼接和過濾得到有效數據,然后利用FLASH v1.2.11軟件將雙末端測序得到的成對reads進行組裝,得到高變區的tags。利用USEARCH v7.0.1090軟件將組裝好的tags在97%相似度下聚類,得到物種分類的操作分類單元(operational taxonomic unit,OTU)序列,并繪制稀釋曲線和物種多樣性曲線。利用Mothur v1.31.2軟件進行主成分分析(principal component analysis,PCA)、α多樣性指數組間差異分析(t檢驗),包括ACE指數和Chao1豐度指數、Simpson指數、Shannon多樣性指數、PD_whole_tree和Observed_species指數。利用QIIME v1.80軟件中Unweighted UniFrac計算不同樣品間的β多樣性值,測定樣品間群落組成的差異性。
1.3.4 長期發酵蝦醬中生物胺測定
參照陳功等[14]的方法提取不同發酵階段蝦醬樣品中生物胺,采用內標法和HPLC測定生物胺含量,并根據儀器條件稍作改進。HPLC條件:Agilent C18色譜柱(4.6 mm×250 mm,5 μm);柱溫37 ℃;進樣量5 μL;流速1 mL/min;流動相:A為0.01 mol/L乙酸銨緩沖液-乙腈(90∶10,V/V);B為0.01 mol/L乙酸銨緩沖液;梯度洗脫程序:0~18 min,40%~0% A、60%~100% B;19~24 min,0% A、100% B;25~35 min,0%~40% A、100%~60% B。各色譜峰在254 nm波長處檢出。
1.4 數據處理
采用IBM SPSS statistic 22.0軟件進行數據差異分析,Excel 2010軟件進行線性回歸分析,Origin 2018軟件進行繪圖。細菌多樣性數據通過SPSS 22.0軟件進行單因素方差分析(P<0.05,差異顯著)。利用Pearson相關性檢驗分析標準化后變量間的相關性。
2 結果與分析
2.1 蝦醬感官特征分析
如圖1A所示,發酵1 a的蝦醬呈褐色,表觀呈不規則顆粒狀;隨發酵時間延長,蝦醬顏色逐漸變深;發酵8 a的蝦醬呈深褐色、光滑、外觀無顆粒狀。由圖1B可知,發酵1~8 a期間亮度(L*)值逐漸降低,發酵8 a樣本的L*值低至26.77;蝦醬發酵1~3 a,紅度(a*)值逐漸減小,但發酵8 a蝦醬的a*值增加;黃度(b*)值在發酵過程中呈先上升后下降趨勢,在發酵8 a達到最低。
由圖2可知,發酵1~8 a的蝦醬風味存在明顯差異。隨發酵時間延長,蝦醬的蝦味、腥味和氨氣味均降低,在發酵8 a達到最低;鮮味在發酵2 a達到最大值,隨后逐漸降低;此外,蝦醬中酸味較低、咸味較高。

圖1 不同發酵年份的蝦醬外觀(A)和色澤分析(B)Fig. 1 Appearance (A) and color parameters (B) of shrimp paste samples during fermentation
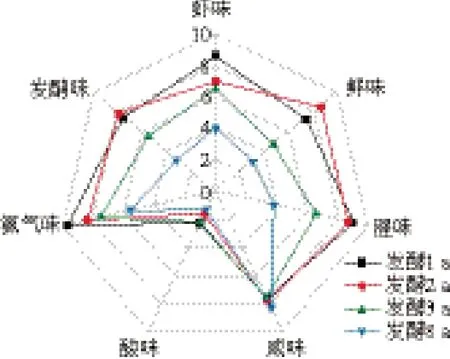
圖2 不同發酵年份的蝦醬滋味QDA雷達圖Fig. 2 QDA radar chart of the odor and taste of shrimp paste fermented for different periods
2.2 蝦醬長期發酵過程中細菌多樣性變化
2.2.1 Illumina MiSeq測序數據統計及質控分析
利用16S rRNA測序技術研究1、2、3 a和8 a發酵蝦醬細菌群落結構和多樣性變化。由圖3a可知,隨測定序列數增加,所有樣品可觀測OTU數量不斷上升;當測序深度大于25 000時,各樣品中觀測的OTU數量逐漸趨于平緩,樣本菌落覆蓋率達98.9%。由圖3b可知,不同發酵階段蝦醬樣品中細菌群落的相對豐度隨可觀測OTU數量的增加逐漸趨于穩定;當樣品的可觀測OTU數量大于200時,所有樣品的多樣性曲線趨于平滑,表明蝦醬樣品中細菌群落分布趨近均勻,群落結構無偏向性。從不同發酵階段蝦醬中測得總tag數分別為48 515±9 423、42 799±7 651、53 984±6 894和56 504±2 789,各篩選出(41 206±6 328)、(39 875±8 432)、(50 163±8 999)條和(55 132±5 172)條優化序列;各組有效序列數均遠大于測序深度閾值(25 000),4 組蝦醬樣品細菌群落覆蓋率達98.1%~99.5%,且測得的序列分別聚類于(1 502±87)、(2 008±113)、(1 611±202)、(515±19)個OTU(圖4)。
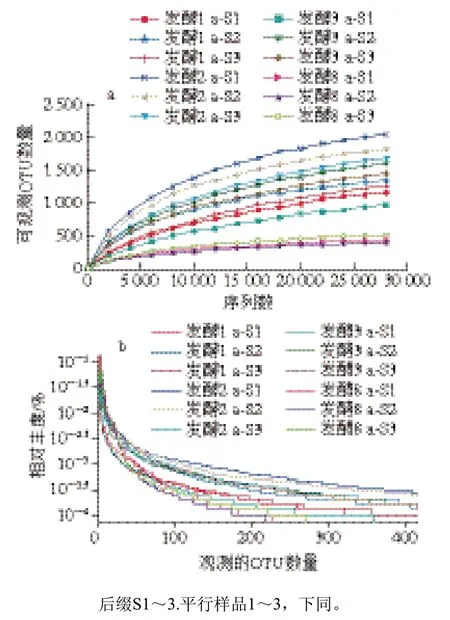
圖3 不同發酵階段蝦醬的細菌稀釋曲線(a)和多樣性曲線(b)Fig. 3 Rarefaction (a) and diversity (b) curves of bacterial communities in shrimp paste at different fermentation stages

圖4 蝦醬長期發酵過程中細菌16S rRNA測序數據統計Fig. 4 Statistical analysis of 16S rRNA sequencing data of bacteria in shrimp paste at different fermentation stages
2.2.2α多樣性分析
蝦醬樣品經α多樣性指數分析,得到組內菌群多樣性指數和豐富度指數,數據經Wilcox秩和檢驗和Tukey檢驗分析組間物種的多樣性差異。ACE指數和Chao1指數反映樣品中群落的豐富度。由圖5可知,不同發酵階段蝦醬細菌群落的ACE指數和Chao1指數變化規律一致,隨發酵時間延長,蝦醬中細菌多樣性逐漸增加,在發酵2 a時細菌多樣性最高,表明細菌群落中物種數量較多,在發酵3、8 a時菌群多樣性顯著降低。Shannon指數和Simpson指數綜合體現物種豐富度。發酵1 a蝦醬的Shannon指數和Simpson指數與其他組相比較小,表明菌群豐富度較低,發酵2 a菌群豐富度值達到最大值,隨后發酵時間延長,群落豐富度逐漸降低。此外,蝦醬樣品中Observed_species指數和進化距離的多樣性評估指數(PD_whole_tree)也與多樣性顯著相關,均在發酵2 a達到最大值,在發酵8 a時最低,表明長期發酵使蝦醬細菌群落單一化。
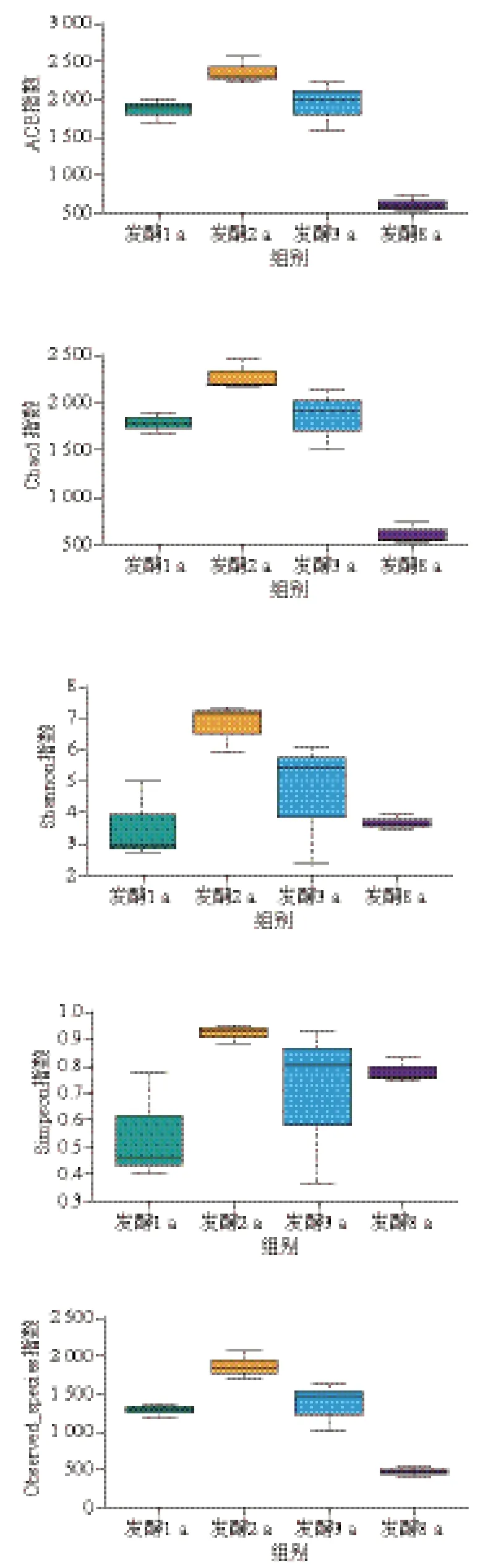

圖5 不同發酵階段蝦醬細菌α多樣性分析Fig. 5 α Diversity analysis of bacterial communities in shrimp paste at different fermentation stages
2.2.3β多樣性分析
基于Unweighted UniFrac距離衡量法進行β多樣性分析,比較不同發酵階段蝦醬細菌多樣性差異。由圖6a可知,4 個發酵階段蝦醬樣品β多樣性指數顯示,發酵1~3 a蝦醬組樣品的相異指數為0.415~0.581,表明3 組樣品間物種多樣性較小;8 a發酵組與1~3 a發酵組的相異指數范圍為0.642~0.774,說明發酵8 a蝦醬的細菌群落與中短期發酵具有顯著差異。由圖6b可知,基于對細菌屬水平聚類分析,發現1~3 a發酵組細菌種類均聚在同一分支,8 a發酵組樣品單獨聚為一類,此結果與β多樣性指數結果一致。表明蝦醬前期發酵(1~3 a)的細菌群落結構與后期發酵(8 a)的群落結構差異較大,而在1~3 a內的發酵階段,各組群落結構差異較小。這說明在前期發酵蝦醬中細菌群落結構變化較大,后期發酵時間越長,細菌群落結構趨于穩定。
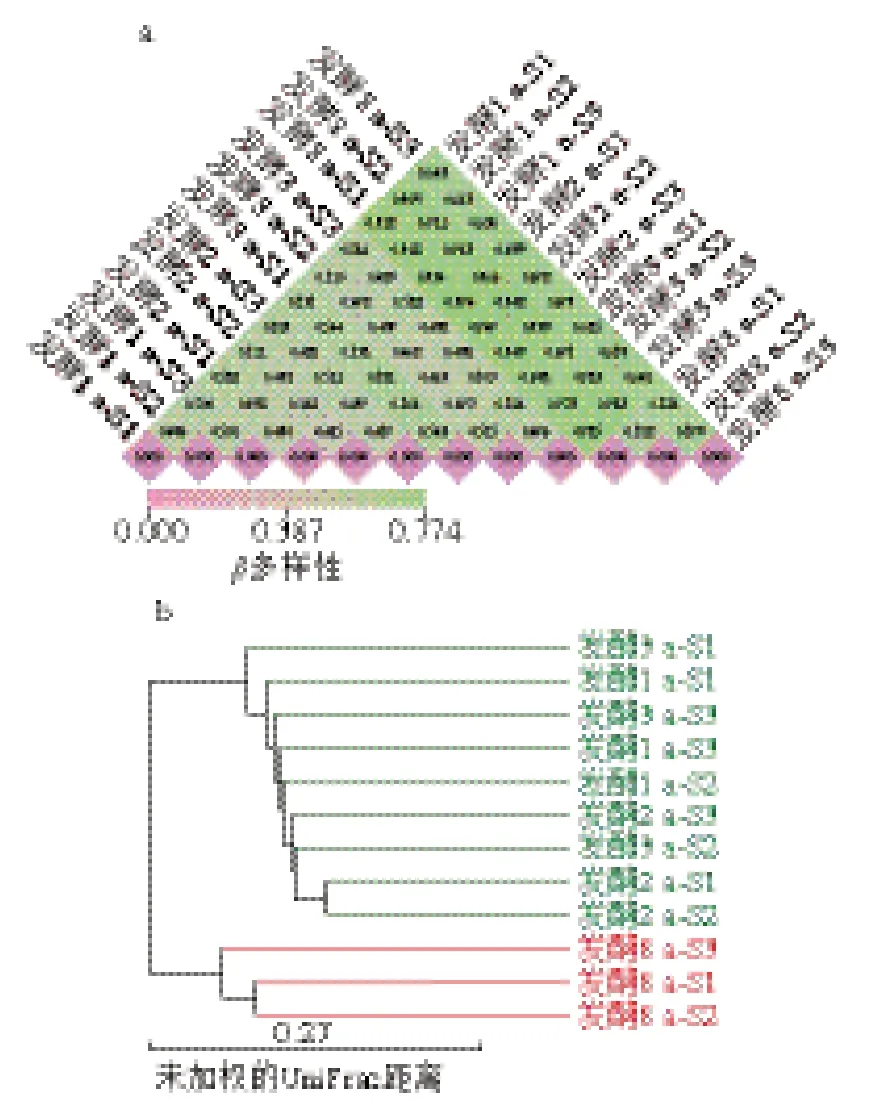
圖6 不同發酵階段蝦醬細菌β多樣性指數(a)和聚類分析(b)圖Fig. 6 β Diversity index (a) and cluster analysis (b) of bacterial communities in shrimp paste at different fermentation stages
2.2.4 Venn圖和PCA
對不同蝦醬組中測得在相似水平為97%以上所有OTU數目的相似性和重疊性進行歸類,得到組間差異Venn圖,如圖7a所示,4 個發酵階段共有的細菌種類為161 個,分別占1、2、3、8 a發酵組細菌總數的41.6%、33.5%、38.6%和69.6%,其中1、2、3 a發酵組共同含有282 個OTU,表明這3 組的細菌群落相似度較高。進一步對不同發酵階段獨有OTU數量分析可知:2 a發酵組(58 個)>3 a發酵組(43 個)>1 a發酵組(26 個)>8 a發酵組(24 個),說明發酵2 a蝦醬獨有的細菌種類最多,隨著發酵時間延長,蝦醬中細菌群落結構逐漸相似。采用PCA識別蝦醬樣品的組內和組間差異性,根據各樣品在PCA得分圖中的分布區域和距離,判定樣品間相似度。由圖7b可知,PC1和PC2對區分樣本差異的貢獻率分別為53.19%和26.85%,總貢獻率>80%,表明這兩個因素能夠較好地反映樣品中生物多樣性特征。4 個發酵階段蝦醬樣品主要分布在第1、3、4象限,其中2 a發酵組的組內平行樣本間距離較遠,表明平行樣本的細菌群落波動性大,細菌群落發生劇烈更替;而1、3、8 a發酵組的組內平行樣本間距離較近,說明樣本平行性較好,細菌群落構成相對穩定;此外,1 a和3 a發酵組的組間樣本距離較近且有重疊,說明二者細菌群落構成相似。2 a和8 a發酵組的組間樣本距離較遠,并與1 a和3 a發酵組無重疊,表明2 a和8 a發酵蝦醬菌群豐度差異顯著。
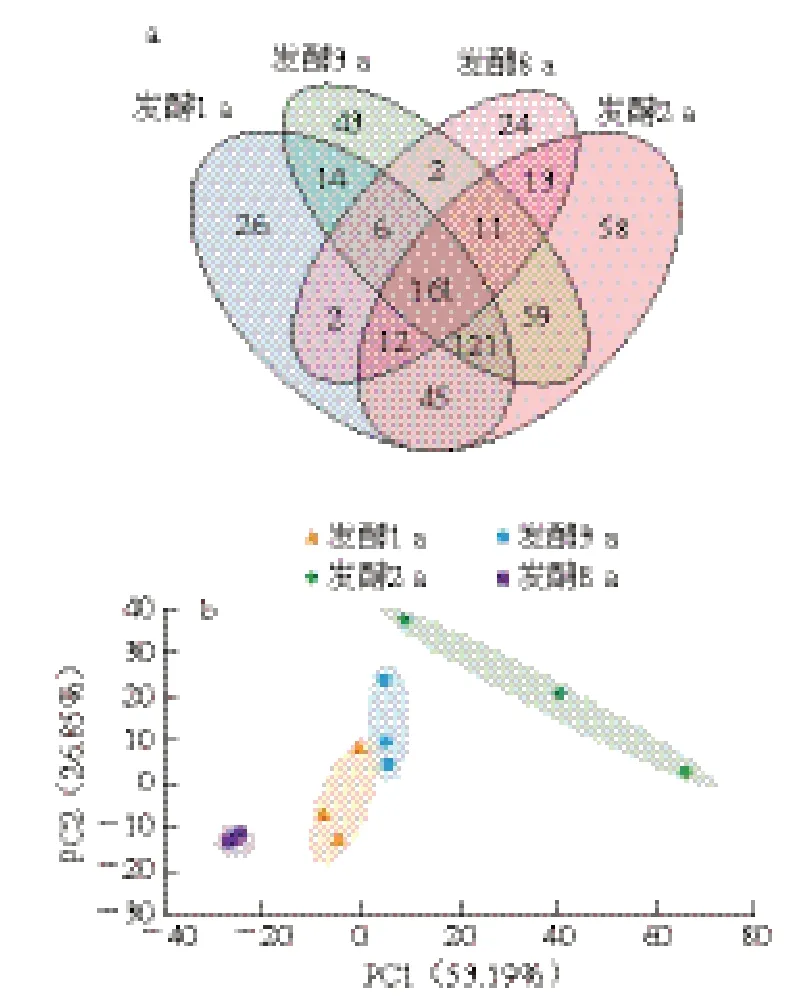
圖7 不同發酵階段蝦醬細菌群落Venn圖(a)和PCA得分圖(b)Fig. 7 Venn diagram (a) and PCA score plot (b) of bacterial communities in shrimp paste at different fermentation stages
2.3 蝦醬長期發酵過程中細菌群落的演替分析
2.3.1 門和屬水平細菌群落結構變化
由圖8a可知,在細菌群落門水平上,1 a發酵組的優勢菌群分為3 類,包括:厚壁菌門(Firmicutes,82.35%)、變形菌門(Proteobacteria,11.52%)和放線菌門(Actinobacteria,3.55%),占細菌群落總平均豐度97.37%;發酵2 a時,樣品中優勢菌群顯著增加到10 類,新增菌群為擬桿菌門(Bacteroidetes,3.08%)、酸桿菌門(Acidobacteria,1.7%)、髕骨細菌門(Patescibacteria,1.22%)、綠彎曲門(Chloroflexi,0.66%)、芽單胞菌門(Gemmatimonadetes,0.44%)、疣微菌門(Verrucomicrobia,0.4%)和裝甲菌門(Armatimonadete,0.3%),而厚壁菌門、變形菌門和放線菌門分別下降至41.11%、9.92%和2.88%;發酵3 a的蝦醬樣品中無明顯新增菌門,絕大多數菌門的相對豐度降低,僅厚壁菌門增加至59.1%;發酵8 a后,核心優勢菌門為厚壁菌門和變形菌門,分別占相對豐度的46.91%和52.42%,其他菌門的相對豐度均顯著降低。
由圖8b可知,在細菌屬水平上,共鑒定出相對豐度高于0.1%的33 個菌屬,1 a發酵組中的優勢菌屬為:四聯球菌屬(Tetragenococcus,71.7%)、嗜冷桿菌屬(Psychrobacter,2.73%)、芽孢桿菌屬(Bacillus,1.77%)、勞爾氏菌屬(Ralstonia,1.96%)、假單胞菌屬(3.62%)、龐蒂亞克桿菌屬(Pontibacter,2.61%)、鏈球菌屬(Streptococcus,2.58%)、腸球菌屬(2.55%)、嗜冷桿菌屬(Psychrobacter,1.73%)、乳桿菌屬(1.32%)、玫瑰變色菌屬(Roseovarius,1.17%)和副球菌屬(Paracoccus,0.25%)等;當蝦醬發酵2 a時,四聯球菌屬相對豐度降低為54.5%,而腸球菌屬、嗜冷桿菌屬、鏈球菌屬、假單胞菌屬相對豐度明顯上升,同時出現新優勢菌屬包括棒狀桿菌屬(Corynebacterium_1,1.66%)、擬桿菌屬(Bacteroides,0.78%)和不動桿菌屬(Acinetobacter,0.92%);發酵3 a時,四聯球菌屬相對豐度為50.56%,優勢菌屬以假單胞菌屬(4.12%)、弧菌屬(1.48%)和玫瑰變色菌屬(1.26%)為主;發酵8 a蝦醬樣品中細菌群落構成與1~3 a樣品存在明顯差異,其中四聯球菌屬相對豐度顯著降低至31.36%,假單胞菌屬和弧菌屬的相對豐度顯著增加至23.69%和8.49%。因此,不同發酵時期在屬水平下蝦醬的菌群多樣性具有顯著差異,四聯球菌屬和鏈球菌屬為蝦醬整個發酵過程的優勢菌屬。
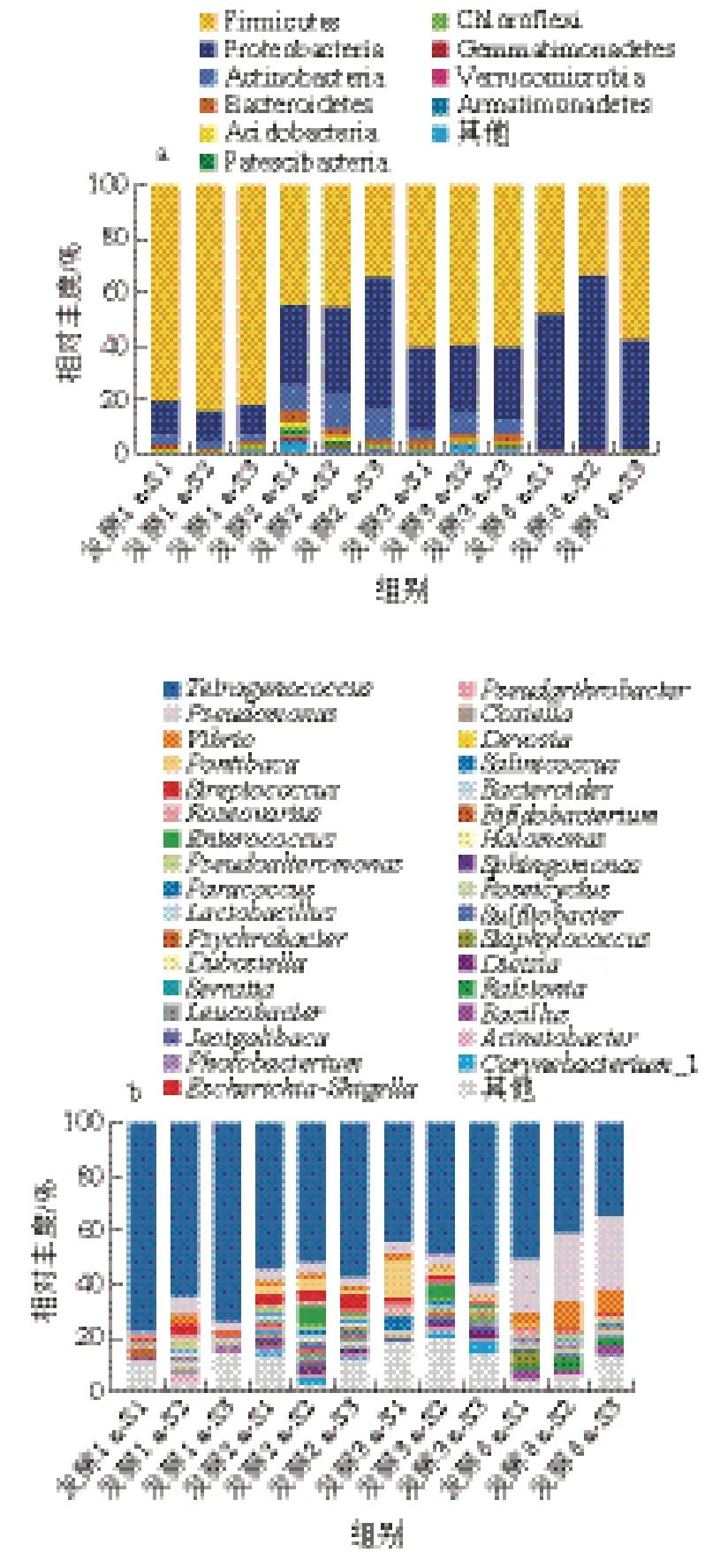
圖8 不同發酵階段蝦醬菌群在門(a)和屬(b)水平的構成圖Fig. 8 Phylum-level (a) and genus-level (b) composition of bacteria communities in shrimp paste at different fermentation stages
2.3.2種水平細菌群落多樣性分析
根據高通量測序結果在種分類水平上篩選相對豐度大于0.1%的可識別細菌群落組成,共得到14種,如表1所示,穆氏葡球菌(T. muriaticus)為發酵1 a蝦醬中的優勢菌種,相對豐度達65.81%,隨發酵期延長相對豐度整體呈降低趨勢,在發酵8 a相對豐度高度顯著降低且僅為5.48%(P<0.001)。而產藍假單胞菌(P. syncyanea)和嗜鹽四聯球菌(T. halophilus)、瓦拉尼鏈球菌(S. varani)和血光桿菌(P. sanguinicancri)在8 a發酵組中相對豐度均顯著升高(P<0.05),分別為(31.47±4.11)%、(28.49±2.34)%、(0.48±0.09)%和(0.92±0.25)%。此外,大部分豐度較高的細菌在發酵2 a的蝦醬中達到峰值,如糞腸球菌(E. faecalis)、嗜酸乳桿菌(L. acidophilus)、暹羅鹽球菌(S. siamensis)、J. dankookensis、立克次氏體(C. cheraxi)、絲狀白桿菌(L. holotrichiae),隨后隨發酵周期延長,相對豐度降低。
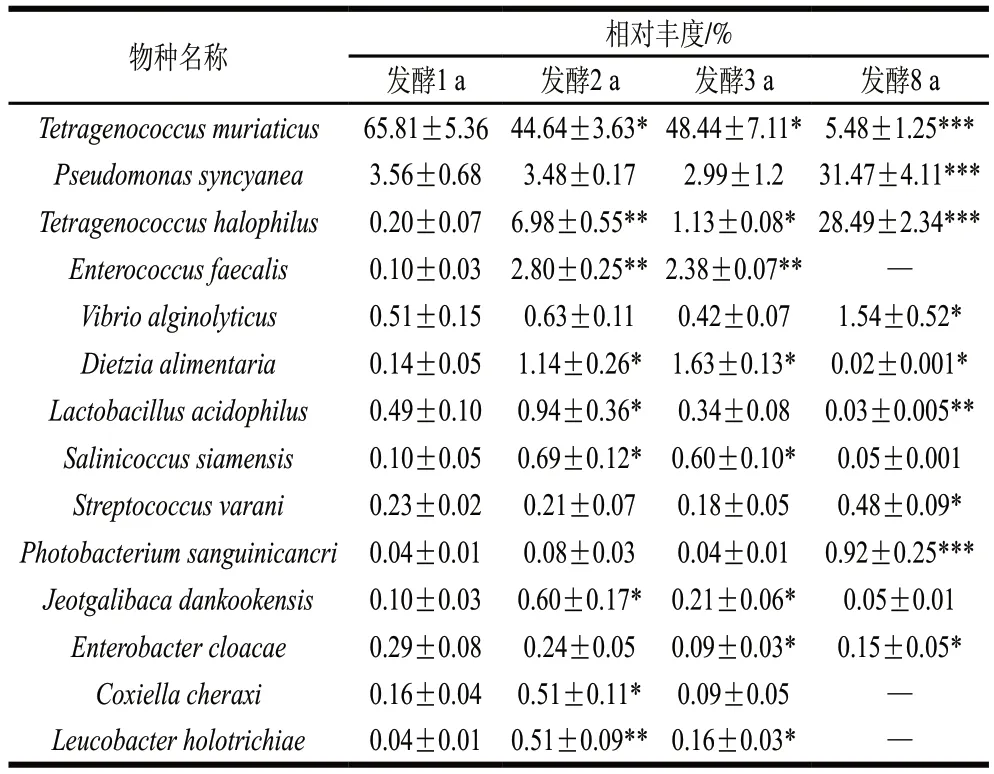
表1 不同發酵階段蝦醬種水平上相對豐度大于0.1%可識別的細菌組成Table 1 Identifiable bacterial composition with relative abundance greater than 0.1% at specie level in shrimp paste at different fermentation stages
2.4 蝦醬長期發酵過程中生物胺含量變化
2.4.1 不同發酵階段蝦醬中生物胺含量分析
6種生物胺混標經丹磺酰氯衍生后均在進樣35 min內出峰,且色譜峰峰形對稱完整、無重疊,表明洗脫程序可將生物胺較好分離。對不同發酵年份的蝦醬生物胺含量分析可得(表2),1 a發酵組僅有腐胺和尸胺;2 a和3 a發酵組檢出的生物胺種類一致,均含有腐胺、尸胺和組胺;8 a發酵組生物胺種類多達6種,包括:腐胺、尸胺、組胺、酪胺、亞精胺和精胺,說明隨著發酵時間延長,蝦醬中生物胺種類逐漸增加。腐胺在1 a發酵組中含量最低,為(1.65±0.67)mg/kg,隨發酵時間延長,腐胺含量在2~3 a發酵中顯著升高(P<0.05),在8 a發酵組中含量高度顯著提高(P<0.001),達到最高值(57.08±8.31)mg/kg;尸胺在1 a發酵組中檢出含量最高(53.13±5.83)mg/kg,在2 a和3 a發酵組中均降低,分別為(41.11±10.75)mg/kg和(43.79±8.99)mg/kg,在8 a發酵組中降低至(35.67±6.84)mg/kg;組胺在1 a發酵組中未檢出,在2、3、8 a發酵組中含量逐漸增加,在8 a發酵組中達到最大值(14.41±2.28)mg/kg;酪胺、亞精胺和精胺僅在8 a發酵組中檢出,含量分別為(11.94±1.21)、(0.88±1.37)、(0.98±0.11)mg/kg。表明除了尸胺外,其他5種生物胺含量都隨著發酵期延長而不斷積累,發酵期越長,蝦醬中總生物胺含量越高。
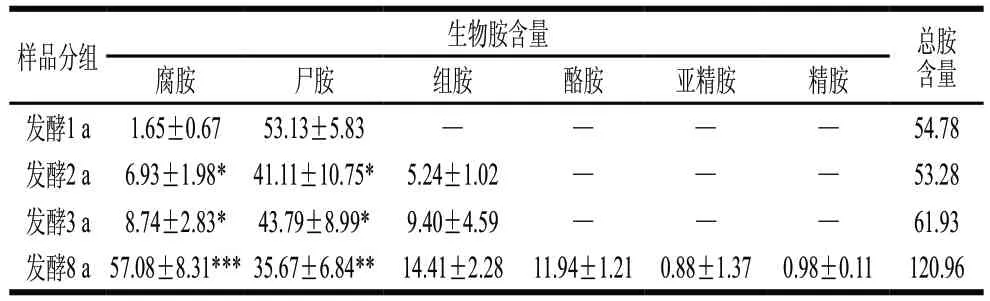
表2 不同發酵階段蝦醬的生物胺含量變化Table 2 Changes in contents of biogenic amines in shrimp paste at different fermentation stages mg/kg
2.4.2 細菌群落結構對蝦醬中生物胺形成的影響
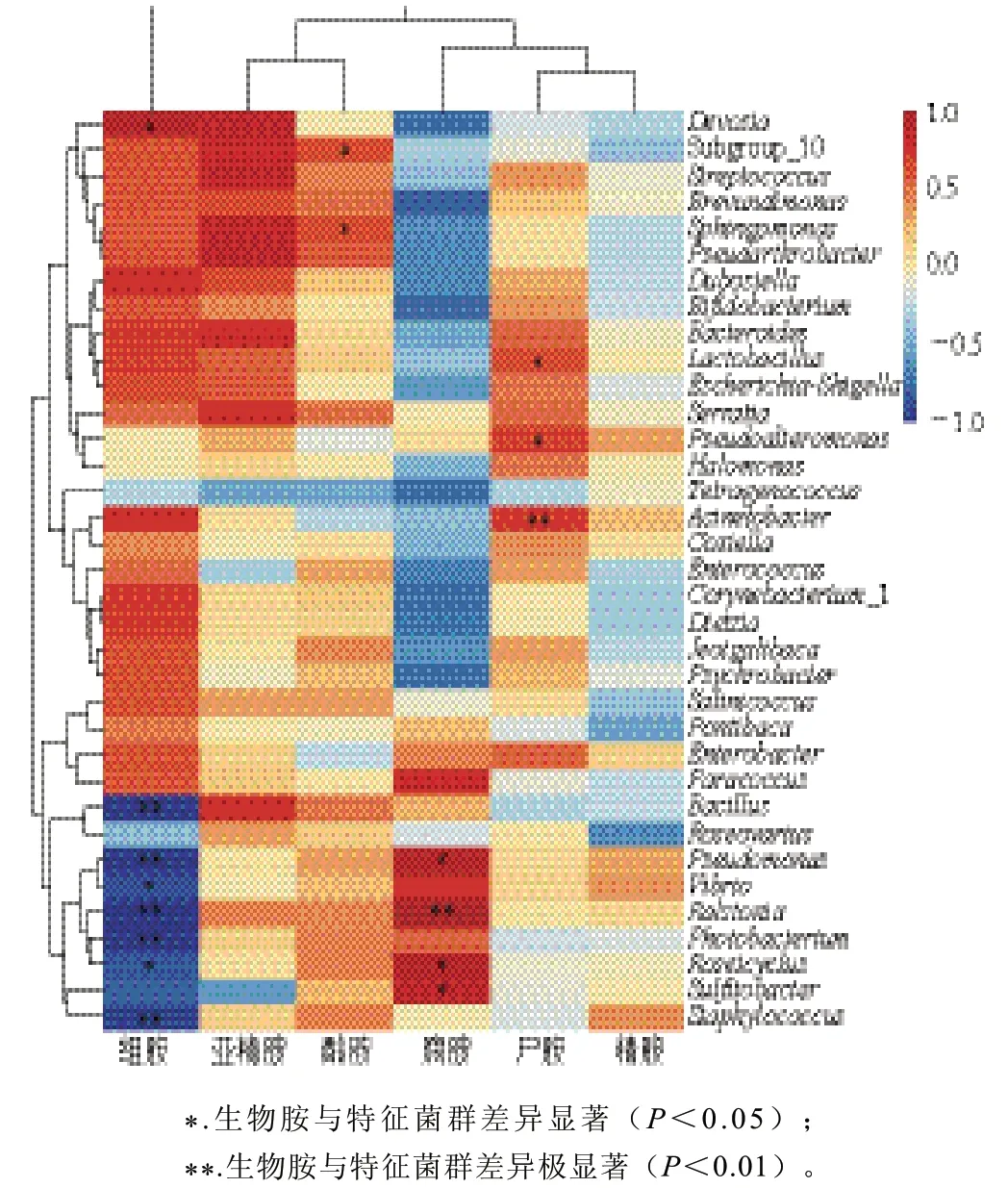
圖9 蝦醬中優勢菌群與生物胺之間的Pearson相關性分析Fig. 9 Pearson’s correlation analysis between dominant bacterial communities and biogenic amines in shrimp paste
基于Pearson相關性檢驗,對蝦醬中生物胺與細菌群落關聯度分析。由圖9可知,蝦醬中組胺、酪胺、腐胺和尸胺與發酵1~8 a階段的優勢菌群密切相關,而亞精胺和精胺與細菌群落無明顯關聯。組胺含量變化與德沃斯菌屬(Devosia)呈顯著正相關(P<0.05),與芽孢桿菌屬、勞爾氏菌屬、發光桿菌屬(Photobacterium)、葡萄球菌屬呈極顯著負相關(P<0.01);腐胺含量變化與勞爾氏菌屬呈極顯著正相關(P<0.01),與假單胞菌屬、慢生鹽場菌屬(Roseicyclus)、亞硫酸桿菌屬(Sulfitobacter)呈顯著正相關(P<0.05)。尸胺主要與不動桿菌屬呈極顯著正相關(P<0.01),與乳酸菌屬和假交替單胞菌屬呈顯著正相關(P<0.05)。酪胺含量變化主要與鞘氨醇單胞菌屬(Sphingomonas)呈顯著正相關(P<0.05)。芽孢桿菌屬、假單胞菌屬和葡萄球菌屬是發酵1 a的蝦醬優勢菌群,與組胺呈極顯著負相關(P<0.01),表明其可抑制組胺形成,因此在1 a發酵蝦醬中未檢出組胺。與酪胺、腐胺和尸胺呈顯著正相關的優勢菌群主要在2~8 a發酵的蝦醬中豐度較高,在這3種生物胺的形成上發揮重要作用。
3 討論與結論
經高通量測序發現,蝦醬在長期發酵過程中,具有較厚細胞壁、可產生內生孢子的厚壁菌門逐漸演替為優勢菌門,主要包括四聯球菌屬、葡萄球菌屬、芽孢桿菌屬、鏈球菌屬和乳桿菌屬等。也有報道指出,乳桿菌屬具有產胺酶基因,與啤酒發酵過程中的酪胺、組胺、腐胺和尸胺的產生顯著相關[15]。葡萄球菌在發酵香腸中被檢測是酪胺的主要產生菌[16]。本研究發現,蝦醬中細菌群落多樣性在發酵2 a達到峰值,隨后逐漸降低,適應性較弱的細菌群落逐漸消失,抗逆性強、嗜鹽性強和代謝能力較弱的革蘭氏陽性菌占優勢,如嗜酸乳桿菌和暹羅鹽球菌等。嗜酸乳桿菌與蝦醬尸胺增加顯著相關,在其他蝦醬發酵過程中也有報道[10],這可能與嗜酸乳桿菌具有較強的賴氨酸脫羧酶活性有關。前期發酵1~3 a的蝦醬,經PCA表明,細菌群落組成具有一定相似性,而發酵8 a的菌落結構具有特殊性,與1~3 a發酵蝦醬的共有菌群顯著降低;β多樣性顯示1~3 a發酵蝦醬聚類同一分支,而發酵8 a單獨為一分支,表明在前期發酵過程中,細菌群落演替較為頻繁,菌群無顯著差異性,長期發酵后,群落結構趨于穩定。
目前普遍認為,蝦醬發酵時長有利于風味物質形成,主要是由于部分菌屬分解蛋白質形成特殊風味,Prihantoab等[17]發現雙歧桿菌屬、片球菌屬和魏斯氏菌屬等乳酸菌,能產生丙氨酸、纈氨酸、天冬氨酸、蘇氨酸等多種氨基酸,有利于提供發酵食品的滋味,但部分乳酸菌如干酪乳桿菌和嗜酸乳桿菌具有組氨酸和酪氨酸脫羧酶,對組胺和酪胺的形成具有重要影響[18]。此外,蝦醬發酵8 a后假單胞菌屬和弧菌屬的豐度增加。假單胞菌屬是水產食品常見的腐敗菌和致病菌,相關性分析發現其與尸胺增加顯著相關。另外,假單胞菌屬和弧菌屬會分解蛋白質產生硫化氫氣味和腥臭味等不良氣味,影響蝦醬的風味和安全性[19-20]。因此,蝦醬長期發酵過程中應預防環境中腐敗菌和致病菌污染。
蝦醬由小蝦在腌制過程中增加鹽分可抑制細菌繁殖引起的腐敗,但長期存在的脫羧酶陽性菌群對氨基酸的轉化和水解,是產生尸胺、腐胺、組胺等有害生物胺的主要途徑[21]。在發酵過程中,主要存在的生物胺為尸胺和腐胺,且尸胺僅發酵1 a含量已超過我國水產品中生物胺限量標準(50 mg/kg)[22]。目前,生物胺超標一直是發酵水產品的棘手問題,Li Wenya等[23]對我國渤海灣的食品工廠發酵蝦醬調查發現總胺含量為18.20~469.02 mg/kg,尸胺和組胺嚴重超標。Ma Xinxiu等[24]調查12 個月發酵魚的產胺量,發現組胺含量高達55 mg/kg,且生物胺總量增加。蝦醬長期發酵使腐胺和尸胺生成顯著增加,且發酵8 a蝦醬中含有腐胺、尸胺、組胺、酪胺、亞精胺和精胺,可能是由于發酵期產酸微生物活躍,通過糖酵解將原料中的碳水化合物分解為磷酸、乳酸等酸性代謝物質使蝦醬pH值降低,導致大量脫羧酶陽性菌群為維持pH值的相對平衡,將部分氨基酸脫羧轉化為生物胺[25-26]。Pearson相關性分析發現,假單胞菌屬、慢生鹽場菌屬和亞硫酸桿菌屬與腐胺呈正相關;不動桿菌屬、乳酸菌屬和假單胞菌屬與尸胺呈正相關。研究發現,產胺能力較強的多為抗逆性較強的菌屬,具有較好適應環境的能力。Jan?ová等[27]調查奶業廠廢水中的葡萄球菌屬、乳球菌屬、腸球菌屬、科氏菌屬、不動桿菌屬、假單胞菌屬和腸桿菌屬等的產胺能力,發現所有菌株均表現脫羧酶基因陽性,且能產生4~8種生物胺。
針對發酵水產品中生物胺含量超標的問題,主要通過添加甘氨酸、茶多酚和姜辣素等天然活性物質,或添加微生物發酵劑降低蝦醬體系中微生物的生長繁殖和消減胺類物質[26,28],或從蝦醬中篩選分離生物胺降解菌如維吉芽孢桿菌和鹽反硝化枝芽孢桿菌等,再接種于發酵蝦醬,降低生物胺的產生[29-30]。在本研究中,穆氏葡球菌為蝦醬發酵期間細菌占比最大的優勢菌,在泰國發酵魚露[31]和日本發酵水產品[32]中也均有檢出,屬嗜鹽發酵乳酸菌。Sang Xue等[33]針對蝦醬源穆氏葡球菌進行安全性評估,發現與組胺產生無顯著相關性,且對抗生素有弱抗性、無溶血活性和不產生生物被膜,產生脂肪酶和蛋白酶,可作為蝦醬發酵期間控制組胺的潛在優勢菌株。另外,嗜鹽四聯球菌在發酵8 a豐度顯著增加,研究發現其具有較強的抗酸脅迫性和熱適應性,為水產品發酵制品中的優勢菌株[34]。Kim等[35]從發酵魚中分離出此菌,經基因組測序未發現生物胺產生相關基因,接種發酵魚可顯著抑制尸胺的生成。因此,開展蝦醬中優勢菌屬的降胺能力研究,有助于篩選潛在的功能性發酵菌株,對于功能菌種干預生物胺形成的機理,未來研究中將結合生物胺相關理化指標和菌群代謝特征進行深入探究。

