苦蕎EMS突變體庫的構建及SCoT標記篩選分析
方小梅, 楊文娟,2, 王于棟, 唐恬, 吳銀環, 陶建波, 王藝鋼, 王俊珍, 朱劍鋒, 張建, 易澤林
1. 西南大學 農學與生物科技學院/重慶市蕎麥產業體系創新團隊,重慶 400715; 2. 青島市即墨區金口鎮農業農村服務中心,山東 青島 266000; 3. 涼山彝族自治州農業科學研究院,四川 西昌 615000
苦蕎又稱韃靼蕎麥,生育期短,適應性廣,抗逆性強,自花授粉率高,是很好的填閑補荒作物,社會效益顯著[1].苦蕎營養價值很高,富含蛋白質、 維生素B和膳食纖維以及黃酮類生物活性成分,是一種潛在的“功能性食品”[2].苦蕎獨特的藥食兩用特性,使其具有重要的應用價值和開發潛力,市場需求不斷擴大.然而,由于苦蕎的產量不穩,品種退化較嚴重、 更新速度慢和品種間品質參差不齊等問題,嚴重阻礙了苦蕎的生產及發展[3].苦蕎屬于小宗作物,基礎研究開始較晚,遺傳育種研究也相對滯后[4].因此,加快苦蕎種質資源創新,挖掘與利用優良基因已經成為我國苦蕎產業研究和發展的重點[5-9].
植物的自然突變頻率很低,要想獲得足夠多有價值的突變材料,可通過人工誘變的方法來提高突變頻率,創制篩選出更多、 更有價值的突變體[10].突變體庫主要的構建方法有插入誘變、 物理誘變、 化學誘變等.化學誘變相較于其他誘變有著簡單、 經濟、 易突變、 無需遺傳轉化的特點,已成為突變體庫創建的一種重要技術手段[11].其中甲基磺酸乙酯(EMS)誘變因其誘變范圍廣、 效率高、 操作簡便、 成本低廉、 產生的染色體畸變很少、 對處理材料生物損傷小、 主要發生DNA分子上的點突變(且大多是顯性突變)、 利于篩選工作的進行等優勢而被認為是使用最廣、 效果最明顯的誘變劑[12],已在玉米[13]、 高粱[14]、 黃瓜[15]、 番茄[16]等植物上成功構建了EMS突變體庫,獲得了不同的新種質資源,大大加快了育種進程,并有助于新的等位基因鑒定和功能基因組學研究.在苦蕎育種研究方面,利用化學方法對苦蕎的誘變研究陸續有相關報道出現.溫日宇等[17]研究了不同濃度EMS對晉蕎麥4號種子發芽的影響,認為其EMS誘變的半致死百分比為1.7%,處理時間為12 h.鄧琳瓊等[18]利用EMS對貴州地方栽培苦蕎品種進行處理,對其突變體進行篩選和鑒定,獲得了葉片肥大、 早熟、 晚熟、 小粒、 矮稈和黃化6種穩定遺傳的突變體.馬名川等[19]利用EMS對苦蕎地方資源材料刺蕎進行處理,對其M2代突變體進行篩選和鑒定,獲得了抗倒、 矮稈、 籽粒多棱、 大粒等突變體,初步創建了刺蕎突變體庫.孫朝霞等[20]利用EMS誘變苦蕎品種“黑豐1號”,獲得了矮桿、 種殼開裂、 叢生枝等突變株系,并篩選出高低蘆丁突變體株系,對蘆丁合成關鍵酶基因進行了表達分析.
目標起始密碼子多態性(SCoT)分子標記是2009年由Collard等[21]新開發的一種基于翻譯起始位點而設計的新型單引物擴增反應目的基因分子標記.有研究表明,SCoT分子標記可以根據植物的性狀突變進行初步鑒定.岳慶春等[22]利用SCoT分子標記技術對經137Cs-γ射線處理“醉金香”葡萄種子得到的變異單株進行遺傳變異及多樣性分析,實現了葡萄變異材料的早期鑒定; 王俏君等[23]對經形態學觀察篩選到的彩葉芋表型突變體進行SCoT分子標記分析檢測,發現在DNA分子水平上發生了變異的4株表型突變體; 白邦琴等[24]將3種草坪草作為試驗材料進行EMS誘變后,對誘變M2代植株進行了SCoT分子標記分析,在SCoT-PCR擴增結果電泳條帶中出現了較豐富的多態性條帶,表明篩選的突變體發生了分子水平的遺傳變異.
本研究利用EMS誘變劑對苦蕎測序品種“品苦1號”進行浸種誘變處理,創建一個表型變異豐富的苦蕎突變體庫,并對M2進行形態學和SCoT分子標記的篩選和鑒定,以期豐富苦蕎基因資源,加快苦蕎遺傳育種進程,并為苦蕎品種選育及功能基因組學的研究提供優良的基礎材料.
1 試驗材料與方法
1.1 試驗材料
試驗所用材料為已完成測序的苦蕎品種“品苦1號”[25],由山西省農業科學院作物研究所提供.
1.2 苦蕎EMS誘變百分比的篩選
選取籽粒飽滿均勻的“品苦1號”種子2 400粒,每200粒種子為一組,設0,0.2%,0.6%,1.0%,共4個百分比梯度處理,每個處理3次重復.將種子清水浸種12 h后,用pH=7.0的磷酸緩沖液作為溶劑,配制百分比為0(磷酸鈉緩沖液作為對照),0.2%,0.6%,1.0%的EMS誘變液(上海麥克林生化有限公司)處理“品苦1號”苦蕎種子,并置于搖床上在通風櫥中避光處理12 h,然后以濃度為0.1 mol/L的硫代硫酸鈉為終止劑,終止誘變反應,然后用流水持續沖1 h.吸干水分晾干后,于田間進行種植.每個百分比處理種植1個小區(行長2 m,行距0.33 m),設3次重復,播種后記錄各小區播種量(S),并對田間出苗和成苗情況進行調查統計.于苦蕎的2葉期,調查出苗數(E),計算各小區出苗率(X):X=E/S×100%.于苦蕎的4葉期,調查成苗數(F),計算各小區成苗率(Y):Y=F/S×100%.
1.3 M2突變體庫的構建
選取飽滿均勻的“品苦1號”種子4 000粒,先在清水中浸種12 h,然后用篩選出的適宜百分比的EMS溶液對浸泡好的4 000粒種子進行誘變處理,以未處理的“品苦1號”為對照,于2019年3月將其播種在西南大學科研基地實驗田,每個小區(行長2 m,行距0.33 m)種200粒籽粒,對M1代植株做好田間管理,進行田間突變體及農藝性狀的調查統計,成熟后按單株收獲籽粒.于2019年9月種成M2代株行(每株行種10粒籽粒),并對定植的M2代單株進行田間突變體及農藝性狀調查統計,成熟后將定植的M2代植株按單株收獲,其余單株按株行收獲作為株系對照.誘變材料各世代田間管理均采用常規育種方式.
1.4 田間突變體性狀調查
突變體統計: 對M2代植株全生育期調查,每3~5 d進行1次田間調查,根據《蕎麥種質資源描述規范和數據標準》,觀察記載植株的葉片、 莖稈、 株高、 分枝、 株型、 籽粒、 育性、 生育期等表型性狀,篩選出各種表型突變體.在形態學調查過程中篩選出各種表型性狀變異材料,同時分類記錄各種表型變異性狀,對變異性狀進行拍照留存,并進行單株編號.于成熟期,收獲種子前測量株高(cm): 用直尺測量從地面至主莖花序頂端的距離; 一級分枝數(個): 主莖上從基部至頂端的有效分枝數; 主莖節數(個): 主莖基部至頂端的總節數.籽粒成熟單株脫粒收獲后,將籽粒置于37 ℃烘箱烘干,并去除空癟籽粒,采用萬深SC-G型種子數粒儀及千分之一天平測量單株粒數(粒)、 單株粒質量(g)、 千粒質量(g)、 籽粒面積(mm2)、 籽粒周長(mm)、 籽粒長(mm)、 籽粒寬(mm)及籽粒長寬比.最后,取3 個單株的性狀平均值作為該品種的表型值.
1.5 基因組DNA的提取
待M2代幼苗正常生長后,分別采集每株定植植株0.1 g新鮮葉片于離心管,經液氮速凍后,放入磁力打樣機(LC-DMS-H 型)(30 s,50 Hz)粉碎至粉末.參照改良后的 CTAB 法提取苦蕎種質資源的 DNA[26],采用1.0%瓊脂糖凝膠電泳進行質量檢測,并利用Nano Drop 2000儀器檢測樣本的DNA質量濃度,用已滅菌的ddH2O將DNA稀釋到50 ng/μL,-20 ℃低溫保存待用.
1.6 SCoT分子標記分析
參考Collard等[21]的方法設計并合成了36條SCoT引物,以野生型“品苦1號”DNA為模板,對36條引物進行篩選,其中26條引物可擴展出穩定性好,可重復的清晰條帶(表1).
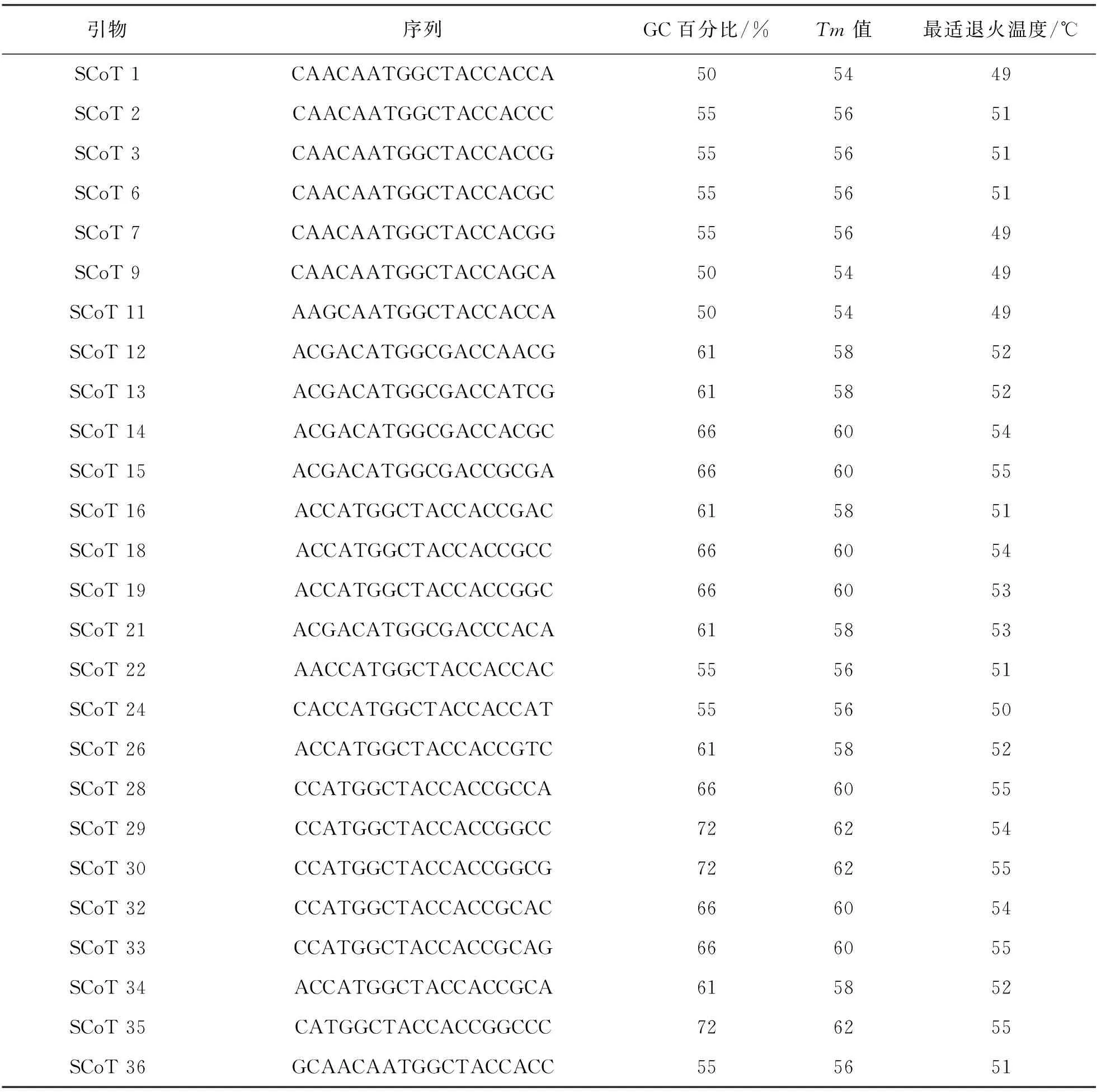
表1 SCoT分子標記引物信息
PCR總反應體系為20 μL,其中苦蕎基因組DNA 1.0 μL,引物各1.0 μL,buffer 1.0 μL,2×Taq PCR Master Mix 10 μL,ddH2O 6 μL.2×Taq PCR Master Mix購自諾唯贊生物科技有限公司.SCoT-PCR初始基本擴增程序為: 先94 ℃下預變性4 min,然后進行94 ℃變性30 s,53 ℃退火30 s,72 ℃延伸90 s,35個循環程序,最后在72 ℃下進行7 min延伸.PCR擴增產物經2.0%瓊脂糖凝膠電泳分離,于凝膠成像系統拍照保存,并根據電泳圖像讀取條帶數據,分析誘變材料與野生型之間的差異.
1.7 數據分析
利用Excel 2016統計各突變類型的突變數目及突變率,計算苦蕎植株和籽粒各主要農藝性的平均值、 最小值、 最大值、 極差、 標準差,進而計算各農藝性狀的變異系數、 遺傳多樣性指數,同時繪制相應圖表.利用SPSS 24軟件對誘變M2代的各主要農藝性狀進行相關性分析、 主成分分析、 聚類分析,并利用DPS軟件處理體系優化正交實驗的方差分析及多重比較.
電泳結果采用0/1賦值,強帶記1,弱帶反復出現記1,弱帶出現但不重復記0,無帶記0,建立引物擴增的“0/1”分子數據矩陣,利用Power Marker軟件[27]計算遺傳距離,并利用MEGA 7.0軟件[28]進行UPGMA聚類分析,利用Fig Tree軟件對聚類圖進行美化編輯.
2 結果分析
2.1 EMS誘變百分比的篩選
本研究將0,0.2%,0.6%,1.0%共4種EMS百分比梯度處理后的種子于田間播種,播種后于2葉期統計出苗率及相對出苗率,于4葉期統計成苗率及相對成苗率(表2).研究發現,經EMS處理的苦蕎品種“品苦1號”種子的田間出苗率和成苗率均隨著EMS百分比的增加而逐漸下降.其中0.6% EMS處理的“品苦1號”種子,與對照相比其相對出苗率為51.92%,相對成苗率為46.19%.在EMS誘變的研究中,一般以半致死劑量LD50作為EMS誘變處理的適宜百分比標準,半致死劑量即相對出苗率為50%時的EMS劑量,此時誘變處理產生的材料,其單堿基突變的頻率最高.經綜合分析后,本研究最終選定0.6% EMS為適宜“品苦1號”批量誘變的誘變劑量.
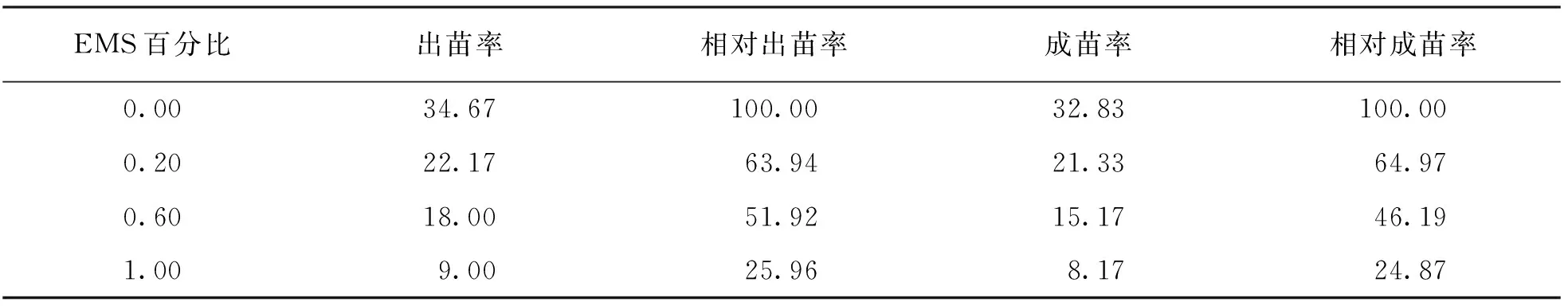
表2 EMS百分比對“品苦1號”苦蕎種子出苗的影響 %
2.2 M2代植株表型性狀變異分析
田間播種經0.6% EMS處理12 h的“品苦1號”苦蕎種子4 000粒,2葉期出苗數為1 076株,出苗率為26.90%; 4葉期成苗數為991株,成苗率為24.78%; 同年5月底收獲M1代植株971株.M1自交后單株收獲M2代965份材料.對野生型“品苦1號”和965個M2代株行進行突變調查(圖1),結果表明苦蕎品種“品苦1號”經過EMS誘變后,在M2代觀察到了豐富的表型變異突變體,且在所調查的葉片性狀、 莖稈性狀、 籽粒性狀及生育期等表型性狀中均發現了突變位點.其中,部分植株表現出兩種或兩種以上表型性狀的復合突變.共計發現486個突變位點在M2代272個單株上(366個突變植株中,復合突變植株僅計數1次),M2代表型突變頻率為28.19%.各類型突變率為葉片8.60%,莖稈11.50%,籽粒14.20%,其他類型為4.56%(表3).

圖1 M2代部分突變體
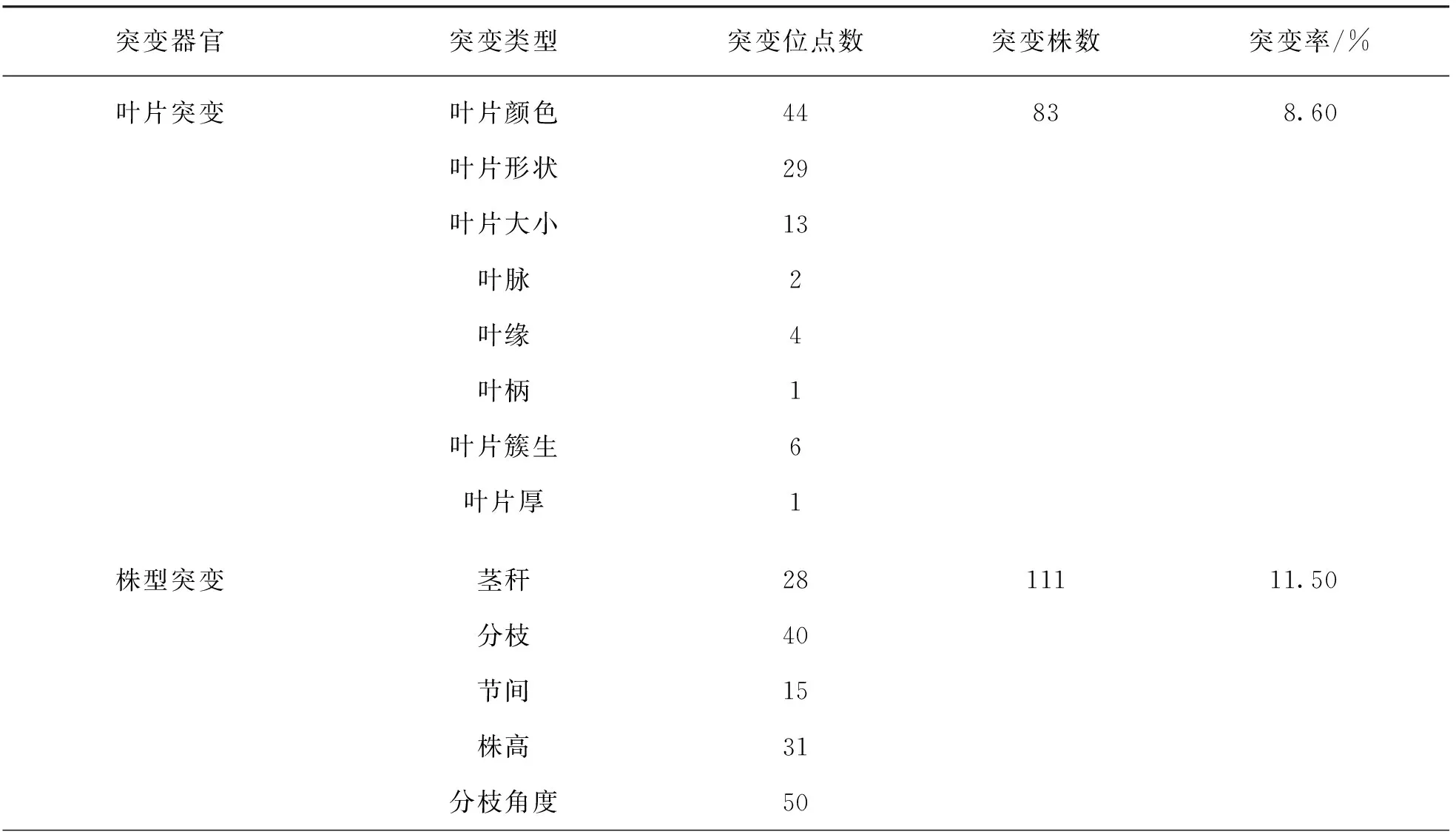
表3 誘變M2代群體各突變類型突變情況統計表
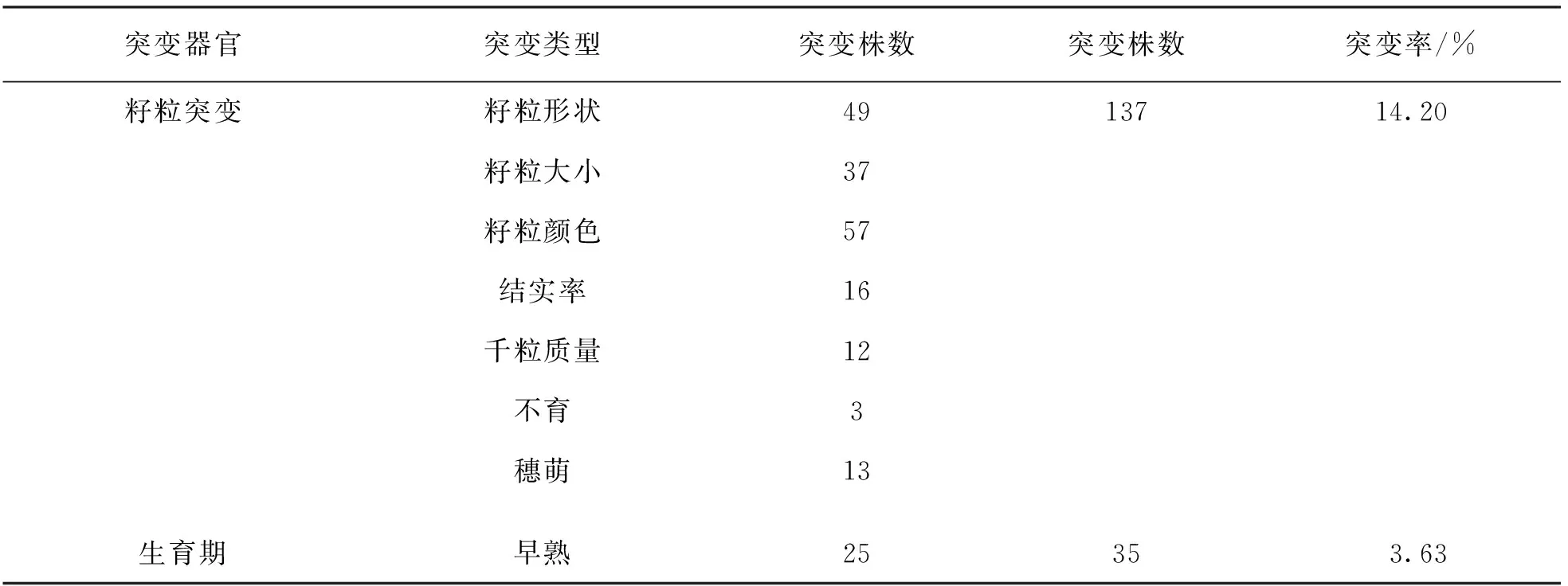
續表3
2.3 M2代主要農藝性狀的遺傳多樣性分析
本研究對“品苦1號”苦蕎誘變M2代材料和野生型對照的主要農藝性狀進行了調查測量及統計分析(表4).11個主要農藝性狀的變異系數變化范圍介于4.12%~53.88%之間,遺傳多樣性指數在1.46~2.02之間,平均值為1.87,各性狀的遺傳多樣性指數從大到小依次為單株粒質量(單株粒數)、 株高(籽粒周長)、 籽粒面積、 籽粒長、 千粒質量、 籽粒寬、 籽粒長/寬、 主莖節數、 一級分枝數,表明“品苦1號”誘變M2代苦蕎材料各主要農藝性狀之間存在較大的差異,產生了較豐富的性狀變異.

表4 誘變M2代材料主要農藝性狀表現
將誘變M2代材料的11個主要農藝性狀進行主成分分析,結果表明所有主成分構成中特征值大于1的有4個主成分(表5).其中,第1主成分的的特征值為3.433,貢獻率為31.209%; 第2主成分的特征值為3.109,貢獻率為28.262%; 第3主成分的特征值為1.935,貢獻率為17.587%; 第4主成分的特征值為1.027,貢獻率為9.333%; 前4個主成分累積貢獻率達86.391%.根據累積貢獻率大于(等于)85.00%的標準,表明本研究提取的4個主成分基本可以反映誘變M2代的11個主要農藝性狀的因子信息,可以很好地解釋表型的變異.
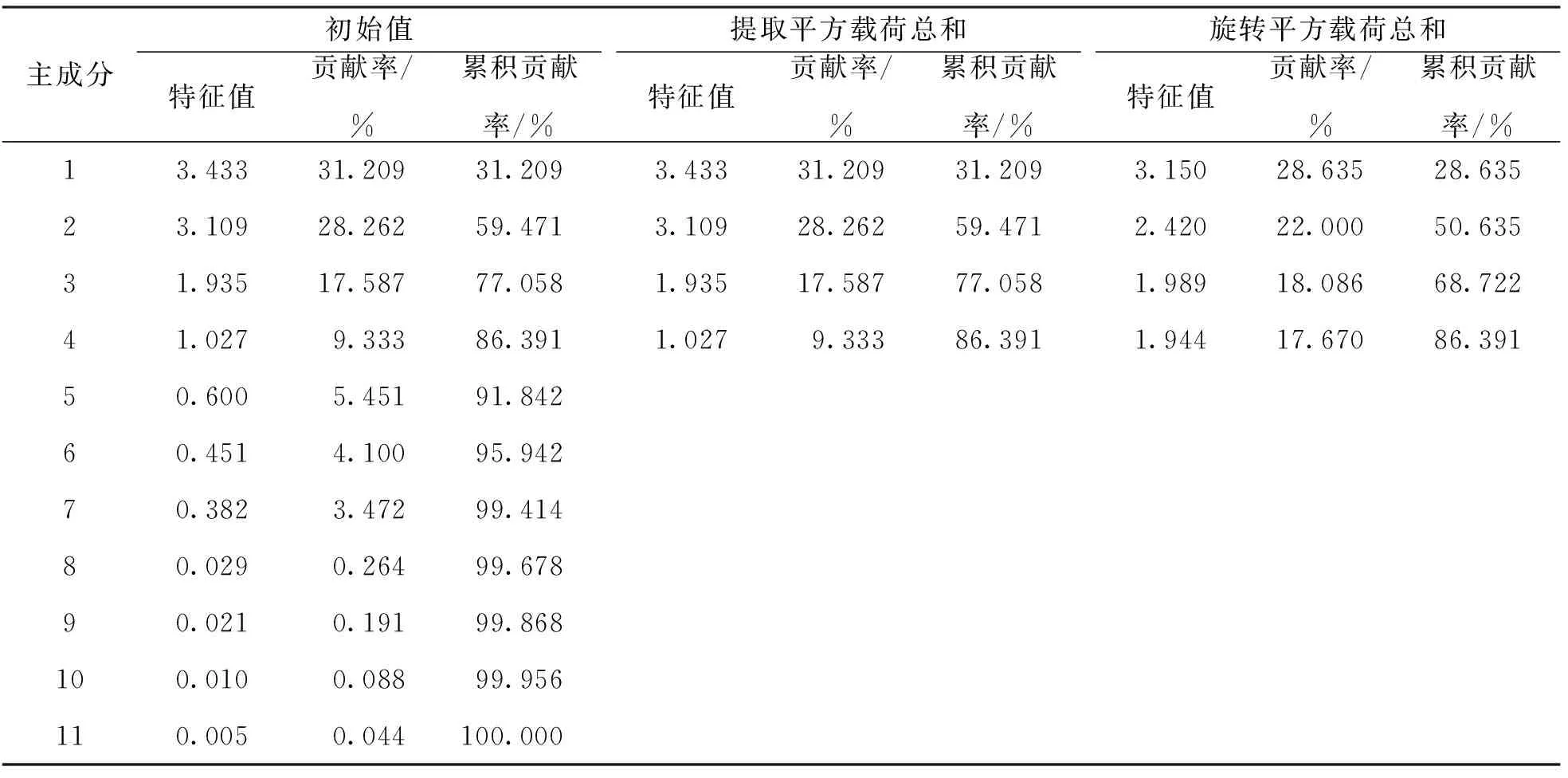
表5 誘變M2代材料主要農藝性狀主成分特征值與貢獻率
2.4 M2代的SCoT分子標記分析
利用26條SCoT引物對“品苦1號”誘變M2代群體進行PCR擴增,共得到263條清晰穩定的條帶,各SCoT引物擴增出的條帶在4~16條之間,平均為每條引物擴增出10.12條電泳條帶.對比野生型“品苦1號”和誘變M2代材料SCoT-PCR產物的電泳條帶,發現誘變M2代與野生型之間存在較豐富的條帶差異,包括條帶增加和條帶缺失,這些條帶差異證明EMS誘變方法導致苦蕎在DNA分子水平上發生了變異(圖2).
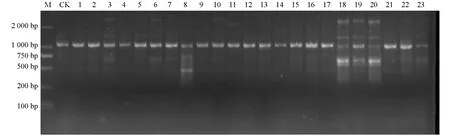
CK: 野生型“品苦1號”; 1~23: 23份M2代材料; M: 代表2 000 bp的DNA分子質量標準.圖2 部分誘變M2代材料SCoT-PCR電泳條帶
基于SCoT分子標記電泳條帶數據,將對照的野生型“品苦1號”在內的966份材料兩兩組合進行分析,共得到466 095個遺傳距離,分布在0.003 8~0.324 5之間,平均值為0.093 5,其中PKM2-148和PKM2-566間的遺傳距離最大,為0.324 5; CK和PKM2-097間的遺傳距離最小,為0.003 8.以0.015為組間距進行頻數分布分析,96.23%的遺傳距離分布在0.045~0.180之間(圖3a).965個誘變材料與對照材料“品苦1號”間的遺傳距離平均為0.056 2.其中CK和PKM2-803間的遺傳距離最大,為0.203 8; CK和PKM2-097間的遺傳距離最小,為0.003 8.
根據SCoT分子標記數據,利用非加權組平均法(UPGMA)構建聚類圖(圖3b),結果966個材料被分為4類(CI-CIV).對4個類群的農藝性狀進行統計分析(表6)發現: CI由256個材料組成,包括對照在內的256個材料間的遺傳距離在0.003 8~0.271 7之間,平均遺傳距離為0.066 9,顯著小于其他類群,植株與籽粒的主要農藝性狀均適中.CII由145個材料組成,145個材料間的遺傳距離在0.015 1~0.230 2之間,平均遺傳距離為0.088 7,主要農藝性狀中株高偏低、 單株產量較高,千粒質量偏小、 籽粒偏大偏長.CIII由210個材料組成,210個突變材料的遺傳距離在0.007 5~0.249 1之間,平均遺傳距離為0.106 7,顯著大于其他類群,主要農藝性狀中主莖節數和分枝較少、 單株產量低.CⅣ由355個突變材料組成,355個突變材料間的遺傳距離在0.007 5~0.222 6之間,平均遺傳距離為0.094 2,主要農藝性狀中株高偏高,主莖節數偏多,千粒質量偏大,籽粒較小.
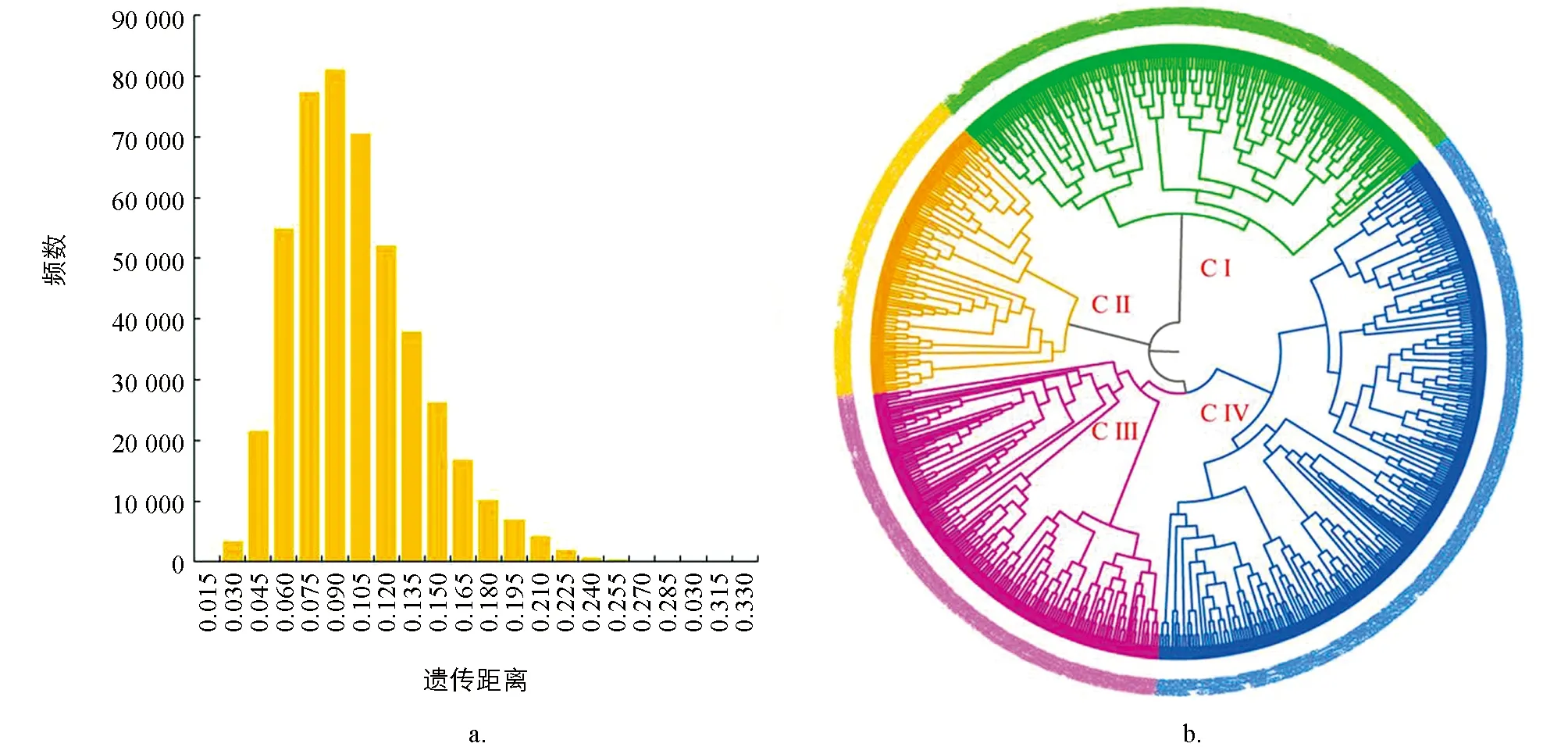
圖3 誘變M2代材料間遺傳距離的頻數(a)和聚類圖(b)
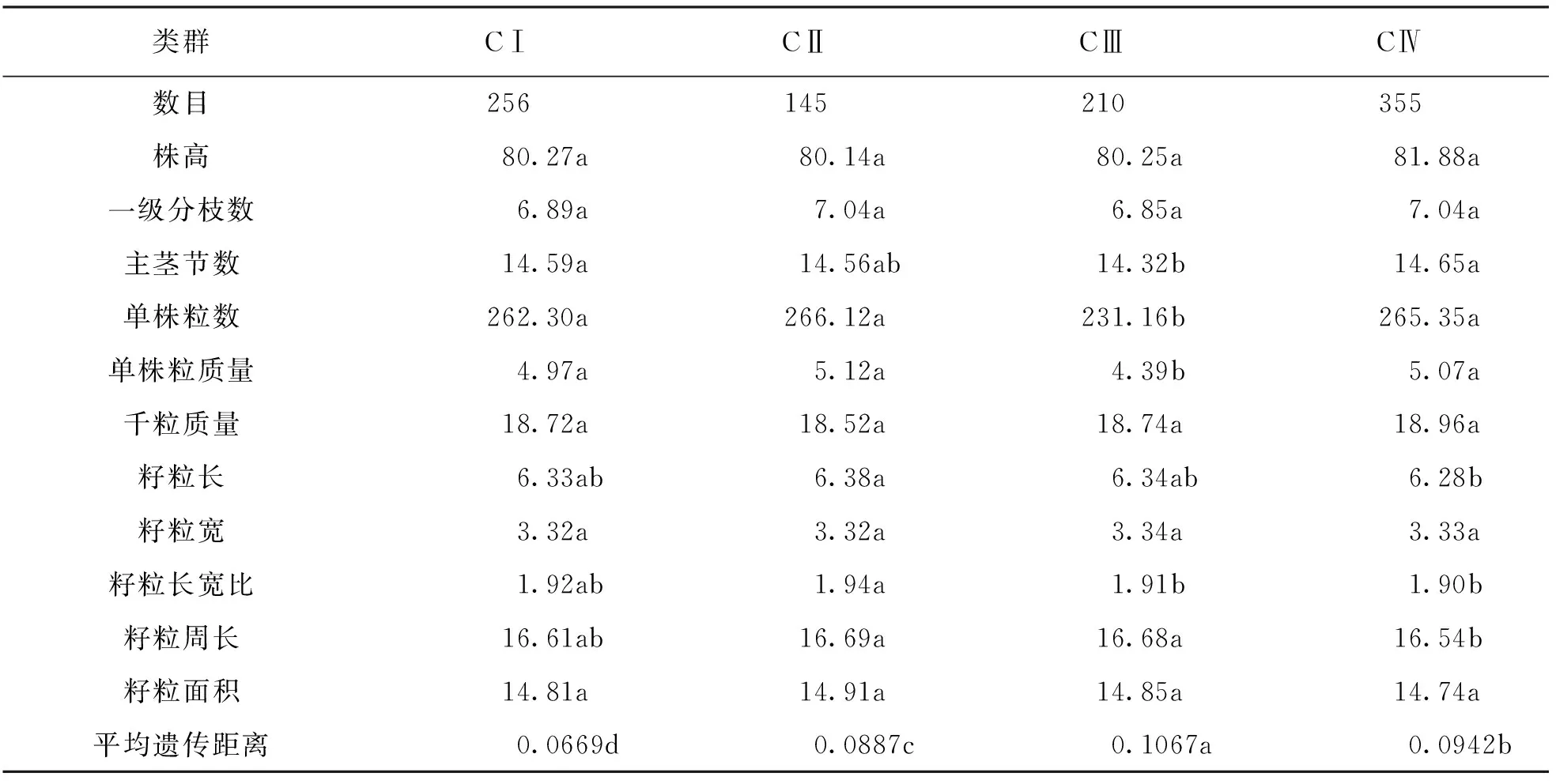
表6 誘變M2代材料基于SCoT分子標記聚類的4大類群主要農藝性狀差異
3 討論
3.1 EMS誘變百分比的篩選
EMS誘變結果具有不確定性,誘變對象不同,EMS的誘變效率也不同,而且前人研究結果表明,最佳EMS處理條件通常是接近半致死劑量的處理條件,原因是半致死劑量下的突變效率較高,獲得的突變體較多,待選群體基數適中[24].影響EMS誘變效果的主要因素是EMS百分比和誘變處理時間長短[29].溫日宇等[17]對苦蕎種子EMS誘變效應的研究結果表明,不同誘變時間的處理結果差異不顯著,且處理8 h以上才會對種子發芽率產生明顯的影響,苦蕎EMS誘變的半致死百分比為1.7%.孫朝霞等[20]的研究結果顯示,“黑豐1號”苦蕎種子的EMS誘變半致死劑量為1.2%.本研究對測序品種“品苦1號”采用0,0.2%,0.6%,1.0%共4種EMS誘變百分比對苦蕎種子進行浸種誘變處理12 h,最終選定0.6% EMS誘變百分比為最適宜的誘變劑量.本研究結果與前人研究最適誘變劑量的結論存在差異,可能是不同品種對誘變劑的敏感程度不同,亦有可能是處理后環境條件(播種地土壤、 大氣溫度和濕度等)差異所致.
3.2 EMS突變體庫的構建
誘變M2群體是突變體表型調查最為關鍵的時期[30].本研究通過對966個M2代單株進行田間突變表型調查發現,苦蕎品種“品苦1號”經過EMS誘變的M2代產生了豐富的表型變異突變體,共發現486個突變位點在M2代272個單株上,M2代表型突變頻率為28.19%.在所調查的M2代葉片性狀、 莖稈性狀、 株型及生育期等表型中均發現了突變,比馬名川等[19]、 孫朝霞等[20]在EMS誘變苦蕎研究中的突變率要高,可能原因在于: 與其他研究相比,本研究采用的苦蕎品種不同,不同品種的材料對EMS的適應程度不同,因此可能造成的突變率不同; EMS誘變百分比及誘變劑品牌不同,產生的誘變效率會有所差異; 植株生長環境不同也會導致田間表型調查的突變率不同.本研究對突變群體田間表型調查采取的是單株逐一調查的方式,單株收獲籽粒后進行了單株烤種,對籽粒表型進行了細致的鑒定,初步篩選的突變數量較多,因此突變比例也相對較高,但是在突變的穩定性上實驗室后續還會進一步地篩選和鑒定.
統計發現,在M2代苦蕎突變體庫中產生最多的突變性狀包括黃化葉片、 矮化植株、 緊湊株型、 籽粒表型等,此外還有一些突變單株存在多個變異性狀一起出現的現象,如矮化的植株節間短,株型緊湊的植株分枝多,叢生植株籽粒會比較早熟等等,這些現象的出現應證了前人提出的EMS誘變會導致基因點突變率增加,且突變的基因之間可能會存在連鎖表達效應的說法[31-32].
3.3 M2代主要農藝性狀的遺傳多樣性分析
遺傳多樣性指數是反映性狀遺傳多樣性的一個重要指標,遺傳多樣性指數越高,表明農藝性狀的多樣性越豐富.近年來,已有文獻報道了較多苦蕎株高、 分枝數、 節數、 單株產量、 籽粒表型等主要農藝性狀的遺傳變異研究[33-35].而本研究的M2代突變體主要農藝性狀遺傳多樣性指數在1.46~2.02之間,平均值為1.87,其中最高的是單株粒質量和單株粒數,說明經EMS誘變后的M2代群體間主要農藝性狀的多樣性變異豐富,包含的變異類型多,具有很高的研究價值.
聚類分析已廣泛應用于苦蕎的遺傳多樣性分析,呂丹等[36]基于農藝性狀對苦蕎資源材料進行聚類分析,將213個苦蕎種質資源分為6類,其中的高產類群可以作為苦蕎品種選育的親本材料.本研究基于11個主要農藝性狀進行聚類,將誘變M2代材料分為4大類群,方便對優良性狀進行篩選和鑒定,為苦蕎育種工作提供豐富的基礎材料,加快育種進程.
3.4 M2代的SCoT分子標記分析
SCoT分子標記與傳統DNA分子標記相比具有靈敏度高、 穩定性好、 引物設計簡單、 通用性強; DNA用量少且質量要求低、 操作簡單、 成本低廉、 遺傳信息豐富、 條帶的多態性高等優點[37].本研究以誘變M2代與野生型“品苦1號”為PCR擴增的DNA模板,進行SCoT-PCR擴增,發現誘變M2代與野生型之間存在條帶差異,包括條帶增加和條帶缺失,這些條帶差異證明EMS誘變方法導致苦蕎在DNA分子水平上發生了變異,與王俏君[23]的研究結論相似,但各突變株變異位點的堿基序列信息、 突變性狀能否穩定遺傳等問題還需后續進一步地研究.
將基于M2代農藝性狀的聚類結果與基于M2代SCoT分子標記的聚類結果進行對比分析,發現誘變苦蕎品種“品苦1號”的誘變M2代在兩種不同方式下的聚類結果有所不同,雖然兩種方式都聚成了4個類群,但每個類群在綜合農藝性狀變現過程中有所不同,且每個類群的材料分布也不盡相同.兩種聚類方式結果有所差異的現象也出現在其他許多植物的研究中[38-40],造成這些差異的主要原因是農藝性狀聚類的作用是揭示植株表型性狀的差異,而基于SCoT分子標記的聚類結果揭示的主要是M2代材料在DNA分子水平上的差異.同時,兩種聚類方式無論是性狀測量,還是電泳條帶讀取在數據統計時都存在統計人員主觀因素及儀器設備誤差的影響.因此,將農藝性狀分析與分子標記分析結果相結合,在突變體研究工作中可以根據既定目標進行綜合篩選和分析,有利于提高突變體鑒定和篩選的效率和準確性,同時也說明將分子標記技術與常規育種手段有機地結合起來,能有效縮短育種年限,加快作物育種進程.
4 結論
EMS誘變百分比梯度試驗結果表明“品苦1號”在重慶最適宜的EMS誘變百分比為0.6%; M2代966個株系產生了豐富的表型變異突變體; 主成分分析得到包括籽粒大小因子、 籽粒形狀因子、 植株產量因子、 植株表型因子的4大主成分因子; 基于SCoT分子標記的UPGMA聚類分析將966個材料分為4大類,SCoT-PCR擴增結果表明EMS誘變導致苦蕎在DNA分子水平上發生了變異.該突變體庫的構建及初步篩選分析,將為苦蕎功能基因組學研究和分子育種提供表型多樣的種質資源.

