雙特異性抗體在抗人類免疫缺陷病毒方面的研究進展
劉廣文,秦嘉萍,顧匯權,劉嬙
艾滋病(acquired immunodeficiency syndrome,AIDS)是威脅人類健康的重大傳染病之一。經典的抗逆轉錄病毒藥物治療(antiretroviral therapy,ART)[1]能夠極好地抑制感染,但它們無法清除人類免疫缺陷病毒(HIV),且存在耐藥性。單克隆抗體(mAb)具有高度特異性,是預防感染性疾病最有效的方法,由于其廣度的有限性,需使用mAb組合療法[2-4]。雙特異性抗體是在mAb的基礎上,對其進行有目的的加工而獲得的工程抗體,具有非常強的抗HIV活性[5-6]。本文綜述了近期國內外文獻中有關靶向不同抗原表位HIV雙特異性抗體研究的報道,以期為更深入的研究提供參考。
1 雙特異性抗體的分子結構
雙特異性抗體可大致劃分為兩種分子形式:含有Fc區的IgG類和不含Fc區的非IgG類[7]。IgG類雙特異性抗體,有兩個Fab區和一個Fc區,相對分子質量較大(>100 000 kD),具有較長的半衰期[8],穩定性更高。非IgG類的雙特異性抗體,由兩個抗體的VL區和VH區組成,沒有Fc區,有些也會由Fab片段組成,分子量(30~50 kD)小于整個IgG(150 kD),有助于穿透組織。但由于腎臟清除速率快,導致半衰期短,需要持續輸送用于延長作用時間[9-10]。
在抗病毒免疫治療中,與傳統單抗的組合治療不同,雙特異性抗體能夠同時靶向兩個甚至多個靶點,治療效果更好。目前雙特異性抗體分子結構正在不斷創新,越來越多的新結構被設計出來,為多價抗體的設計提供了基礎的技術平臺。
2 抗HIV雙特異性抗體
雙特異性抗體主要基于病毒和宿主細胞上特定的抗原表位,通過結構修飾而得到的[11-13],雙特異性抗體在抗癌及抗炎領域已取得了巨大進步,如今已開始探索將其應用到抗HIV領域[14],針對不同靶向的雙特異性抗體如表1所示。
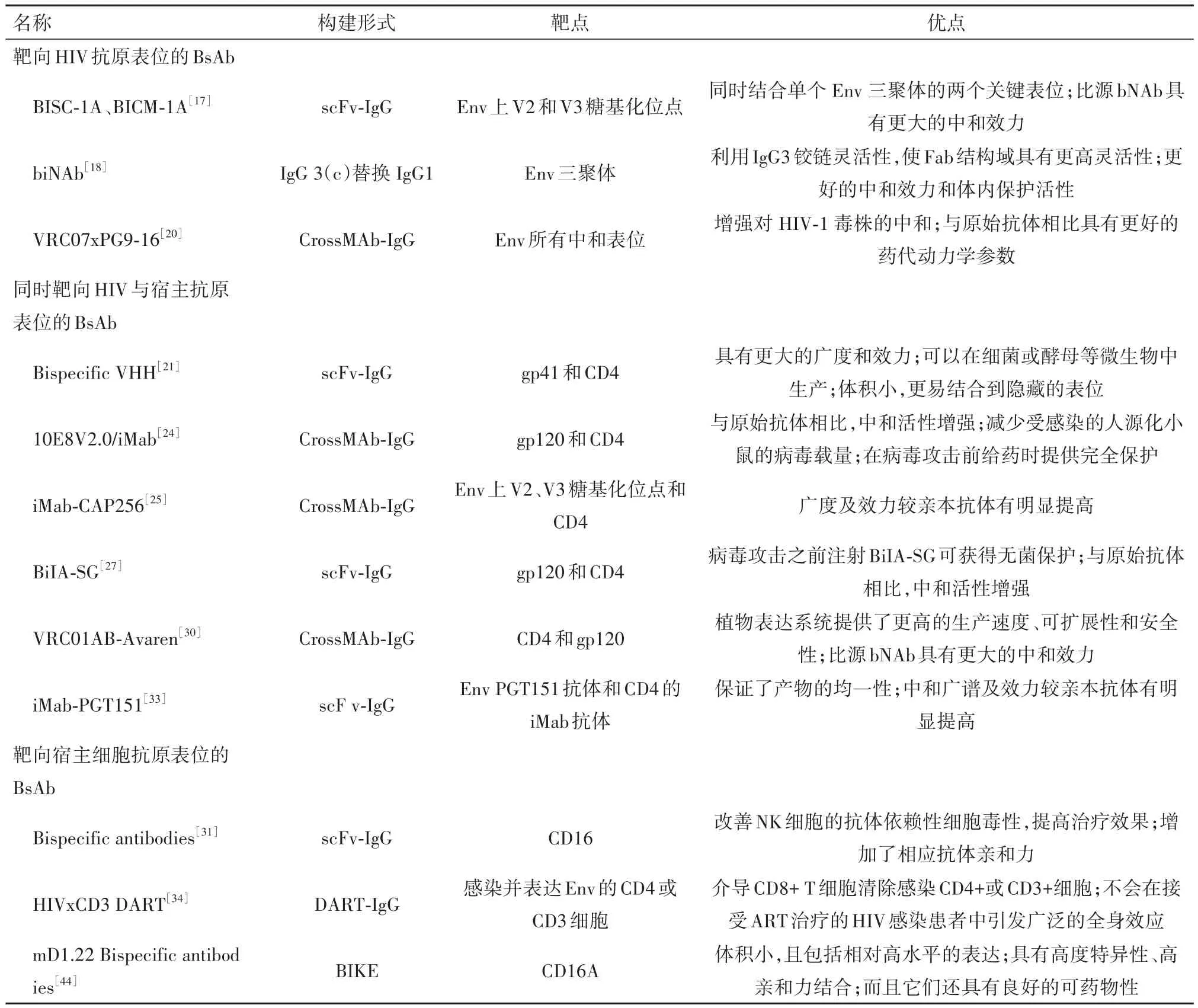
表1 處于研發階段的抗HIV雙特異性抗體
2.1 靶向HIV抗原表位的BsAb該種類型的抗體主要靶向HIV上的抗原表位,在源頭上抑制病毒的功能[15-16]。基于此,Davis-Gardner等[17]報道了基于HIV包膜蛋白(Env)上V2和V3糖基化位點設計的雙特異性抗體,具體來說,在一個抗體臂上帶有單鏈(scFv)形式的CAP256.VRC26.25 V2糖基化位點抗體,在另一個抗體臂上帶有完整的Fa形式的10-1074 V3糖基化位點抗體,另外在Fc區域引入了KIH結構,得到了BISC-1A和BICM-1A, BISC-1A是由CAP256.VRC26.25單鏈和10-1074組成的雙特異性抗體,而BICM-1A是由CAP256.VRC26.25和10-1074完整單抗組成cross-Mab結構的雙特異性抗體。這兩種組合都能更有效地中和分離株,可能是因為它們同時與Env的頂點和V3-聚糖表位結合顯著增加雙特異性抗體的效力。數據顯示,BISC-1A比BICM-1A具有更好的親和力,推測與完整的Fab結構域相比,CAP256.VRC26.25的單鏈抗體Fc形式可能更好地將雙特異性抗體的Fc結構域定位在V3糖基化位點附近。
Bournazos等[18]開發了一種新的抗HIV雙特異性抗體,這種抗體的IgG區改造為IgG3亞型(IgG3C),同時保留IgG1 Fc的功能特性[19]。體外實驗表明,IgG區結構與抗體的中和能力有著密切的聯系,未經過IgG區改造的雙特異性抗體中和能力相比單抗未有明顯提升,表明IgG1亞型的雙特異性抗體與傳統的單抗相比沒有優勢。推測可能由于兩個Fab臂缺乏足夠的靈活性,無法實現Env三聚體的異二價相互作用。而將IgG區改造為IgG3C的雙特異性抗體,由于兩個Fab臂的長度增加,其韌性和靈活度也增加了,同時加強了Env三聚體的異二價相互作用,這種方法對整體IgG結構的改變最小,也顯著增強中和廣度和效力。在感染 HIV-1 的人源化小鼠中該抗體顯示出比親本更強的中和活性,異二價BsAb能夠增強與Env的相互作用,從而通過FcgR介導的機制促進病毒顆粒和感染細胞的清除。
有研究者使用CrossMab 技術構建出四種雙特異性IgG[20],每個臂都可以靶向不同表位,這些雙特異性IgG可以中和94%至97%的病毒,表現出比親本抗體更高的中和廣度和效力,其中VRC07 x PG9-16的廣度優于任何一種單獨抗體,中和了病毒中的97%,平均IC50為0.055 mg/L。這種雙特異性IgG在體內藥代動力學參數方面也與其親本抗體組合相似。
2.2 同時靶向HIV與宿主抗原表位的BsAb此類抗體能夠同時靶向病毒的表位與免疫細胞的表位,有利于免疫細胞對病毒進行定位,從而達到抗HIV的目的[15-16]。Strokappe等[21]參考駱駝或其他駱駝科的純重鏈抗體(VHH)開發出新一代雙特異性抗體。單價VHH抗體由于體積小和超過平均長度的CDR3可以結合到隱藏的CD4結合位點,且通常在高溫下穩定。基于這些特性,為了進一步增加廣度和效力,構建了雙特異性VHH,包含J3或3E3以及結合獨立表位的VHH。實驗表明N端帶有CD4bs VHH的雙特異性VHH中和效果優于C端帶有CD4bs VHH的雙特異性VHH。使用含有2E7或11F1F構建的雙特異性VHH,對HIV C分支病毒96ZM651.02和ZM214表現出了更高的中和效力。其中J3-11F1F和3E3-11F1F對ZM214的效力增加了200多倍,而單體11F1F在濃度低于1 μmol/L時無法中和該病毒。對此的合理解釋可能是J3或3E3的結合引起構象變化,使11F1F結合或增強11F1F結合,從而確認HR1中間構象上可能存在一個表位。
值得注意,基于結構修飾的BsAb雖然提高了其抗病毒的效能,但偏離正常抗體結構,不利于藥代動力學和潛在免疫原性的研究,同時生產純化這種抗體也是一種挑戰[13,22-23]。Huang等[24]通過 Cross-Mab技術構建出具有正常結構的10E8V2.0/iMab和10E8V1.1/P140兩種BsAb,其中10E8V2.0/iMab能中和118種HIV-1假型病毒,且能抑制HIV-1感染小鼠的病毒載量,提前給藥能提供完全保護。Moshoette等[25]設計的iMab-CAP256雙特異性抗體可能與10E08-iMab在中和廣度和效力上互補,10E08-iMab和iMab-CAP256聯合使用,可能會有更好的中和效果。無獨有偶,在人源小鼠中,Wu等[26]設計的BiIASG雙特異性抗體不僅表現出比親本分子更強的中和效力,且在HIV攻擊之前注射BiIA-SG即可獲得無菌保護。Niu等[27]在中華獼猴的體內實驗表明,提前注射BiIA-SG可以防止中華獼猴感染SHIVSF162P3CN病毒[28],而在病毒激發后的第1天或第3天,單次注射BiIA-SG可顯著降低病毒血癥峰值,接受BiIA-SG治療的中華獼猴延遲疾病進展數年。相比之下,未經治療的中華獼猴在2年內發展為SHIV。通過抗CD8b抗體耗竭實驗確定,BiIA-SG誘導與CD8+T細胞長期保護作用相關[29],該發現提供了雙特異性抗體治療誘導非人靈長類中T細胞免疫的概念證明,這保證了BiIA-SG用于HIV-1預防和免疫治療的臨床開發。
Seber Kasinger等[30]描述了一個基于植物的瞬時表達系統生產的雙特異性抗體VRC01Fab-Avaren,由靶向CD4結合位點的mAb VRC01的抗原結合片段(Fab)和靶向gp120的抗病毒凝集素(Avaren)組成的新型雙特異性抗體。有趣的是,VRC01Fab-Avaren以煙草花葉病毒為載體在煙草中表達。初步試驗表明,VRC01AB-Avaren顯示出比二價母體分子VRC01-IgG和Avaren-Fc更強的中和作用,IC50值范圍為48-310 pM。這些結果支持了基于植物的瞬時過表達系統構建的雙特異性抗體,與傳統的基于細胞培養的方法相比,植物表達系統提供了更高的生產速度、可擴展性和安全性[31-32],使其成為藥物蛋白生產的一個有吸引力的選擇,為開發更有效的雙特異性和三特異性抑制劑提供了一個更好的平臺。鄭欽文等[33]也報道了一種新型單基因編碼的串聯雙特異性抗體iMab-PGT151,由靶向CD4的iMab抗體和靶向gp120和gp41交界面的PGT151抗體組成。該抗體由單一基因編碼,保證了產物的均一性,生產和純化更加方便高效。
2.3 靶向宿主細胞抗原表位的BsAb此類抗體靶向宿主細胞的抗原表位,招募免疫細胞對其清除[15-16]。Sung等[34]設計了一種可以招募效應T細胞的雙特異性抗體(HIV×CD3 DART),該雙特異性抗體一臂可以和受感染的宿主細胞抗原表位相連,另一臂是單價CD3抗體可以和效應T細胞結合。HIV×CD3 DART可以錨定受感染并表達Env的細胞,重定向效應T細胞特異性殺滅這些細胞。但當HIV患者使用抗逆轉錄病毒藥物治療時,在沒有病毒感染的靶細胞的情況下,未觀察到T細胞活化,可能由于HIV×CD3 DART只能作用于感染并表達Env的靶細胞。Pollara等[35]使用人類臍帶血作為新生兒免疫系統的模型,以此來評估HIV×CD3 DART分子招募和重定向效應T細胞的能力,從臍帶血中分離的T細胞相較于成人外周血分離的細胞,其殺傷力有所降低,這是由于缺乏記憶和效應CD8 T細胞。當它們被雙特異性DART分子重定向時,它們的溶細胞作用可以達到最強[35]。Dashti等[36]對感染SHIV.C.CH505.375H.dCT的恒河猴分別進行抗逆轉錄病毒治療和HIVxCD3 DART分子的混合物治療,發現實驗組和對照組在使用AZD5582+DART分子治療前后CD4+T細胞中總vDNA的水平穩定,研究發現在沒有潛伏期逆轉的情況下,HIVxCD3 DART分子不能在體內清除感染細胞,而潛伏期逆轉是誘導Env表達和允許DART分子識別的必要條件。
Ramadoss等[31]以增強針對HIV感染細胞的自然殺傷(NK)細胞ADCC為目的設計的雙特異性抗體,該抗體由針對HIV-Env保守gp41殘基的單抗,和針對NK細胞上激活受體CD16的高親和力scFv組成,通過CD16將NK細胞連接到HIV感染的靶點,CD16是NK細胞激活的有效觸發器[37],從而迫使NK細胞與這些細胞接觸并被激活。實驗表明,與相應單克隆抗體相比,bsAbs對 gp41和CD16的親和力增加,由于bsAb能夠同時與NK細胞表面的兩個CD16受體結合,因此其親和力比單抗更高。此外,最近的研究表明[38],HIV通過隱藏Env數量以及ADCC表位,以此阻礙ADCC抗體的識別,有研究者猜測,由于HIV Vpu和Nef對CD4的下調,降低了Env進入CD4結合構象的可能性[39-40]。為了克服感染細胞表面的CD4下調,研究者設計了CD4mc,其可以結合Env并誘導CD4結合構象,能夠改善ADCC介導抗體與Env的結合,并使HIV感染細胞對ADCC敏感[41-443]。Li等[44]設計的雙特異性殺傷細胞接合器BiKEs,通過激活受體CD16A與自然殺傷(NK)細胞結合,將其引導至表達Env的細胞并消除。他們通過柔性連接體將靶向CD4的mD1.22融合到CD16A的抗體結構域,由于其尺寸小且完全來源于人類,可以有效穿透組織找到隱藏的CD4表位,并通過CD16A引導NK細胞殺死HIV-1感染的細胞。實驗顯示,該BiKEs能夠結合所有HIV-1分離物的可能性,這些分離物體積小,完全來自人類,結合它們的高親和力和特異性,激活與CD16A的相互作用,導致HIV-1感染細胞的裂解,表明它們是有希望的候選療法,值得在動物模型和人類中進一步評估,以治療HIV-1感染。
3 總結與展望
隨著基因工程抗體的快速發展,雙特異性抗體技術也日趨成熟,數十個BsAb已經進入臨床研究階段,三個雙特異性抗體已批準上市并應用于腫瘤以及炎癥方面的治療,在病毒免疫治療方面也已起步。HIV雙特異性抗體通過改變結構作用于病毒和宿主細胞的不同靶點,具有更好的效力、廣度,值得進一步研究。但Env的多樣性、mAb的病毒逃逸突變和進入淋巴結或中樞神經系統中的濾泡區等解剖部位(病毒可以在這些部位建立宿主)仍是基于BsAb治療的主要挑戰。在未來,抗HIV雙特異性抗體藥物開發非常重要,基于結構設計的抗體將會越來越多,不論是其單獨使用或與其他抗HIV療法聯合,都必將成為有效的治療方案。

