奧卡西平對三叉神經痛大鼠BDNF/Nrf2通路及機械痛敏的影響
田佳玉 馮丹 胡焓 張書力 袁峰 (武漢市第一醫院疼痛科,湖北 武漢 430000)
三叉神經痛(TN)主要病因是三叉神經周圍出現微血管壓迫,盡管最初的損傷已經愈合,但疼痛傾向持續存在,可嚴重影響患者的身心健康〔1〕。腦源性神經營養因子(BDNF)影響神經元的存活、分化、生長發育,其含量的多少與疼痛感的傳遞密切相關〔2〕。另外,神經性疼痛可誘導氧化應激的產生,而因子E2相關因子(Nrf2)信號通路是目前發現的與外源性刺激和氧化應激相關的主要途徑,血紅素氧合酶(HO)-1為其下游因子〔3〕,Nrf2信號通路激活可進一步抑制機械性痛覺敏感、機械異位痛和熱性痛覺過敏〔4〕。奧卡西平(OXC)主要用于局部性和全身性癲癇發作,可有效治療病毒性腦炎繼發癲癇,降低患者體內炎性因子水平,調節患者的免疫功能紊亂和機體氧化應激狀態〔5〕。但是OXC對TN大鼠BDNF/Nrf2通路及機械痛敏的影響,目前尚未有研究。本研究旨在探究OXC對TN大鼠BDNF/Nrf2通路及機械痛敏的影響并初步探究其機制。
1 材料與方法
1.1材料
1.1.1實驗動物 SPF級SD大鼠(60只,雄性,體重200~220 g,6~8周齡),動物許可證號:SCXK(豫)2017-0001,購自河南省實驗動物中心。本研究通過醫院動物倫理委員會批準并根據3R原則對待實驗動物。
1.1.2實驗藥物 OXC,規格:0.15 g×50片,批準文號:國藥準字J20171081和卡馬西平(CBZ),規格:0.2 g×30片,批準文號:國藥準字H102279均購自北京諾華制藥有限公司。
1.1.3主要試劑和儀器 炎性因子酶聯免疫吸附試驗(ELISA)試劑盒(上海酶聯生物公司);蘇木素-伊紅(HE)染色試劑盒(索萊寶公司);BDNF、Nrf2、HO-1兔抗和辣根過氧化物酶標記羊抗兔IgG二抗(Abcam公司);電子測痛儀(Electric Von Frey型,儀數科技公司);酶標儀(Fax-20100型,INStat公司);光學顯微鏡(SMZ745型,普赫公司);全能型凝膠成像分析系統(ChemiDoc-MP型,湖北惠達公司);等。
1.2方法
1.2.1TN大鼠模型的建立及分組 采用改良后的大鼠眶下神經慢性壓迫性損傷法建立大鼠TN模型〔6〕:術前需禁食12 h,自由飲水。腹腔注射戊巴比妥鈉(30 mg/kg)麻醉大鼠后,取右側臥位,固定頭部及四肢于手術臺上,剔除右側面部觸須及毛發、酒精擦拭皮膚。在手術顯微鏡下,使用手術刀沿大鼠眶下緣3~4 mm處,緊貼鼻根,并沿鼻骨方向切3~5 cm長切口,充分暴露出右側眼眶,分離出位于眶底部內側的眶下神經(共兩道,相隔約1 mm),用兩根4-0烙制羊腸線輕輕結扎眶下神經(假手術組僅暴露神經,不結扎,其他步驟與造模大鼠相同),結扎標準:顯微鏡下可見結扎線使神經稍微變細,并不完全阻斷傳導,且不影響神經外膜血液循環。結扎完成后,縫合創口,待動物清醒后正常飼喂。實驗共分為假手術組、模型組、OXC低、中、高(50、100、200 mg/kg〔7〕)劑量組、CBZ組(陽性對照,7.5 mg/kg〔8〕)各10只,各組灌胃相應劑量藥物,1次/d,連續7 d。
1.2.2機械測痛儀檢測機械痛閾值 實驗前1 w對大鼠進行機械刺激適應性訓練:圍繞鼻區中央的觸須部位及周圍皮膚,用細絲刺激大鼠眶下神經。分別在建模前3、1 d,建模后1、3、5、7 d用電子測痛儀在大鼠鼻區中央的觸須部位及周圍皮膚行機械痛閾值測定,測試時間為上午10~12點,測定溫度保持22℃左右。每只大鼠每次刺激6次,每次間隔1 min。電子測痛儀可將刺激壓力傳導BME-Tactile軟件中,并自動計算出相應的機械痛閾值(共刺激6次,每次間隔1 min)。記錄大鼠陽性反應(即以下行為出現一種時):①退縮,大鼠快速閃躲、后退、轉身、蜷縮身子、靠攏籠壁、將面部覆于身下;②攻擊,大鼠抓咬刺激物;③騷抓,大鼠至少3次騷抓刺激部。記錄有效機械痛閾值,即大鼠產生陽性反應強度的最小值。
1.2.3HE染色觀察三叉神經組織病理變化 上述1.2.2實驗結束后,對大鼠實施安樂死,尾靜脈取血(4℃、13 000 r/min離心15 min),血清置于-20℃冰箱中用于后續ELISA檢測。按照上述1.2.1手術步驟,各組隨機取3只大鼠三叉神經組織置于4%多聚甲醛中固定(另外7只置于-80℃冰箱用于后續檢測),經脫水后、石蠟包埋、切片機切片(5 μm厚)后,進行染色,置于光學顯微鏡下觀察。
1.2.4ELISA法檢測炎性因子含量 取上述1.2.3中-20℃冰箱中保存的各組大鼠血清,嚴格ELISA試劑盒說明書檢測按照白細胞介素(IL)-6、腫瘤壞死因子(TNF)-α和IL-1β含量。
1.2.5生物化學法檢測三叉神經組織中含胱甘肽過氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量 取上述1.2.3中-80℃保存的各組部分三叉神經組織,參照李海軍等〔9〕方法制備組織勻漿(0.5 g三叉神經組織加入0.9% NaCl溶液勻漿),4 000 r/min離心10 min,取上清,比色法檢測GSH-Px活性,硫代巴比妥酸法檢測SOD活性,黃嘌呤氧化法檢測MDA含量。
1.2.6Western印跡檢測三叉神經組織中BDNF、Nrf2和HO-1蛋白表達水平 取上述1.2.3中-80℃保存的各組剩余三叉神經組織,提取總蛋白,對蛋白定量,取50 μg蛋白樣品進行電泳、轉聚偏氟乙烯(PVDF)膜、封閉、BDNF、Nrf2和HO-1兔抗(稀釋比1∶1 000)4 ℃過夜孵育、二抗(1∶2 000)室溫孵育2 h,顯色,以β-actin為內參,分析蛋白表達水平。
1.3統計學方法 采用SPSS22.0軟件進行方差分析及SNK-Q檢驗。
2 結 果
2.1OXC對不同時間點機械痛閾值的影響 建模前3、1 d,各組機械痛閾值差異不顯著(P>0.05)。建模后1、3 d,與假手術組相比,模型組機械痛閾值顯著降低(P<0.05),與模型組相比,OXC低中高劑量組和CBZ組機械痛閾值差異不顯著(P>0.05)。建模后5、7 d,模型組機械痛閾值顯著低于假手術組(P<0.05);OXC低、中、高劑量組機械痛閾值較模型組依次明顯升高,OXC高劑量組和CBZ組機械痛閾值差異無統計學意義(P>0.05)。見表1。
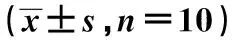
表1 各組機械痛閾值比較
2.2OXC對TN大鼠三叉神經組織病理變化的影響 假手術組三叉神經組織結構正常,無明顯病理性變化;模型組三叉神經組織結構紊亂,間質異常,出現大量炎性因子浸潤;與模型組相比,OXC低、中、高劑量組三叉神經組織上述病理損傷依次減輕;OXC高劑量組和CBZ組三叉神經組織病理性損傷差異不明顯。見圖1。

圖1 各組三叉神經組織病理學變化(HE染色,×200)
2.3OXC對TN三叉神經組織GSH-Px、SOD活性和MDA含量的影響 與假手術組相比,模型組三叉神經組織中GSH-Px、SOD活性顯著降低,MDA含量顯著升高(P<0.05);與模型組相比,OXC低、中、高劑量組三叉神經組織中GSH-Px、SOD活性依次升高,MDA含量依次降低(P<0.05);OXC高劑量組、CBE組三叉神經組織中GSH-Px、SOD活性和MDA含量差異無統計學意義(P>0.05)。見表2。
2.4OXC對TN大鼠三叉神經組織BDNF、Nrf2和HO-1蛋白表達水平的影響 與假手術組相比,模型組三叉神經組織BDNF、Nrf2和HO-1蛋白表達水平顯著降低(P<0.05);OXC低、中、高劑量組三叉神經組織BDNF、Nrf2和HO-1蛋白表達水平較模型組依次明顯升高(P<0.05);OXC高劑量組、CBE組三叉神經組織BDNF、Nrf2和HO-1蛋白表達水平差異無統計學意義(P>0.05)。見表2和圖2。

表2 各組三叉神經組織GSH-Px、SOD活性和MDA含量及BDNF、Nrf2和HO-1蛋白表達水平比較

1~6:假手術組,模型組,OXC低劑量組,OXC中劑量組,OXC高劑量組,CBZ組圖2 Western印跡檢測各組三叉神經組織中BDNF、Nrf2和HO-1蛋白表達
2.5OXC對TN大鼠血清中炎性因子含量的影響 與假手術組相比,模型組血清炎性因子TNF-α、IL-6、IL-1β含量顯著升高(P<0.05);OXC低、中、高劑量組、CBE組血清TNF-α、IL-6和IL-1β含量較模型組依次明顯降低(P<0.05);OXC高劑量組、CBE組血清炎性因子含量差異不顯著(P>0.05)。見表3。

表3 各組血清炎性因子含量比較
3 討 論
TN屬于慢性繼發性疼痛,主要由周圍或中樞神經系統損傷或疾病引起,沒有高度的專業化治療手段且診斷和治療均較為困難,涉及麻醉科、神經科、牙科、神經外科等多門學科〔10〕。目前已有多種藥物可用于治療,包括加巴噴丁、普雷加巴林、三環抗抑郁藥等,但是其副作用限制了現有藥物治療的使用〔11〕,手術治療可顯著改善疼痛癥狀,但是操作極為嚴格且費用昂貴〔12〕。本研究提示模型構建成功,產生炎癥反應且大鼠疼痛敏感性增加。
OXC主要治療癲癇病患者,尤其是對于強直陣攣性發作的或者部分性癲癇的患者,另外,OXC也可以治療神經性頭痛,比如帶狀皰疹后神經痛及周圍神經病變導致的肢體麻木癥狀,此藥副作用相對較小。孟偉建等〔13〕研究發現中藥湯劑聯合OXC混懸液治療癲癇,可有效地降低機體炎癥反應,減少癲癇發作頻率,臨床療效顯著且安全性高。另外,OXC治療,對缺血性損傷后的腦損傷具有神經保護作用,這種神經保護作用可能通過氧化應激和神經炎癥的減弱表現出來〔14〕。其中GSH-Px、SOD可作為抗氧化應激能力強弱的指標,MDA可作為評定氧化應激反應嚴重程度的指標,而TNF-α、IL-6和IL-1β水平與炎性反應密切相關,水平越高表明炎癥越嚴重。另外,Szok等〔15〕研究發現OXC可用于治療TN。本研究結果提示OXC可降低TN大鼠氧化應激及炎癥反應,降低大鼠疼痛敏感性,但其中的機制尚需進一步研究。
Zhang等〔16〕研究發現,眼鏡蛇毒素可能通過下調BDNF通路,引起大鼠TN和認知功能障礙,而雙相躁狂患者血清BDNF水平較低,OXC短期單藥治療后BDNF水平升高〔17〕。羅杰等〔18〕研究發現逍遙散可能通過激活Nrf2通路,上調BDNF水平,從而改善氧化應激狀態,抵抗嗅球摘除大鼠抑郁癥。Yoo等〔19〕研究發現乙酰復合胺可通過激活神經元細胞中BDNF和Nrf2通路,對神經起保護作用,改善氧化應激及細胞凋亡。通過激活BDNF/Nrf2信號通路可減輕慢性壓迫性神經損傷大鼠的神經性疼痛〔20〕。提示OXC可能通過激活BDNF/Nrf2通路,減輕氧化應激反應,實現降低大鼠疼痛敏感性的功能。
綜上,OXC可能通過激活TN大鼠BDNF/Nrf2通路,減輕氧化應激及炎癥反應,降低大鼠機械疼痛敏感性。但是TN的機制比較復雜,可能涉及其他通路,因此,OXZ對TN治療機制尚需深入研究。

