膿毒癥患兒凝血功能障礙的評判及預后的回顧性研究
葛令清,諸澎偉,陸 濤,吉山寶,何 勇
(南京醫科大學附屬無錫兒童醫院PICU,江蘇 無錫 214023)
在 2016年膿毒癥國際會議上將膿毒癥(sepsis-3)定義為機體對感染的反應失調導致危及生命的器官功能障礙,強調了器官功能障礙是診斷基本條件,并選擇了續貫器官功能衰竭評估(sequential organ failure assessment score,SOFA)作為量化器官功能障礙的評分系統,有利于重癥監護室對膿毒癥患者病情的準確判斷和高效集中的重點管理[1]。研究表明,凝血障礙在膿毒癥的器官功能障礙的發展中起重要作用。一旦患者發展為彌散性血管內凝血(disseminated intravascular coagulation,DIC),病死率將顯著增加。因此,盡早發現DIC在膿毒癥的救治中至關重要。
本研究對近5年來本院兒科重癥監護病房(PICU)的膿毒癥患兒進行了回顧性分析研究,由于目前SOFA仍然是成人病患的標準,于是采用國際上較為廣泛使用的兒童續貫器官功能衰竭評估[2-4](pediatric sequential organ failure assessment score,pSOFA)的方法進行評估,并用中國彌散性血管內凝血診斷積分系統[5](Chinese DIC scoring system,CDSS)、膿毒癥相關凝血功能障礙[6](sepsis-induced coagulopathy,SIC)兩種凝血功能評分方法進行評判,對影響預后的凝血相關因素進行了回歸分析。
1 資料與方法
1.1研究對象 回顧性分析2015年7月1日至 2020年6月30日本院PICU收治的147例膿毒癥患兒。
1.2納入標準 年齡29 d至16歲;均符合膿毒癥3.0診斷標準:感染+pSOFA評分≥2分;膿毒癥休克:膿毒癥患者經充分液體復蘇后仍存在組織低灌注,需血管活性藥物以維持平均動脈壓(MAP),且血漿乳酸>2 mmol/L。
1.3排除標準 惡性腫瘤、先天性凝血功能異常、原發肝臟疾病的患兒,使用抗凝藥物患者、入院后24 h內死亡均不納入研究。臨床資料不完整、病史不詳盡的患者。
1.4方法
1.4.1設計表格與資料收集 147 例膿毒癥患者均按照《拯救膿毒癥運動指南》實施治療,收集相關臨床資料:患兒姓名、住院號、性別、年齡、感染原因與部位;收集患兒本次入住PICU前的血常規資料,其中白細胞(WBC)、血紅蛋白(Hb)、C反應蛋白(CRP)、血小板(PLT)分別為病初WBC、病初Hb、病初CRP、病初PLT。收集患兒入住PICU后病情危重期的實驗室數據:Hb、CRP、PLT、總膽紅素(TB)、血肌酐(Cr)、氧合指數(OI)、血乳酸(LAC)、凝血酶原時間(PT)、凝血酶原時間國際標準化比值(PT-INR)、活化部分凝血酶原時間(APTT)、纖維蛋白原(Fib)、D二聚體(D-D)、抗凝血酶Ⅲ(ATⅢ)。在危重期的WBC、Hb、CRP、PLT分別是高峰WBC、高峰Hb、高峰CRP、高峰PLT,并分別與病初值計算出差值。
1.4.2評估與分組 采用CDSS和SIC兩種方法分別對所有患兒進行評分。當患兒CDSS評分≥7分,則為CDSS-DIC組[5];當患兒SIC評分≥4分,則為SIC異常組,見表1。并根據患者預后情況將患者分為死亡組和存活組,其中死亡是指患者院內死亡或不可避免死亡而放棄搶救自動出院,存活是指患者病情穩定出院或轉普通病房。

表1 SIC評分標準
1.4.3檢測方法 (1)所有患兒入住PICU 后采集外周靜脈血,測定血常規、血生化、血凝系列、血乳酸、血Cr、血TB,同時采集股動脈血進行血氣分析。(2)病情及凝血系統評分監測:收集所有患兒入住PICU后第一個24 h的兒童危重癥病例評分(pediatric critical illness score,PCIS)、Glasgow、pSOFA、CDSS、SIC評分。

2 結 果
2.1各組患兒人口學資料分析 膿毒癥患兒 147例,男88例,女59例;年齡1~155個月;存活組136例,死亡組11例,病死率為7.5%。存活組與死亡組的性別、月齡、月齡分布各階段的比較,差異無統計學意義(P>0.05),見表2。

表2 各組患兒人口學資料對比分析
2.2存活組與死亡組患兒的臨床實驗室指標對比分析 存活組與死亡組相比較,病初WBC、Hb差值、高峰PLT、PLT差值、LAC、Cr、PT、PT-INR、APTT、Fib、 AT病死率、D-D差異有統計學意義(均P<0.05)。而兩組在高峰WBC、WBC差值、病初Hb、高峰Hb、病初PLT、病初CRP、高峰CRP、CRP差值、TB、OI的比較差異均無統計學意義(P>0.05),見表3。

表3 存活組與死亡組患兒的臨床實驗室指標比較分析

組別n高峰PLT(×109/L)PLT差值(×109/L)病初CRP(mg/L)高峰CRP(mg/L)CRP差值(mg/L)LAC(mmol/L)存活組136336.04±194.06133.91±63.1053.45±38.6259.90±49.8553.65±38.313.02±2.33死亡組11149.45±108.4194.00±101.4167.09±47.0156.60±37.7448.88±36.455.22±3.45t-3.13 2.25 1.02 0.63 0.39 2.81 P-0 0.03 0.28 0.53 0.69 0

組別nTB(μmol/L)血Cr(μmol/L)OIPT(s)PT-INR存活組13614.34±7.5930.01±17.56398.82±171.9814.34±4.781.23±0.39死亡組1112.46±8.1870.5±43.93421.18±184.4123.04±6.512.02±0.66t-0.74 5.40 0.41 -5.63 -3.85 P-0.46 0 0.68 0 0
2.3存活組與死亡組的臨床評估指標的對比分析 存活組與死亡組分別在Glasgow、PCIS、pSOFA的比較,差異有統計學意義(均P<0.05),見表4。
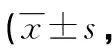
表4 各組患兒的臨床評估指標比較分析分)
2.4CDSS、SIC兩種評估方法的對比 通過CDSS、SIC兩種方法對膿毒癥患兒的病情進行評估,CDSS-DIC組有13例,SIC異常組有32例,總體死亡人數11例,病死率7.5%,其中CDSS-DIC組有6例(4.1%),SIC異常組有11例(7.5%)。CDSS-DIC組和SIC異常組在性別、月齡、pSOFA的對比分析見表5。以患兒的死亡為標準對CDSS、SIC兩種方法的進行評估,分別計算兩種評分方法的查準率[查準率P=TP/(TP+FP)]、查全率[查全率R=TP/(TP+FN)]和準確率[A= (TP+TN)/(TP+TN+FP+FN)]。TP:T是指標記正確,P是指實際中的類別是P類,TP:正確地標記為正。FP:錯誤地標記為正。FN:錯誤地標記為負。TN:正確地標記為負。CDSS的查準率、查全率和準確率分別是46.2%、54.5%、85.3%,SIC的查準率、查全率和準確率分別是34.4%、100.0%、85.7%。

表5 CDSS-DIC組和SIC異常組的臨床資料對比分析
2.5預后影響因素的二元 logistic回歸分析 以預后為因變量,將單因素分析中差異具有統計學意義的實驗室指標變量(初期WBC、Hb差值、高峰PLT、PLT差值、LAC、Cr、PT、PT-INR、APTT、Fib、ATⅢ、D-D)納入二元 logistic回歸分析,結果顯示,Hb差值、PLT差值、PT、Cr是影響患兒預后的獨立相關因素,隨Hb差值、PLT差值、PT增大,死亡風險隨其增加(均P<0.05)。危險因素回歸模型預測概率公式:P=1/〔1+ e-(4.436+0.079×Hb差值+0.012×PLT差值+0.699×PT+0.054×Cr)〕。見表6。

表6 膿毒癥患兒死亡危險因素的二元 logistic 回歸分析
2.6危險因素對預后的預測價值 對回歸分析中有價值的變量分別進行ROC曲線分析,結果顯示,PT、Cr 可預測膿毒癥患兒預后,ROC曲線下的面積均大于0.7(均P<0.05)。而Hb差值、PLT差值的AUC均小于0.5(均P<0.05)。Hb差值、PLT差值的截斷值:依據ROC曲線,尋找Hb差值的約登指數對應的其敏感度為54.5%,特異度83.0%,截斷值為36.88,PLT差值的截斷值為67.8×109/L,敏感度32.9%,特異度87.4%,見圖1、表7。

表7 ROC曲線下的面積分析

圖1 ROC曲線分析
3 討 論
國際血栓形成和止血協會(ISTH)將DIC定義[1]為一種獲得性綜合征,其特征是血管內凝血激活并由于不同原因引起局部喪失。DIC可能起源于微血管,并對其造成損害,如果足夠嚴重,會導致器官功能障礙。最新的研究支持以下觀點:DIC不僅應被視為凝血障礙或止血失敗,還應被視為由內皮功能障礙引起的新出現的全身性血管炎癥的延遲癥狀,破壞的內皮細胞成為凝血的支架,促使DIC的發生[7-8]。國外目前使用4 種 DIC 診斷評分系統,我國的專家共識方案是2017年中國彌散性血管內凝血診斷積分系統(CDSS)。
然而,導致DIC的原發疾病有感染、腫瘤、手術、外傷等,膿毒癥中凝血激活被認為是抵抗感染宿主過度的全身反應,凝血/纖溶系統功能紊亂、免疫功能紊亂等多因素相互作用的結果。目前認為,炎性反應介質超常釋放引起機體的過度炎性反應與凝血功能障礙是決定膿毒癥病情與預后的關鍵[9]。最近的研究闡明了潛在疾病不同,DIC的特征有差異,例如:與膿毒癥相關的DIC通常并發器官功能障礙,實體瘤患者的DIC多合并血栓,血液系統惡性腫瘤患者并發DIC多合并出血[10]。
于是,2017年ISTH科學標準化委員會的活躍成員提出了膿毒癥合并DIC,即SIC的概念,目前在國內外已經得到運用并逐漸認可。ISTH的DIC成員檢查了敗血癥性凝血病患者的診斷率和病死率。結果,幾乎所有顯性DIC患者都患有SIC,并且在每種情況下SIC都較顯性DIC提前出現。公開DIC的病死率顯著高于SIC(32.5%vs.23.1%)[11]。YAMAKAWA等[12]比較了SIC與國際血栓形成和止血協會(ISTH)的DIC和日本急性醫學協會(JAAM)DIC的診斷標準,認為 SIC和JAAM DIC診斷出的凝血病發生率相似,SIC診斷標準可能對膿毒癥的抗凝治療具有重要價值,并且可以替代常規DIC評分系統。DING等[13]回顧研究分析了252例膿毒癥患者,認為ISTH的改良DIC評分和SIC評分是ICU病死率的獨立危險因素。
而兒科疾病中以感染膿毒癥是產生DIC最多、最常見病因,于是用CDSS和SIC兩種凝血功能評分方法對膿毒癥患兒進行評判,并對影響預后的凝血相關因素進行了回歸分析。
根據存活組與死亡組的對比分析,兩組在性別、月齡及月齡分布比較均無統計學差異;而臨床實驗室指標對比發現,死亡組的Hb差值、Cr、LAC、PT、PT-INR、APTT、D-D較存活組均有顯著升高(均P< 0.05);病初WBC、高峰PLT、LAC、ATⅢ顯著下降,PLT差值顯著升高(均P<0.05)。提示死亡組患兒具有更加明顯的炎性反應,LAC堆積,Hb、PLT消耗性下降,凝血因子大量消耗,腎功能受損,從而導致了難以糾正的多器官衰竭。本研究中,Glasgow、PCIS、pSOFA的比較存活組與死亡組差異也有統計學意義(均P<0.05)。將這些單因素分析有顯著差異的實驗室指標變量納入預后的二元logistic回歸分析發現,Hb差值、PLT差值、PT、Cr是影響患兒預后的獨立相關因素,提示Hb差值、PLT差值越大,則凝血因子消耗越多,PT即升高明顯,死亡風險隨其增加,提示Hb、PLT是保護性因素。同時當腎功能出現受損時,死亡風險也顯著增加。不過,對Hb差值、PLT差值、PT、Cr 4個變量分別進行ROC曲線分析后發現:PT、Cr 的ROC曲線下的面積均大于0.7(均P<0.05)。而Hb差值、PLT差值的AUC均小于0.5(均P<0.05),提示PT、Cr對于膿毒癥患兒預后的診斷價值高于Hb差值、PLT差值,推測其原因可能與Hb、PLT主要參與了膿毒癥并發凝血異常的早期過程有關,當這種惡性循環發生時才出現凝血因子消耗、腎功能異常的變化,即預示預后不佳。本研究關注到了Hb、PLT在膿毒癥發生、發展過程中的急劇變化,認為膿毒癥早期患兒出現Hb、PLT的急劇下降可能比Hb、PLT水平對預后預判中的意義更大。
同時,采用CDSS、SIC兩種方法對膿毒癥患兒進行病情評估,發現CDSS、SIC判斷患兒病情的準確率均達到85%以上,具有較高的準確率;以患兒的死亡為標準來預判患兒的查準率,CDSS優于SIC(46.2%vs.34.4%);但是,SIC在查全率上較CDSS提高近一倍(100.0%vs.54.5%)。本研究認為,CDSS、SIC出現查準率、查全率的差異,其主要原因有:(1)CDSS對凝血異常值的改變更嚴格,如PLT、D-D、Fib均在顯著變化時計分,兒童膿毒癥合并凝血異常時PLT、D-D、Fib水平相較于血液病、手術、外傷等其他疾患低;(2)SIC是結合了膿毒癥pSOFA與PLT、PT-INR的計分系統,較為強調膿毒癥的相關變化,而凝血異常值的改變要求相對較低。
王義等[14]回顧性分析了165例膿毒癥患兒,通過二元 logistic回歸分析、ROC曲線分析顯示,LAC、SCr均對膿毒癥患兒預后有預測價值,是影響膿毒癥患兒預后的獨立危險因素。褚曉瓊等[15]回顧性分析ICU的138例膿毒癥成人患者,logistic回歸分析提示,PT是膿毒癥患者死亡預后的獨立危險因素。
總結本次臨床回顧性分析,認為(1)pSOFA作為為重癥兒童設計的膿毒癥的診斷評分標準,是完善兒童膿毒癥診斷標準的一個有效方案,值得在臨床中使用并完善;(2)目前國內外的DIC診斷標準較多,我國以CDSS為準,然這些診斷標準的設計使用對象包括多種原因導致的DIC,而針對膿毒癥導致的DIC診斷標準目前只有SIC,本研究發現SIC雖然在查準率上較CDSS低,而在查全率上較CDSS又明顯提高,提示在臨床工作中可以采用CDSS、SIC兩種方法更有利于提高膿毒癥的預警和處理;(3)通過本次回顧性分析研究認為,Hb差值、PLT差值、PT、Cr是影響患兒預后的獨立相關因素,Hb、PLT是保護性因素。早期臨床上出現Hb或者PLT迅速下降,提示患兒感染導致的病情已經急劇惡化,有DIC啟動的危險;同時病情變化中Cr迅速上升,更應該高度警惕和重視。

