四氫萘催化裂化研究進展
闞仁俊, 達志堅, 張久順, 魏曉麗
(中石化石油化工科學研究院有限公司,北京 100083)
隨著中國經濟的快速發展,對低碳烯烴的需求量越來越高[1-2]。重油催化裂解工藝(DCC)是將重質餾分油轉化為丙烯的重要手段,丙烯收率能達到25%左右[3]。為實現石油資源的高效利用,加氫處理油越來越成為催化裂解的重要原料。宋昌才[4]研究了渣油深度加氫-催化裂解組合工藝,發現渣油經加氫生成的飽和烴和烷基苯類比例達到70%以上,以此為原料進行催化裂解,丙烯收率達到19%以上,乙烯+丙烯+苯、甲苯、二甲苯(BTX)收率可達28%以上。原料油中的芳烴在加氫過程中飽和為環烷烴,但單環芳烴不易飽和[5],因此加氫處理油中會含有部分環烷基單環芳烴,如四氫萘、八氫菲、八氫蒽等。
Corma等[6]認為,3個或更多環數的環烷基單環芳烴的化學性質與四氫萘具有一定的相似性,同時,由于多環烷環取代的單環芳烴模型化合物較難找尋與研究,因此,研究四氫萘催化裂化過程對于研究更加復雜的同類型分子具有一定的借鑒意義。四氫萘在催化裂化過程中主要發生開環裂化反應和脫氫縮合反應,這2個反應屬于競爭反應且活化能很接近,產物包括C1~C4的輕烴,苯、甲苯、二甲苯、萘和焦炭等[7]。
筆者從反應機理、動力學、催化材料、工藝等方面對四氫萘催化裂化過程進行系統總結與分析,并從上述角度對強化四氫萘開環裂化反應生成低碳烯烴和BTX等化學品提出了展望。基于對四氫萘催化裂化過程的深入認識,對于在加工富含多個環烷基取代芳烴的原料油時選擇催化材料和相應的工藝具有積極作用。
1 四氫萘催化裂化反應機理
Sato等[8]在NiW/USY分子篩催化劑、反應溫度為250~350 ℃、臨氫的條件下研究了四氫萘的反應機理,提出四氫萘的反應由2種不同的機理引發:一是雙分子反應機理;二是單分子反應機理。
雙分子反應機理認為,一個四氫萘分子先形成丁基苯正碳離子,然后丁基苯正碳離子通過芳環上的親電取代反應進攻另一個四氫萘分子,從而形成苯基丁基四氫萘,而后苯基丁基四氫萘分解為苯和丁基四氫萘正碳離子。但是由于丁基四氫萘正碳離子不穩定,其易于轉化為八氫蒽或八氫菲。八氫蒽或八氫菲進而發生異構化、裂化和烷基轉移等反應生成八氫蒽和八氫菲的同分異構體以及烷基取代四氫萘,反應路徑如圖1所示。Mostad等[9]和Townsend等[10-11]分別研究了四氫萘在460~482 ℃和400 ℃下四氫萘的催化裂化反應,均未發現苯基丁基四氫萘的存在,因為苯基丁基四氫萘在溫度大于450 ℃下易在催化劑上轉變為苯和焦炭。

圖1 低溫下四氫萘雙分子反應機理Fig.1 Bimolecular reaction mechanism of tetralin at low temperatures
單分子反應機理認為,四氫萘通過快速加氫、脫氫反應生成十氫萘和萘,十氫萘發生異構化反應生成甲基全氫茚,然后由甲基全氫茚發生裂化反應生成正丁基環己烷和環己烷。另一方面,四氫萘通過異構化反應生成甲基茚滿,甲基茚滿在催化劑上生成正丁基苯正碳離子,進而生成正丁基苯,接著正丁基苯發生裂化反應生成苯和正丁烷,反應路徑如圖2所示。Corma等[6]采用Y型分子篩催化劑,在反應溫度為450~550 ℃條件下,考察了四氫萘催化裂化反應規律,結果幾乎沒有發現由雙分子反應機理生成的特征產物苯基丁基四氫萘。因此,其認為在催化裂化條件下,四氫萘遵循單分子反應機理進行反應。Townsend等[10-11]在研究四氫萘催化裂化反應時發現有少量氫氣生成,這也驗證了四氫萘受H+進攻形成非經典五配位正碳離子的猜想。
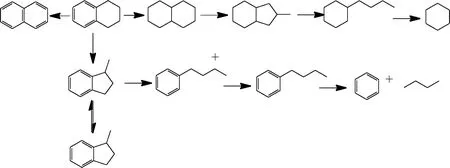
圖2 四氫萘單分子裂化反應機理Fig.2 Monomolecular reaction mechanism of tetralin
楊哲等[12]由分子模擬計算得到四氫萘中不同C—H鍵和C—C鍵的鍵能,結果如圖3和圖4所示。由圖3可知,環烷環上的C—H鍵鍵能均小于苯環上C—H鍵鍵能,因受苯環的影響,與苯環相鄰的α位C—H鍵鍵能最低。由圖4可知,環烷環上C—C鍵鍵能均小于苯環上C—C鍵鍵能,環烷環上位于苯環β位的C—C鍵鍵能最低。在催化裂化過程中,上述兩處鍵能最低的位點較易受到催化劑酸中心的進攻。

圖3 四氫萘不同C—H鍵的鍵能Fig.3 Energies of different C—H bonds of tetralin
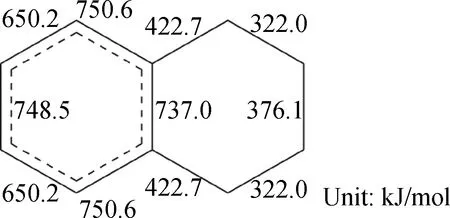
圖4 四氫萘不同C—C鍵的鍵能Fig.4 Energies of different C—C bonds of tetralin
許友好等[13]和王新等[14]提出,當催化劑上B酸中心質子H+進攻四氫萘環烷環上與苯環相鄰的α位C—Hσ鍵時,會形成非經典五配位正碳離子,然后非經典五配位正碳離子進一步裂化生成1個相應的經典三配位正碳離子和1個H2分子,反應過程如圖5所示。當催化劑上B酸中心H+攻擊四氫萘環烷環上位于苯環β位的C—Cσ鍵時,也是先形成非經典五配位正碳離子,繼而裂化生成三配位正碳離子,反應路徑如圖6所示。

圖5 H+進攻四氫萘α位C—H σ鍵示意圖Fig.5 Schematic diagram of H+ attackingα-C—H σ bond of tetralin

圖6 H+進攻四氫萘β位C—C σ鍵示意圖Fig.6 Schematic diagram of H+ attackingβ-C—C σ bond of tetralin
Corma等[6]和Mostad等[9]認為,在催化裂化
反應條件下,四氫萘主要遵循單分子反應機理,四氫萘芳環處最容易質子化形成正碳離子,然而這種正碳離子發生開環裂化時會產生伯正碳離子,此時必須出現去質子化或釋放負氫離子。伯正碳離子通過質子化環丙烷機理發生異構化生成甲基茚滿,通過β裂解生成相應的仲正碳離子。另一種反應路徑是B酸攻擊四氫萘環烷環形成仲正碳離子,仲正碳離子進而發生β斷裂反應、質子化裂化反應使環烷環開環,并生成低碳烷烴、烯烴、烷基苯等。上述反應通常伴隨少量的烷基轉移反應和脫烷基反應,吸附在催化劑上的正碳離子之間很容易發生氫轉移反應生成萘、菲等芳烴和焦炭[15]。四氫萘催化裂化2種反應路徑如圖7所示[6]。

圖7 四氫萘催化裂化反應路徑示意圖[6]Fig.7 Reaction path diagram for catalytic cracking of tetralin[6]
由于四氫萘上的芳香環具有較強的電負性,容易導致所連接環烷環的α位被抽離負氫離子形成相應的正碳離子,并進一步脫氫芳構化形成萘。Mostad等[8]采用Y-82催化劑,發現四氫萘經脫氫芳構化反應生成萘和甲基萘的選擇性高達36%,其中萘的選擇性達到30%。宋海濤[7]考察了四氫萘在不同類型Y型分子篩上的裂化反應,發現經氫轉移反應生成的萘的選擇性高達43%,而開環裂化反應選擇性為54%。唐津蓮[16]使用選擇性催化裂化催化劑,在470~515 ℃條件下進行四氫萘的開環和脫氫縮合動力學研究,計算出四氫萘的開環反應活化能為56 kJ/mol,脫氫縮合反應的活化能為52 kJ/mol,數據顯示四氫萘脫氫縮合反應更容易發生,從定量方面進一步證實了四氫萘易發生脫氫縮合反應生成萘。
Mostad等[8]研究發現,四氫萘催化裂化的主要產物雖然是萘,但是其一環產物總和大于二環產物總和,說明四氫萘在催化裂化條件下還是主要發生開環裂化反應。四氫萘正碳離子可能是由芳環上的碳原子經質子化形成的,結合楊哲等[12]計算得到的四氫萘分子中C—C鍵的鍵級可以推測,四氫萘苯環與環烷環連接處的碳最有可能受到催化劑的B酸攻擊,于位置9形成叔碳正離子。實驗過程發現的異丁基苯、甲苯和C3等特征產物,說明甲苯可能來源于異丁基苯的叔碳β位斷裂,甲苯進一步發生歧化反應生成苯和二甲苯[17]。Mostad等[8]還發現四氫萘催化裂化反應產物中存在大量1-甲基茚滿,研究者認為其除來源于四氫萘通過異構化反應生成外,還可能來源于丁基苯的環化,這一猜想符合烷基取代芳烴的環化規律[18]。
2 四氫萘催化裂化反應動力學
四氫萘催化裂化反應是典型的氣-固非均相反應,唐津蓮[16]使用平均粒徑為60~100 μm、比表面積為95 m2/g、平均孔徑為34 nm且80%集中在30~40 nm屬于大孔徑小粒徑的選擇性催化裂化催化劑,以消除內、外擴散的影響,采用小型固定流化床(FFB)考察四氫萘在反應溫度470~515 ℃范圍內發生環烷環開環反應和脫氫縮合反應的動力學規律。建立了簡化的四氫萘反應網絡,如圖8所示。并以雙曲線型Langmuir-Hinshelwood(L-H)模型來描述四氫萘催化裂化動力學行為,計算得到各反應的速率常數,并據此計算出催化裂化條件下四氫萘環烷環開環反應活化能為56.06 kJ/mol,脫氫縮合反應活化能為52.57 kJ/mol,集總反應活化能為36~58 kJ/mol,計算結果在常規蠟油催化裂化反應活化能數值范圍內,求得的各反應活化能數值是合理可信的。

k1—k5—Reaction rate constant圖8 四氫萘裂化反應網絡[16]Fig.8 Reaction network for catalytic cracking of tetralin[16]
Dang等[19]采用蒙特卡羅(GCMC)方法計算了四氫萘在γ-Al2O3上的吸附行為,隨著反應溫度的升高,四氫萘的飽和吸附量和飽和吸附熱均下降;隨著催化劑孔徑的增大,四氫萘的飽和吸附量增大,而飽和吸附熱降低。Dang等[20]還采用分子動力學(MD)方法計算了四氫萘在γ-Al2O3上的擴散行為,計算得到四氫萘在γ-Al2O3上的擴散活化能為33.53 kJ/mol;隨著孔徑增大,四氫萘擴散系數增大,徑向分布函數(RDF)分析表明,四氫萘分子在孔道內主要通過分子環區的離域電子與孔道表面的氫原子作用,以近似“平躺”的方式分布在孔道表面。
由于四氫萘與分子篩吸附時,其苯環上的π鍵被破壞,電子流向分子篩,兩者形成分子間氫鍵。同時,氫原子質子化,電子進一步傳遞給氧原子,使橋羥基之間鍵能減弱,O—H鍵長增加。Wang等[21]通過密度泛函理論(DFT)方法計算發現,Y型分子篩的酸密度越高時,分子篩的去質子化能越大,單酸位酸強度越低,四氫萘與分子篩之間的吸附能增加。
3 四氫萘催化裂化催化劑
從催化材料角度看,影響四氫萘催化裂化反應的主要因素包括催化劑的孔結構和酸性。
3.1 裂化催化劑孔結構
Corma等[6]選擇了超大孔(十四元環)UTD-1分子篩,大孔(十二元環)Y型分子篩、Beta分子篩,中孔(十元環)ZSM-5分子篩以及介孔MCM-22分子篩催化劑,探究了分子篩的孔尺寸和拓撲結構對四氫萘催化裂化反應性能的影響。結果表明,具有十四元環孔道結構的UTD-1分子篩由于孔徑過大,可以同時容納2個四氫萘分子,因此四氫萘的反應活性很高,但同時萘和焦炭的產率也很高,這與Martinez等[22]的研究結果相一致,說明四氫萘在超大孔中易以雙分子反應機理進行裂化反應。USY分子篩與UTD-1分子篩相同,四氫萘在其上轉化率高的同時萘和焦炭產率也高。
Arribas等[23]合成了具有6個十二元環的三維大孔結構的ITQ-21分子篩,其與USY分子篩具有相近的B酸位,但其獨特的孔結構不僅有利于開環產物的擴散,還抑制了二次裂化反應發生的可能性,增加了開環產物的選擇性和收率。
陳妍[24]研究了四氫萘在Beta分子篩上的催化裂化反應,發現Beta分子篩孔徑較小,僅能勉強允許單個四氫萘進入,缺少使2個分子足夠靠近并形成過渡態的有利空間,不利于雙分子氫轉移反應的發生。相比于大孔的UTD-1分子篩和Y型分子篩,Beta分子篩由于孔較小,雖然四氫萘的轉化率有所降低,但其也表現出較低的氫轉移活性,裂化產物中萘和焦炭的產率也較低。
Townsend等[10-11]研究四氫萘在酸量基本相同的HY分子篩和HZSM-5分子篩上反應時發現,由于HZSM-5分子篩的孔徑較小,存在嚴重的擴散阻力,使得四氫萘分子難以接近分子篩內部所有的酸性中心,只能在催化劑表面發生裂化反應。所以HZSM-5分子篩的初始活性低于HY分子篩,四氫萘在前者上的轉化率遠低于在后者上的轉化率,但HZSM-5分子篩可以快速裂化產物烷基苯中的烷基取代基,主要產物是苯和丙烯。
姜帥[25]從反應的熱效應角度探究了四氫萘在USY分子篩和ZSM-5分子篩上反應的差異。當采用USY分子篩時,反應器內部會出現溫度迅速升高的現象;當采用ZSM-5分子篩時,反應器內溫度會下降。因為四氫萘的開環裂化反應是吸熱反應,而脫氫縮合反應是放熱反應,因此,可以推導出四氫萘在USY分子篩上發生脫氫縮合反應比例較大;在ZSM-5分子篩上發生開環裂化反應比例較大。Galadima等[26]研究發現,Y型分子篩催化劑比ZSM-5分子篩催化劑具有更合適的孔結構,四氫萘更易接近催化劑上更多的B酸中心,因此四氫萘在Y型分子篩催化劑上開環反應選擇性較高。
唐津蓮[27]在500 ℃、劑/油質量比為6、質量空速為6-1的條件下,研究了四氫萘在Y型分子篩催化劑(CAT-L)和ZSM-5分子篩催化劑(CAT-Z)上的催化裂化反應。結果表明:四氫萘在CAT-L上的轉化率為86.54%,單環芳烴收率為40.04%,雙環及以上芳烴和焦炭收率為39.46%;在CAT-Z上的轉化率為60.93%,單環芳烴收率為23.84%,雙環及以上芳烴和焦炭收率為31.20%。由此可知,四氫萘在CAT-L和CAT-Z上的擴散屬于構型擴散,吸附在CAT-L催化劑活性中心上的正碳離子之間更容易通過雙分子反應機理進行快速的氫轉移反應生成萘等;而CAT-Z催化劑由于其孔徑較小抑制了雙分子裂化反應的發生和大分子中間體及最終產物的形成。
介孔可以提高催化劑上反應活性位點的可接近性,既有利于反應物擴散吸附于活性中心而提高四氫萘的轉化率,也有利于產物快速脫附擴散至反應主體而降低二次反應生成焦炭的幾率。四氫萘分子在ZSM-5分子篩上的擴散路徑如圖9所示。Xin等[28]研究了四氫萘在介孔ZSM-5分子篩上的催化裂化反應,四氫萘的轉化率高達84.8%,遠高于其在常規ZSM-5分子篩上的轉化率56.4%。

圖9 四氫萘在ZSM-5分子篩和介孔ZSM-5分子篩上的擴散路徑Fig.9 Diffusion paths of tetralin on ZSM-5 zeolite and mesoporous ZSM-5 zeolite
楊振東[29]將USY型分子篩和ZSM-5分子篩按照不同程度混合的裝填方式進行混合,并進行四氫萘在催化劑不同裝填方式下的催化裂化反應。研究結果表明,四氫萘在USY型分子篩和ZSM-5分子篩共存時的裂化反應歷程為優先在USY型分子篩表面或孔道內進行反應,生成的烷基芳烴會在USY型分子篩孔道內部或遷移到ZSM-5分子篩上進行反應。USY型分子篩和ZSM-5分子篩存在協同催化作用。
3.2 裂化催化劑酸性
四氫萘的環烷環開環反應是在催化劑的B酸中心上發生的,L酸對開環反應的活性和選擇性影響較小[30-31]。B酸強度增強,有利于環烷環開環反應等單分子反應的發生;酸強度較弱時,有利于氫轉移反應、歧化反應等雙分子反應的發生[31-32]。
陳妍[24]分別在Beta分子篩和Y型分子篩催化劑上考察了四氫萘催化裂化反應性能。研究結果表明,具有較高強酸比例和B酸比例的Beta分子篩更有利于單分子裂化反應。Mcvicker等[33]研究發現,六元環烷環比五元環烷環更加穩定,酸強度增強有利于促進四氫萘經異構化反應生成帶有甲基茚滿,甲基四氫萘中含有叔碳原子,更容易在質子H+的進攻下形成叔碳離子,從而促進環烷環發生開環反應的發生[34]。
但是,B酸位也不是越多越好,因為B酸位越多,反應物和產物極易吸附在活性中心而縮合生焦進而導致分子篩的孔被堵塞。Arribas等[23]研究發現,分子篩B酸密度不宜過高,適中的B酸密度有利于減少二次裂解和脫烷基反應,從而增加開環反應選擇性。因此,較高的B酸強度,有利于促進環烷環開環反應和異構化反應,適宜的酸密度有利于降低二次反應的發生。
唐津蓮[27]在CAT-L和CAT-Z催化劑上研究四氫萘催化裂化反應,提出了如圖10所示的簡要反應途徑,其中活性組分為ZSM-5分子篩的CAT-Z催化劑上的焦炭選擇性比活性組分為Y型分子篩的CAT-L催化劑低。一方面,由于ZSM-5分子篩孔徑較小,四氫萘及裂化產物很難進入其孔道內,只能在催化劑表面反應,抑制了大分子稠環芳烴的生成,生焦量少;另一方面,由于ZSM-5分子篩的L酸量較大,四氫萘和吸附在催化劑上的四氫萘正碳離子容易發生脫氫反應,因此產物中萘和烷基萘的選擇性較高。同時,作者研究了四氫萘在不同B酸量的Y型分子篩催化劑上的裂化反應,發現四氫萘脫氫縮合反應以及生焦反應并沒有隨著L酸量和L酸密度的增加而增加,而是隨著B酸量減少而降低,說明脫氫縮合反應也是以催化劑的B酸為活性中心而進行的。Meusinger等[35]考察了四氫萘在不同類型分子篩上的催化裂化反應時發現,氫轉移反應活性中心既不是非骨架鋁也不是總骨架鋁,而是可接近的B酸中心數。

R1—Unlimited; R2—H2-C4 hydrocarbons;R3—(C4-R2)hydrocarbons corresponding to R2圖10 四氫萘裂化反應途徑[27]Fig.10 Reaction pathway of tetralin cracking[27]
為提高四氫萘開環裂化反應選擇性,在催化劑酸度設計上,應減少強B酸,增加弱B酸。雖然B酸是四氫萘催化裂化反應的活性位,但當B酸酸量減少到一定程度時,B酸酸量進一步降低對四氫萘的轉化率影響不大,卻有利于目標產品尤其是低碳烯烴選擇性的提高。
4 四氫萘催化裂化工藝條件
影響四氫萘催化裂化反應過程的工藝條件包括反應溫度、劑/油質量比、質量空速等。
4.1 反應溫度
唐津蓮[27]以活性組分為Y型分子篩的CAT-L為催化劑,在劑/油質量比為6、質量空速10 h-1條件下,采用小型固定流化床考察了四氫萘在反應溫度450~550 ℃范圍內的催化裂化反應。結果表明,隨著反應溫度升高,四氫萘轉化率增大,同時焦炭選擇性也增大,但環烷環開環裂化產物選擇性卻降低。作者認為隨著溫度升高,四氫萘的擴散速率加快,增加了分子碰撞的機會,從而增加了氫轉移反應的幾率,即焦炭選擇性增大。另一方面,四氫萘熱裂化的活化能為251.2 kJ/mol,遠大于其催化裂化活化能62.8 kJ/mol。熱裂化反應速率隨著反應溫度升高而增大,其增加幅度甚至超過催化裂化反應速率的增加幅度,由于四氫萘熱裂化是按自由基反應機理進行,其生成的芳烴自由基易縮合生焦。因此,為得到較好的產物分布,四氫萘催化裂化不宜采用較高的反應溫度。
劉婷[36]和張海娜[37]采用固定床重油微型反應器考察了四氫萘在不同溫度下的催化裂化反應。結果表明:當反應溫度低于520 ℃時,四氫萘的裂化反應占主導地位;當反應溫度高于520 ℃時,四氫萘更易發生脫氫縮合反應。
四氫萘催化裂化過程主要包括吸熱的開環裂化反應和放熱的氫轉移反應。當反應溫度低于530 ℃時,升溫有利于四氫萘分子通過熱震動和轉動進入催化劑孔道,促進環烷環開環。但隨著反應溫度升高,四氫萘的擴散速率也在加快,雙分子碰撞的幾率增大,從而增加了氫轉移反應發生的幾率,使得吸附在催化劑表面的稠環芳烴進一步縮合,直至生成焦炭。同時,隨著反應溫度升高,熱裂化不斷加強,從而導致四氫萘以自由基機理進行熱裂化,并通過縮合生成稠環芳烴和焦炭。因此,四氫萘催化裂化的反應溫度不宜高于560 ℃[38]。
4.2 劑/油質量比
劑/油質量比影響四氫萘在催化劑活性中心上的吸附速率,進而影響反應速率和轉化深度。
唐津蓮[27]采用小型固定流化床研究了四氫萘在以Y型分子篩為活性組分的CAT-L催化劑上,反應溫度500 ℃、質量空速10 h-1、劑/油質量比在3~9范圍內的催化裂化反應。結果表明,隨著劑/油質量比的增大,四氫萘轉化率增大,焦炭選擇性也增大。當劑/油質量比增大時,單位質量四氫萘所接觸的催化劑增多,催化劑的孔道和活性中心增多,四氫萘吸附過程的推動力增大,加快了四氫萘在催化劑表面的吸附過程,從而加快了整個裂化反應的速率。再者,隨著劑/油質量比增大,產物更容易吸附在催化劑上而發生二次反應生成多環芳烴和焦炭等物質。
劉婷[36]和張海娜[37]采用固定床重油微型反應裝置,在質量空速15 h-1、反應溫度510 ℃條件下,考察了四氫萘催化裂化反應隨劑/油質量比的變化規律。發現隨著劑/油質量比的增大,四氫萘裂化過程中酸密度增大,在轉化率顯著提高的同時氫轉移反應活性也顯著增加,脫氫縮合產物增加幅度比開環裂化產物增加幅度大。
從動力學模型角度來看,原料轉化深度與劑/油質量比呈正相關[39],隨著劑/油質量比增大,原料轉化率不斷提高。但是,當劑/油質量比增加大于8時,因催化劑的平均活性和酸密度都增大,促進開環裂化反應的同時也提高了氫轉移反應的活性。
4.3 質量空速
質量空速是指單位時間內單位質量催化劑處理原料的質量,質量空速一般影響反應原料與催化劑的接觸時間,質量空速越大,接觸時間越短。陳妍[24]采用固定床微型反應器,以Y型分子篩和Beta分子篩為催化劑,考察了四氫萘在不同質量空速下的裂化反應行為。結果表明:在Y型分子篩上,當質量空速由10 h-1增加至45 h-1時,四氫萘和催化劑的活性位點接觸時間縮短,轉化率由85.54%降低至39.98%。在Beta分子篩上,四氫萘轉化率由質量空速10 h-1下的76.14%降低至45 h-1下的31.19%。
4.4 反應器類型
實驗室研究四氫萘催化裂化反應規律時主要使用的反應器類型有:固定床微型反應器、小型提升管反應器、小型固定流化床反應器等。
李曉[40]采用多通道固定床微型反應器(MCC)考察了四氫萘催化裂解反應規律,采用Beta分子篩為催化劑,當反應溫度為580 ℃、劑/油質量比為2.4、質量空速為9.6 h-1時,四氫萘轉化率為89.39%,開環反應選擇性為55.10%,芳構化反應選擇性為38.15%,低碳烯烴選擇性為21.13%,而BTX選擇性為25.78%。說明開環裂化反應和脫氫芳構化反應是四氫萘的2個主要反應,四氫萘分子中苯環上π電子的存在使其具有較高的芳構化傾向。
龔劍洪等[41]采用小型提升管催化裂化裝置進行了LTAG(LCO to aromatics and gasoline)實驗,在結合模擬計算并分析四氫萘不同反應類型活化能的基礎上,提出強化開環裂化反應的途徑,由于四氫萘開環裂化反應活化能大于脫氫縮合反應活化能,因此其更易發生脫氫反應生成萘等。從熱力學和動力學角度考慮,當反應溫度高于580 ℃、劑/油質量比大于8、反應時間小于2 s時,有利于四氫萘開環,四氫萘型物質的開環裂化反應比例大于72%。
陳騫[42]采用小型固定流化床(ACE)研究了四氫萘在不同轉化深度下的裂化反應規律。以Y型分子篩為催化劑,反應溫度為460 ℃、劑/油質量比為0.67時,四氫萘轉化率為6.15%,其極易發生氫轉移反應,產物中萘的選擇性達到66.21%。當反應溫度為540 ℃、劑/油質量比為6時,四氫萘轉化率達到64.50%,非芳烴產物選擇性僅為8.54%,BTX選擇性為14.61%,而萘的選擇性為35.17%。這說明隨著反應溫度升高和劑/油質量比增大,四氫萘開環裂化反應選擇性增大。楊哲[43]采用小型固定流化床,以MLC-500老化劑為催化劑考察了不同工藝條件對四氫萘催化裂化的影響。研究發現,由于四氫萘分子中含有苯環,導致整體電子云分布不均勻,進而導致不同位置的C—C鍵和C—H鍵鍵能不同。由分子模擬計算得出,質子H+進攻四氫萘α位C—C鍵活化能達到282.4 kJ/mol,而進攻α碳原子上的C—H鍵活化能僅為180.2 kJ/mol,印證了四氫萘催化裂化過程易形成非經典五配位正碳離子中間體。
使用不同類型的反應器會導致反應結果存在一定的差異,因為反應原料與催化劑的接觸方式和接觸時間不同。四氫萘在固定床反應器上結焦后無法立刻再生使用,導致積炭越來越多,從而使得催化劑活性降低幅度較大;提升管反應器中的催化劑可以在線連續燒焦循環使用,催化劑活性可以保持平穩,且原料與催化劑的混合程度較大;小型固定流化床反應器兼具固定床和提升管反應器的特點,原料與催化劑混合均勻的同時催化劑難以連續燒焦。
5 結語與展望
四氫萘作為典型的環烷基單環芳烴,分子中由于共軛π鍵的存在,在催化裂化條件下很容易發生脫氫反應,不是優質的催化裂化原料。但此類物質在加氫處理油中仍含有一定量的比例,強化其開環裂化反應,將其高效轉化為低碳烯烴和BTX等基本化學品,不論在經濟上還是在原子利用率上抑或是從節能環保角度看都是非常值得研究的。加強對其催化裂化反應行為的系統總結有助于加深對更復雜環烷基取代單環芳烴催化裂化反應規律的認識。
四氫萘在固體酸催化劑上主要遵循單分子裂化機理,主要發生開環裂化反應和脫氫縮合反應,這2個反應的活化能相差不多,屬于強競爭性反應,因此需要強化其裂化反應能力而降低脫氫反應比例。從催化材料角度而言,催化劑需要適宜的孔徑使四氫萘裂化而不提供過大的空間使其發生氫轉移反應生成多環芳烴和焦炭;另一方面,需要適宜的B酸強度和酸密度使其開環,避免過高的酸強度和酸密度使四氫萘脫氫縮合。由Arrhenius公式可知,溫度對四氫萘的反應活性影響較大,在轉化率提高的同時,氫轉移反應的活性快速增加,因此需控制反應溫度不宜過高。劑/油質量比和質量空速影響原料與催化劑的活性中心的接觸,劑/油質量比越大、質量空速越小,四氫萘與催化劑接觸越多,轉化率提高的同時氫轉移反應也越明顯。因此,在四氫萘催化裂化過程中,需要選擇合適的劑/油質量比和質量空速。不同的反應器類型導致結果有所差異,在實驗過程中需根據實驗目標和反應器特點具體選擇相應的反應器。從催化劑與工藝條件的協同作用而言,為使四氫萘多開環裂化而少發生脫氫縮合反應,則應選擇中等孔徑和適宜B酸酸量的催化材料。在保證轉化率的同時,不宜在較高溫度、過大劑/油質量比和過低的質量空速等強化四氫萘脫氫反應的條件下進行。

