沉默T-cadherin對ox-LDL誘導人絨毛膜滋養層細胞HTR-8/SVneo生物學行為的影響
王海嬌,何紅美,祁麟,崔玉嬌,肖春輝,王毅△
人絨毛膜滋養層細胞來自胚胎外滋養層,具有滋養功能,調節胚胎形成、植入,對順利妊娠具有重要作用[1-2]。滋養層細胞異常凋亡、侵襲可引起胎兒生長受限、流產[3]、妊娠期肝內膽汁淤積癥[4]、子癇[5]等疾病。研究滋養層細胞的行為學功能對于探究上述疾病的發病機制及治療具有重要意義。T-鈣黏蛋白(T-cadherin)是附著在細胞膜上的非經典黏附因子,通過調節鈣介導的細胞極性、細胞黏附等方式參與細胞間信號傳導及識別,與腫瘤細胞的增殖、遷移聯系密切[6]。T-cadherin在人胃癌、宮頸癌細胞中低表達,T-cadherin 過表達可顯著抑制癌細胞的增殖、侵襲及遷移[7-8]。因此推測T-cadherin 的表達可能與人絨毛膜滋養層細胞的增殖、遷移等存在關聯。氧化低密度脂蛋白(ox-LDL)是低密度脂蛋白中大量不飽和脂肪酸在氧化作用下生成的脂質過氧化產物,在子癇前期患者體內呈現高表達[9]。研究發現ox-LDL可致人絨毛膜滋養層細胞增殖、侵襲能力受損,細胞異常凋亡等,與子癇等疾病密切相關[10-11]。本研究通過分析T-cadherin 對ox-LDL 誘導人絨毛膜滋養層細胞增殖、凋亡等異常生物學行為的影響,為保證胎盤正常功能和胎兒正常生長發育提供理論依據。
1 材料與方法
1.1 材料 人絨毛膜滋養層細胞HTR-8/SVneo(批號CL-0599)購自武漢普諾賽生命科技有限公司。T-cadherin 小干擾RNA(siRNA)、T-cadherin siRNA 陰性對照由武漢益普生物科技有限公司設計并合成;Lipofectamine 3000 轉染試劑盒、逆轉錄試劑盒、膜聯蛋白V-異硫氰酸熒光素/碘化丙啶(Annexin V-FITC/PI)凋亡檢測試劑盒、BCA 蛋白試劑盒、SYBR 實時熒光定量PCR(qPCR)試劑盒均購自美國Invitrogen公司;RPMI 1640培養液、RNA提取試劑盒、四甲基偶氮唑鹽(MTT)試劑盒、RIPA裂解液均購自北京索萊寶科技有限公司;結晶紫染液、蛋白提取試劑盒均購自上海碧云天公司;兔源胱天蛋白酶-3(Caspase-3)、B淋巴細胞瘤-2(Bcl-2)、Bcl-2 相關X 蛋白(Bax)、基質金屬蛋白酶(MMP)-2、MMP-9、GAPDH 抗體、羊抗兔二抗均購自英國Abcam 公司;CO2細胞培養箱、qPCR儀、酶標儀、流式細胞儀均購自上海百典儀器設備有限公司;細胞計數器、凝膠成像儀均購自萊普特科學儀器(北京)有限公司;倒置顯微鏡購自日本Nikon公司。
1.2 方法
1.2.1 細胞培養 將HTR-8/SVneo 細胞株于37 ℃恒溫水浴鍋中復蘇后轉移到無菌離心管中,反復吹打細胞,待其充分懸浮后接種在培養瓶中,用RPMI 1640培養液(含1%的青鏈霉素混合液、10%胎牛血清)在37 ℃、5%CO2的培養箱中進行培養,每2 d 更換1 次培養液;待細胞長滿培養瓶后利用0.25%胰蛋白酶進行消化傳代。
1.2.2 細胞分組 取對數生長期HTR-8/SVneo 細胞并調整細胞密度為4×106個/mL,取2 mL 接種于細胞培養瓶培養24 h,將細胞隨機分為空白對照組(用RPMI 1640培養液常規培養細胞)、ox-LDL組(用RPMI 1640培養液常規培養的基礎上給予100 mg/L ox-LDL[11]處理48 h 誘導細胞)、T-cadherin siRNA 陰性對照組和T-cadherin siRNA 組。T-cadherin siRNA 陰性對照組和T-cadherin siRNA 組先通過Lipofectamine 3000轉染試劑盒分別轉染T-cadherin siRNA陰性對照、T-cadherin siRNA,然后給予100 mg/L ox-LDL 處理48 h誘導細胞。收集各組HTR-8/SVneo細胞進行后續實驗,每組均重復6次。
1.2.3 qPCR 法檢測HTR-8/SVneo 細胞中T-cadherin mRNA表達 提取各組細胞的總RNA,根據逆轉錄試劑盒要求得到cDNA,然后按照qPCR 試劑盒說明書進行反應。以U6 作為內參。T-cadherin 引物序列:上游5'-TTCAGCAGAAAGTGTTCCATAT-3',下游5'-GTGCATGGACGAACAGAGT-3';U6 引物序列:上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3'。反應體系:ddH2O 8 μL,SYBR qPCR mix 10 μL,上下游引物各0.5 μL,cDNA 模板1 μL。反應條件:95 ℃預變性5 min,然后進行40 個循環(95 ℃變性10 s、60 ℃退火延伸20 s,72 ℃延伸10 s)。根據2-ΔΔCt法進行T-cadherin mRNA表達水平分析。
1.2.4 MTT 法檢測HTR-8/SVneo 細胞增殖情況 收集各組細胞,調整細胞密度為1×104個/孔并接種于96 孔板,培養細胞48 h后加入10 μL MTT 試劑,繼續培養4 h,離心去除上清液,加入110 μL Formazan溶解液并搖勻,于酶標儀490 nm波長處測定各孔吸光度值,計算細胞增殖抑制率,細胞增殖抑制率=(1-各處理組吸光度值/空白對照組吸光度值)×100%。
1.2.5 平板克隆形成實驗檢測HTR-8/SVneo 細胞克隆形成情況 取各組細胞,按照200 個/孔的細胞密度接種在24 孔板中,于CO2培養箱(37 ℃、5%)中培養14 d。期間每3 d更換1 次培養液,采用4%的多聚甲醛固定,1%的結晶紫進行染色,經PBS沖洗干凈后進行拍照。根據公式計算克隆形成率(克隆形成率=克隆細胞數/接種細胞數×100%)。
1.2.6 流式細胞術檢測HTR-8/SVneo 細胞凋亡情況 各組細胞用胰蛋白酶進行消化后經完全培養基終止消化,調整細胞密度為1×106個/mL 并轉移至1 mL 無菌離心管中,用PBS清洗2 次后離心去除上清液,加入70%的乙醇溶液(4 ℃)固定過夜,經PBS溶液清洗后將細胞重懸,一次加入2 μL RNA酶(去除內源性RNA)、5 μL Annexin V-FITC(標記細胞),靜置45 min后再加入2 μL PI 溶液避光染色1 h,于流式細胞儀觀察細胞凋亡情況。
1.2.7 Transwell 實驗檢測HTR-8/SVneo 細胞侵襲能力 收集各組細胞,調整細胞密度至2×105個/mL,取200 μL細胞液加入預鋪設好的Transwell小室的上室,用RPMI 1640培養液補至1 mL,下室僅加入600 μL完全培養基。培養48 h后輕輕拭去未過膜的細胞,將小室置于4%多聚甲醛中固定20 min后室溫條件下風干,用結晶紫染液(1%)浸染20 min 后室溫條件下風干,在光學顯微鏡下觀察HTR-8/SVneo 細胞侵襲情況。隨機讀取6個視野,計算侵襲細胞數。
1.2.8 劃痕實驗檢測HTR-8/SVneo 細胞遷移能力 收集各組HTR-8/SVneo 細胞置于恒溫培養箱(37 ℃、5% CO2)中繼續培養。待細胞鋪滿板內85%左右時,用200 μL 槍頭垂直于6 孔板底部做直線劃痕,之后細胞繼續置于恒溫培養箱(37 ℃、5%CO2)中培養24 h,于倒置光學顯微鏡下拍照觀察,利用Image J軟件測量劃痕區域寬度,并計算細胞劃痕愈合率,劃痕愈合率=[1-(24 h時劃痕寬度/0 h時劃痕寬度)]×100%。
1.2.9 蛋白免疫印跡實驗檢測HTR-8/SVneo 細胞凋亡相關蛋白Caspase-3、Bax、Bcl-2 和侵襲遷移相關蛋白MMP-2、MMP-9表達情況 取各組細胞,調整密度為3×106個/mL,接種于24孔板中,加入RIPA 裂解液,裂解30 min 后離心,取上清液至無菌離心管中,根據BCA蛋白試劑盒操作步驟測定蛋白質含量。電泳分離等量蛋白質,濕轉法轉膜,加入封閉液封閉1 h,4 ℃下添加兔源Caspase-3、Bax、Bcl-2、MMP-2、MMP-9、內參GAPDH 一抗(均為1∶500)孵育過夜;用TBST緩沖液洗滌3 次,添加羊抗兔二抗(1∶1 000),常溫孵育2 h,經凝膠成像儀對蛋白相對表達水平進行分析(目的蛋白/內參蛋白)。
1.3 統計學方法 采用SPSS 25.0 軟件進行數據分析,計量資料以均數±標準差(±s)表示,多組間比較進行單因素方差分析,組間多重比較行SNK-q檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組HTR-8/SVneo 細胞T-cadherin mRNA 表達水平比較 空白對照組、ox-LDL 組、T-cadherin siRNA 陰性對照組和T-cadherin siRNA 組Tcadherin mRNA 表達水平分別為1.02±0.17、1.56±0.23、1.51±0.19 和1.09±0.05,差異有統計學意義(F=15.555,P<0.01);與空白對照組相比,ox-LDL 組和T-cadherin siRNA 陰性對照組T-cadherin mRNA 表達水平升高(P<0.05);與ox-LDL 組相比,Tcadherin siRNA 陰性對照組T-cadherin mRNA 表達水平差異無統計學意義,T-cadherin siRNA 組Tcadherin mRNA 表達水平降低(P<0.05);與Tcadherin siRNA 陰性對照組相比,T-cadherin siRNA組T-cadherin mRNA表達水平顯著降低(P<0.05)。
2.2 各組HTR-8/SVneo細胞增殖抑制率、克隆形成率比較 與空白對照組相比,ox-LDL 組和Tcadherin siRNA陰性對照組增殖抑制率升高,克隆形成率降低(P<0.05);與ox-LDL 組相比,T-cadherin siRNA陰性對照組增殖抑制率和克隆形成率差異無統計學意義,T-cadherin siRNA 組增殖抑制率降低,克隆形成率升高(P<0.05);與T-cadherin siRNA 陰性對照組相比,T-cadherin siRNA 組增殖抑制率降低,克隆形成率升高(P<0.05)。見表1,圖1。
Tab.1 Comparison of proliferation inhibition rate and clone formation rate between the four groups of HTR-8/SVneo cells表1 各組HTR-8/SVneo細胞增殖抑制率、克隆形成率比較(n=6,%,±s)
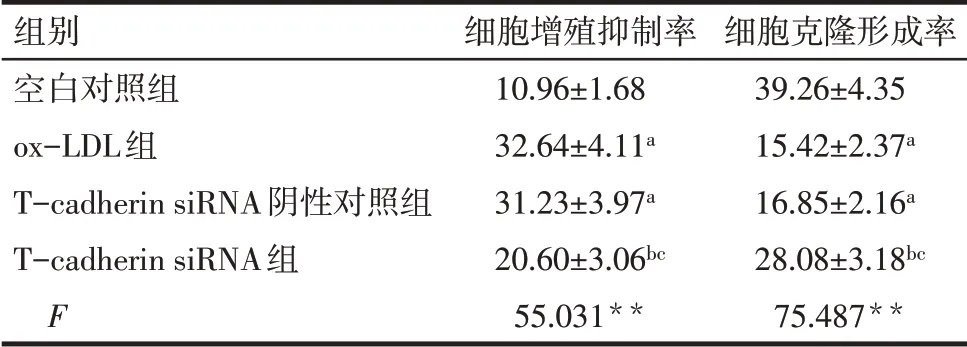
Tab.1 Comparison of proliferation inhibition rate and clone formation rate between the four groups of HTR-8/SVneo cells表1 各組HTR-8/SVneo細胞增殖抑制率、克隆形成率比較(n=6,%,±s)
**P<0.01;a 與空白對照組相比,b 與ox-LDL 組相比,c 與Tcadherin siRNA陰性對照組相比,P<0.05。
組別空白對照組ox-LDL組T-cadherin siRNA陰性對照組T-cadherin siRNA組F細胞增殖抑制率10.96±1.68 32.64±4.11a 31.23±3.97a 20.60±3.06bc 55.031**細胞克隆形成率39.26±4.35 15.42±2.37a 16.85±2.16a 28.08±3.18bc 75.487**
2.3 各組HTR-8/SVneo 細胞凋亡情況比較 空白對照組、ox-LDL 組、T-cadherin siRNA 陰性對照組、T-cadherin siRNA 組細胞凋亡率(%)分別為10.69±2.98、32.47±5.20、33.04±5.13 和21.06±3.98,差異有統計學意義(F=34.721,P<0.05)。與空白對照組相比,ox-LDL 組和T-cadherin siRNA 陰性對照組細胞凋亡率升高(P<0.05);與ox-LDL 組相比,Tcadherin siRNA 陰性對照組凋亡率差異無統計學意義,T-cadherin siRNA 組凋亡率降低(P<0.05);與T-cadherin siRNA 陰性對照組相比,T-cadherin siRNA組凋亡率降低(P<0.05)。見圖2。
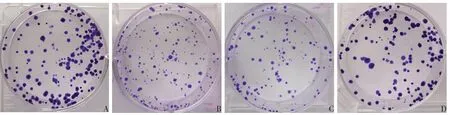
Fig.1 Morphological observation of HTR-8/SVneo cell clone formation in each group(crystal violet staining,×40)圖1 各組HTR-8/SVneo細胞克隆形成形態學觀察(結晶紫染色,×40)
2.4 各組HTR-8/SVneo 細胞侵襲和遷移能力比較 與空白對照組相比,ox-LDL 組和T-cadherin siRNA 陰性對照組侵襲細胞數、劃痕愈合率降低(P<0.05);與ox-LDL 組相比,T-cadherin siRNA 陰性對照組細胞侵襲細胞數、劃痕愈合率差異無統計學意義,T-cadherin siRNA 組侵襲細胞數、劃痕愈合率升高(P<0.05);與T-cadherin siRNA 陰性對照組相比,T-cadherin siRNA 組侵襲細胞數、劃痕愈合率升高(P<0.05)。見表2,圖3、4。
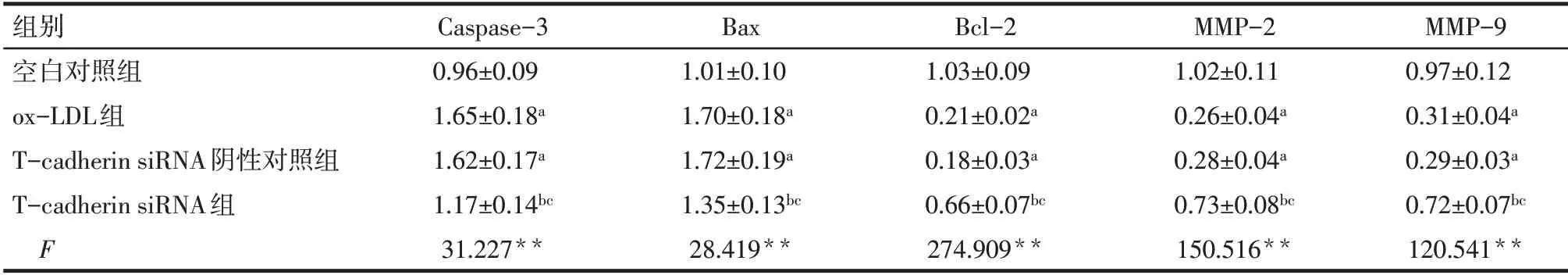
2.5 各組HTR-8/SVneo 細胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表達水平比較 與空白對照組相比,ox-LDL 組和T-cadherin siRNA 陰性對照組Caspase-3、Bax 蛋白表達水平升高,Bcl-2、MMP-2、MMP-9 蛋白表達水平降低(P<0.05);與ox-LDL 組相比,T-cadherin siRNA陰性對照組Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表達水平差異無統計學意義,T-cadherin siRNA 組Caspase-3、Bax 蛋白表達水平降低,Bcl-2、MMP-2、MMP-9 蛋白表達水平升高(P<0.05);與T-cadherin siRNA陰性對照組相比,T-cadherin siRNA 組Caspase-3、Bax 蛋白表達水平降低,Bcl-2、MMP-2、MMP-9 蛋白表達水平升高(P<0.05)。見圖5,表3。
Tab.2 Comparison of the number of invasive cells and scratch healing rate of HTR-8/SVneo cells between the four groups表2 各組HTR-8/SVneo細胞侵襲細胞數和劃痕愈合率比較(n=6,±s)

Tab.2 Comparison of the number of invasive cells and scratch healing rate of HTR-8/SVneo cells between the four groups表2 各組HTR-8/SVneo細胞侵襲細胞數和劃痕愈合率比較(n=6,±s)
**P<0.01;a 與空白對照組相比,b 與ox-LDL 組相比,c 與Tcadherin siRNA陰性對照組相比,P<0.05。
組別空白對照組ox-LDL組T-cadherin siRNA陰性對照組T-cadherin siRNA組F侵襲細胞數(個/視野)140.22±22.95 65.47±8.04a 66.06±8.06a 98.53±10.03bc 39.563**劃痕愈合率(%)25.66±4.30 9.08±1.09a 9.12±1.13a 20.11±3.77bc 46.731**

Fig.2 Apoptosis of HTR-8/SVneo cells in each group圖2 各組HTR-8/SVneo細胞凋亡情況
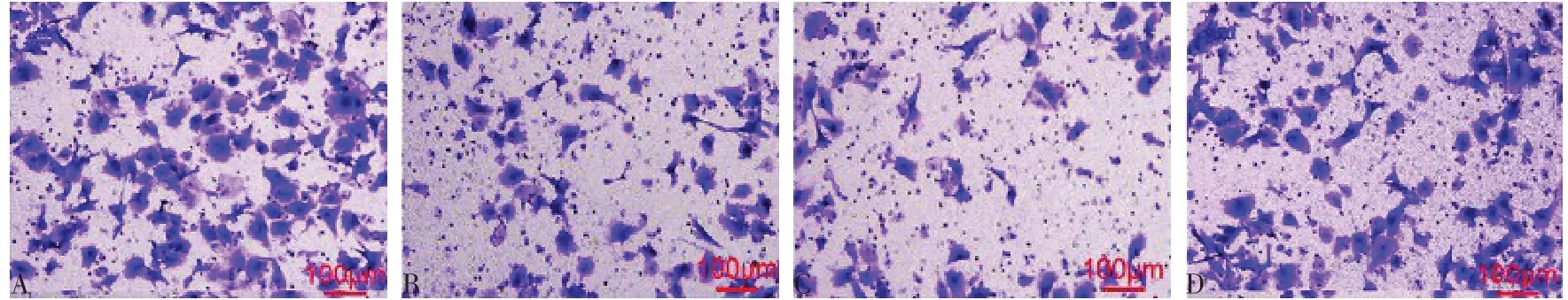
Fig.3 Invasion of HTR-8/SVneo cells in each group(crystal violet staining,×200)圖3 各組HTR-8/SVneo細胞侵襲情況(結晶紫染色,×200)

Fig.4 Migration of HTR-8/SVneo cells in each group(×100)圖4 各組HTR-8/SVneo細胞遷移情況(×100)
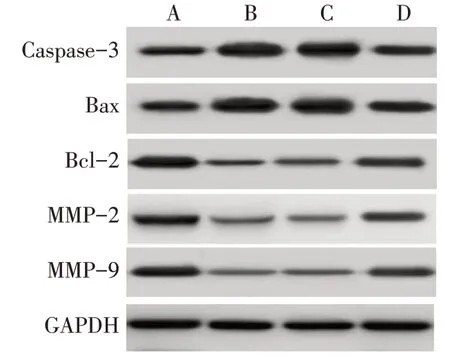
Fig.5 Western blot results of Caspase-3,Bax,Bcl-2,MMP-2 and MMP-9 protein of HTR-8/SVneo cells in each group圖5 各組HTR-8/SVneo細胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白印跡圖
3 討論
ox-LDL是被氧化修飾后的低密度脂蛋白,具有極強的細胞毒性,是造成血管內皮損傷的關鍵。ox-LDL可增加細胞對低密度脂蛋白的通透性,進而損傷血管內皮細胞,誘導細胞凋亡[12-13]。研究表明ox-LDL同樣可誘導滋養層細胞凋亡,并促進滋養層細胞中凋亡相關因子Caspase-3 等的表達[10]。本研究結果顯示,經過ox-LDL誘導的HTR-8/SVneo細胞克隆形成能力、細胞侵襲及遷移能力顯著下降,增殖抑制率、凋亡率顯著升高,表明ox-LDL 具有誘導HTR-8/SVneo細胞凋亡,降低其侵襲能力的作用。
滋養層細胞具有類似腫瘤細胞的侵襲、遷移等能力,與胚胎著床及胚胎植入密切相關[14]。妊娠早期,滋養層細胞生長迅速,并可侵襲子宮內膜、螺旋小動脈、肌層等,使正常基質層減少,血管內皮細胞增加,血管阻力降低,形成高氧分壓的血管網,并擔負著母胎之間營養物質供應、氣體交換等重任[15-16]。胎盤滋養層細胞分化、侵襲、黏附能力不足會導致胚胎血管生理性重鑄障礙、胚胎淺著床、胎盤供血供氧不足等,引發局部氧化應激反應,產生大量炎癥介質及毒性因子,引發胎兒血管內皮損傷、多系統受累等,最終導致不良妊娠結局的發生[17]。周小波等[18]研究發現子癇前期患者胎盤組織中滋養層細胞凋亡水平顯著高于正常孕婦,其凋亡的發生與線粒體自噬密切相關。T-cadherin 是細胞黏附分子家族成員,具有調節細胞黏附、聚集、遷移、識別及信號傳遞等作用[19-20]。研究顯示T-cadherin 是一種抑癌基因,在卵巢癌中表達降低,低表達的T-cadherin可促進卵巢癌細胞的增殖、侵襲、遷移等能力[21]。但關于T-cadherin 與人絨毛膜滋養層細胞的研究較少。本研究通過對HTR-8/SVneo 細胞轉染T-cadherin siRNA,結果顯示,與ox-LDL 組相比,T-cadherin siRNA 組HTR-8/SVneo 細胞中T-cadherin mRNA 表達水平顯著降低,表明T-cadherin siRNA 轉染效率較好,可進行后續實驗。
細胞凋亡相關蛋白Caspase-3、Bax、Bcl-2 的表達可側面反映細胞凋亡情況[22],侵襲遷移相關蛋白MMP-2、MMP-9表達水平與細胞的浸潤程度密切相關,MMP-2、MMP-9 表達水平越高表明細胞侵襲能力越強[23]。本研究結果顯示,與ox-LDL 組相比,Tcadherin siRNA組HTR-8/SVneo細胞增殖抑制率、凋亡率、Caspase-3、Bax 蛋白表達水平顯著降低,克隆形成率、侵襲、遷移能力、Bcl-2、MMP-2、MMP-9 蛋白表達水平顯著升高,提示低表達T-cadherin 可顯著抑制由ox-LDL 誘導的HTR-8/SVneo 細胞異常凋亡,對于治療妊娠期間HTR-8/SVneo 細胞異常凋亡引發的疾病具有一定的幫助。
綜上所述,本研究初步明確沉默T-cadherin 可顯著抑制ox-LDL 誘導的HTR-8/SVneo 細胞異常凋亡,并促進細胞的增殖、侵襲、遷移能力,但HTR-8/SVneo 細胞異常凋亡的機制復雜,關于維持HTR-8/SVneo細胞正常功能方面仍需深入研究。
Tab.3 Comparison of expression levels of Caspase-3,Bax,Bcl-2,MMP-2 and MMP-9 protein in HTR-8/SVneo cells between the four groups表3 各組HTR-8/SVneo細胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表達水平比較 (n=6,±s)
Tab.3 Comparison of expression levels of Caspase-3,Bax,Bcl-2,MMP-2 and MMP-9 protein in HTR-8/SVneo cells between the four groups表3 各組HTR-8/SVneo細胞Caspase-3、Bax、Bcl-2、MMP-2、MMP-9蛋白表達水平比較 (n=6,±s)
**P<0.01;a與空白對照組相比,b與ox-LDL組相比,c與T-cadherin siRNA陰性對照組相比,P<0.05。
組別空白對照組ox-LDL組T-cadherin siRNA陰性對照組T-cadherin siRNA組F Caspase-3 0.96±0.09 1.65±0.18a 1.62±0.17a 1.17±0.14bc 31.227**Bax 1.01±0.10 1.70±0.18a 1.72±0.19a 1.35±0.13bc 28.419**Bcl-2 1.03±0.09 0.21±0.02a 0.18±0.03a 0.66±0.07bc 274.909**MMP-2 1.02±0.11 0.26±0.04a 0.28±0.04a 0.73±0.08bc 150.516**MMP-9 0.97±0.12 0.31±0.04a 0.29±0.03a 0.72±0.07bc 120.541**

