創新藥醫保準入差異化管理國際經驗及啟示
顏建周 李大雙 任曉悅 曾添筑 丁文靜 邵 蓉
(中國藥科大學國際醫藥商學院 南京 211198)
近年來,我國不斷深化醫療保障制度改革,出臺了《關于深化醫療保障制度改革的意見》(中發〔2020〕5 號)、《基本醫療保險用藥管理暫行辦法(國家醫療保障局令第1 號)》(2020)等政策法規,明確了醫保目錄動態調整的基本原則和方式等,并組織開展了多次創新藥準入談判實踐,極大鼓勵了醫藥創新。自2017 年以來,共有近300 個創新藥通過醫保談判進入醫保目錄,平均降幅達到50%以上[1],大大加速了創新藥的醫保準入,提高了我國患者的創新藥可及性。
隨著我國醫藥創新能力的不斷提升,我國每年獲批和在研的新藥數量快速增長。2017 年—2021 年我國上市新藥總數達到328 個[2],處于上市審評或臨床試驗階段的在研新藥數量也屢創新高,預示著未來新藥上市數量將逐年持續增加。現行的醫保準入制度在鼓勵醫藥創新、保障用藥可及的同時,將面臨創新藥數量快速增長與醫保基金可負擔性的矛盾和挑戰。另一方面,我國創新藥同質化嚴重,大部分為Me-too 等創新程度較低的跟隨創新,真正做源頭創新的藥品較少。《“十四五”生物經濟發展規劃》明確提出,要提升生物醫藥原始創新能力,保障人民生命健康和國家生物安全[3],源頭創新被推向了我國生物醫藥發展戰略的新高度。
在新形勢下,迫切需要制度創新以平衡醫保基金持續健康發展與創新藥可及性之間的關系,同時從需求側引導醫藥產業創新方向,以創新驅動國家發展戰略。因此,探討我國創新藥醫保準入中基于創新程度不同,實施差異化醫保準入政策就具有重要的現實意義。
1 創新藥醫保準入差異化管理國際經驗
1.1 英國
1.1.1 ICER 閾值調整。英國依據藥品滿足患者需求情況、產品創新改進情況、藥品可替代性等方面對閾值進行適當的調整,對治療嚴重威脅生命的疾病的藥物和填補臨床需求的藥物、表現出更突出的治療創新性以及與其他藥品相比有更大改進的藥品設定更高的閾值,實現對高創新性高臨床價值的藥品在醫保準入階段的激勵。
2013 年英國國家衛生和臨床技術優化研究所(National Institute for Health and Clinical Excellence, NICE)開展了高度專業技術(Highly Specialized Technology,HST)評估計劃,針對超罕用藥(即在英國發病人數少于1000 或發病率≤1:50000 的罕見病治療藥物),首先對ICER 閾值進行調整,閾值放寬至10 萬英鎊/QALY,低于10 萬英鎊/QALY的超罕用藥可以直接準入醫保[4]。其次對每QALY 所需ICER 超過10萬英鎊的藥物進行QALY 權重調整,保障臨床療效突出藥品的醫保準入。例如,藥物A 在權重調整前每延長1 個QALY 需要11 萬英鎊,且相較于標準療法能夠延長18 個QALY,則藥物A 在權重調整后的ICER 為6.1 萬英鎊/QALY(11 萬英鎊/1.8=6.1 萬英鎊),符合HST模式下成本效果評估要求,允許直接進入醫保[5]。
1.1.2 風險分擔協議。英國自2009 年引入患者準入計劃(Patient Access Scheme,PAS),該計劃由制藥企業提出申請、由英國國家醫療服務體系(National Health Service,NHS)和企業達成風險分擔協議,為患者提供獲得高價創新藥的機會,并專門設立了患者準入計劃聯絡處負責該項政策實施[6]。
PAS 風險分擔方案有兩類,一是基于財務的風險分擔方案(Financial-Based Risk-Sharing Agreements,FBRSA),二是基于結果的風險分擔方案(Performance-Based Risk-Sharing Agreements,PBRSA)。FBRSA 的主要目標是控制預算影響,增強藥品可及性,主要的措施包括控制患者使用上限、控制費用上限及在開始階段提供折扣或免費治療等。PBRSA 的目標則是收集藥品真實使用數據、根據患者使用藥物的效果進行精準支付,采取基于療效付款或僅對參與研究的患者付費(見圖1)。
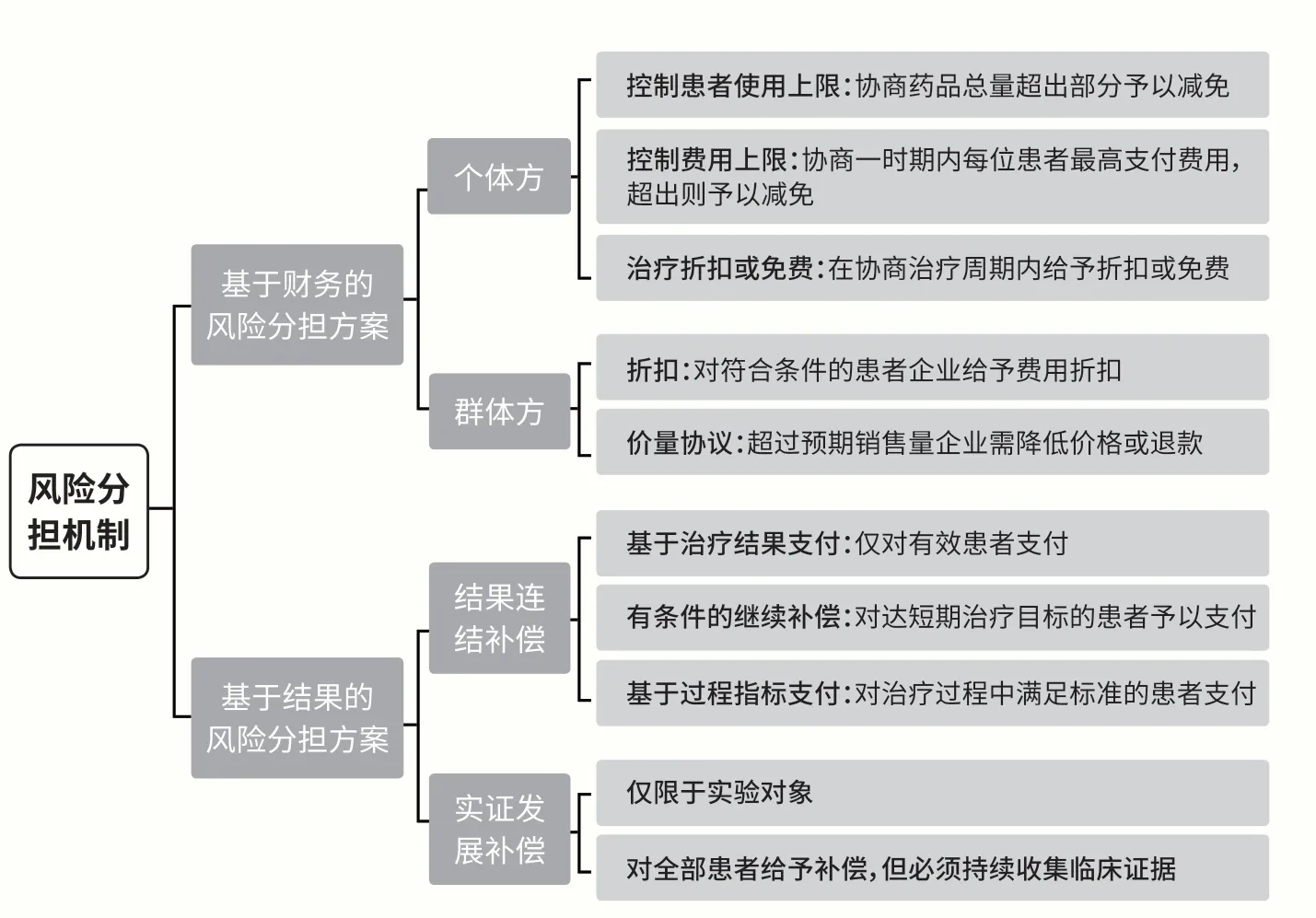
圖1 PAS 風險分擔方案
2019 年NHS 發布藥品商業框架(NHS Commercial Framework for Medicines),制定了更靈活的風險分擔協議,包括PAS、商業準入協議(Confidential Commercial Agreements,CAA)、管理準入協議(Managed Access Agreements,MAA)和預算影響測試(Budget Impact Test,BIT)四種途徑。除PAS 外,企業可根據自身條件和訴求選擇協議類型,如當制藥企業認為藥品價值相較于NICE 設定的成本效果閾值可以更高時、不同適應癥治療價值不同不適合統一價格的藥品時,可以簽訂CAA 協議,保證最大程度體現創新藥的創新價值和臨床價值。
1.1.3 不確定性管理。高創新性、高臨床價值創新藥在上市初期多基于Ⅱ期單臂臨床試驗的證據,在醫保準入過程中缺乏足夠臨床數據證明長期療效,此類藥品在醫保準入時往往存在一定的不確定性風險。為降低此類風險,“附條件批準-準入后再評價-基于再評價評估藥品價值”的動態調整機制被域外典型國家廣泛運用于醫保準入決策中。英國的癌癥藥物基金(Cancer Drugs Fund,CDF)會分擔創新抗癌藥準入NHS 的不確定性風險[7]。CDF 首先會評估藥品是否具有潛在的療效和成本效果以及是否可以通過補充數據降低不確定性,在評估通過后會與其簽訂數據收集協議及預算風險分擔協議,明確廠商在協議期內的義務,以降低因初始數據不足而造成的創新抗癌藥的不確定性風險。廠商在獲得CDF 基金準入后需開展相關研究并收集證據,最后協議到期后,NICE 將針對新收集的數據及證據重新評估抗癌藥品的ICER值,當ICER 值符合NHS 閾值時作出NHS 報銷準入的建議,若不滿足NHS 閾值要求,則作出拒絕準入的決策。在保證高創新性、高臨床價值的創新藥醫保準入的同時,降低醫保的不確定性風險(見圖2)。

圖2 英國癌癥基金會高值藥品準入管理流程
1.2 日本
1.2.1 定價機制。日本的新藥定價主要根據有無類似藥而采取類似藥定價法或成本定價法。如果醫保目錄已經收錄了類似的藥品,那么就采用類似藥比較法確定新藥的價格。厚生勞動省會根據藥品的創新程度增加一個溢價,而藥品的創新程度是根據以下四點判斷的[8]:①新的作用機制;②更高的療效或者安全性;③改善目標疾病的治療;④有益的藥物配方。溢價的比例會根據藥物創新程度有所不同,溢價范圍為5%—120%[9];對于獲得“先驅認定”(類似于我國的“突破性治療藥物”)且在日本優先上市的藥品,會直接給予10%—20%的溢價(見圖3)。

圖3 類似藥比較法的調整加價
對優先在日本上市且無合適參照藥的高創新性、高臨床價值創新藥會采取成本加成定價法,成本是指生產、管理、利潤等的費用加和,其中利潤會根據藥品創新程度有所不同,若創新程度較高,該藥物的利潤會在標準利潤率的基礎上進行上升調整。
1.2.2 ICER 閾值調整。為了緩解日益增長的醫療費用,日本自2012 年開始采用成本效益評估結果對醫保目錄中的藥品價格進行調整,根據現有的報銷水平、過去支付意愿調查結果、人均GDP 和各國基準值,試行期將500 萬日元/QALY、750 萬日元/QALY 和1000萬日元/QALY 作為基準值。而對于特殊藥品則會單獨設定基準值,如治療方法有限的罕見病、小兒疾病、惡性腫瘤等治療藥品基準值為750 萬日元/QALY、1125 萬日元/QALY、1500 萬日元/QALY[14]。對于填補了治療空白的創新藥品,會給予一個較高的基準值,有利于源頭創新藥品獲得較高的定價,激勵源頭創新藥品的研發。
1.3 澳大利亞
1.3.1 ICER 閾值調整。澳大利亞的藥品福利計劃(Pharmaceutical Benefits Scheme,PBS)目錄準入過程中,會基于多個原則和標準對ICER 閾值進行動態調整,包括臨床必需且無替代療法、具有顯著的臨床治療價值、藥品無報銷情況下患者負擔能力和“救援原則”[10]。救援原則主要包括目標患者病情嚴重進入生命終末期、藥物目標患者數量非常少兩個方面。澳大利亞目前仍然是以隱性閾值的方式進行成本效果的評估,并未公布明確的成本效果閾值,但通過明確閾值調整的基本原則和標準,也一定程度上保證了高創新性、高臨床價值等創新藥的準入靈活性(見圖4)。

圖4 澳大利亞ICER 閾值調整原則
1.3.2 風險分擔協議。澳大利亞的風險分擔協議包括兩種,分別是“基于臨床結果的協議”和“基于基金支出的協議”,基于費用的協議只關注藥品進入目錄后的費用支出與預算影響分析的差異,主要包括采取量價協議、折扣、劑量上限和費用上限等方式減少費用支出。基于臨床結果的協議則將報銷水平、價格與患者個體和群體的臨床效果相關聯,基于臨床療效調整藥品的準入和報銷水平、價格等[11]。
1.3.3 上市后審查。高創新性、高臨床價值創新藥在注冊上市階段往往缺乏足夠的臨床證據,在進行醫保準入決策時存在一定的不確定性,為加強對創新藥醫保準入后的持續監管,澳大利亞建立了藥品福利計劃準入后再審查制度[12]。為保證創新藥醫保準入后持續監測臨床效果和成本效果,藥品福利咨詢委員會(Pharmaceutical Benefits Advisory Committee,PBAC)將與藥企簽訂再審查的協議,在準入后藥企將持續開展相關研究,提供包括RCT 證據、真實世界證據等[13],實現包括管理藥品臨床效果和經濟性的不確定性、監測藥品的合理使用、提高藥品的使用質量等目標。
1.4 韓國
1.4.1 定價機制。韓國對申請進入醫保目錄的創新藥,其定價通常采用藥物經濟學評價和國際參考價的方法。對于有替代藥的,基于臨床療效選擇藥物經濟學評價、加權均價等方法確定,而對于無替代藥,尤其是針對罕見病、癌癥等高創新性、高臨床價值的創新藥,則會采取7 國(美國、日本、德國、法國、瑞士、英國、意大利)調整最低價或者平均價[14](見圖5)。

圖5 韓國新藥支付價制定辦法
1.4.2 ICER 閾值調整。韓國目前尚未頒布官方的ICER 閾值,基于過往決策實踐經驗的隱性閾值約為23124 美元/QALY(約合1 倍人均GDP)[15]。對用來治療嚴重的癌癥、罕見病等生命末期患者且替代程度較低的高創新性、高臨床價值藥物,韓國給予了更高的閾值,如重大疾病、嚴重疾病、無替代療法和限制性替代療法藥品分別平均提高閾值1700 萬、1400 萬、1200萬、800 萬韓元/QALY。
1.4.3 風險分擔協議。2014 年起,韓國針對高創新性藥品缺乏足夠成本效果或循證證據,引入了風險分擔協議機制[16]。實行風險分擔協議的創新藥有較明確的遴選條件:無替代或無等效的抗腫瘤藥物;對生命有威脅的罕見病的藥品;由韓國藥物補償評價委員會(Drug Reimbursement Evaluation Committee,DREC)基于藥品創新性和臨床價值、疾病的嚴重程度、社會影響及對衛生保健帶來的影響指定的其他藥物。
韓國風險分擔協議方案(Risksharing Agreements,RSA)形式多樣,包括根據治療效果決定報銷情況,若患者治療達到閾值目標,則可繼續治療并獲得藥費的報銷,反之藥企則返還醫保報銷的藥費;對最高的藥品預算進行封頂,如對抗腫瘤藥物或罕見病藥物銷售額度超過原先談判設定期望目標用量的130%;資金返還,即超過預先確定的醫保報銷費用時需要返還資金;對每個病人的藥品費用封頂,該方法根據預設的銷售量或醫保報銷的人數支付,如超過限額按百分比進行費用返還[17]。
2 啟示和建議
2.1 藥品創新等級劃分
基于前述我國醫藥創新的現狀和國家戰略方向,可將新藥劃分為源頭創新藥品和非源頭創新藥品。由于這是我國特有的一個發展階段,國際上尚無對于源頭創新明確、統一的定義和認定標準。
從科學性角度,源頭創新一般是指新靶點、新結構、新機制,但在醫保評審過程中很難進行準確判斷。在當前醫保準入體系中,對重大創新的認定常用重大新藥創制專項,然而重大新藥創制專項在2020年已收官,之后的藥品已無機會進行專項的申報。另外,醫保更關注的是可以填補治療空白或帶來顯著臨床改善的藥品,藥品審評中心(Center for Drug Evaluation,CDE)“突破性治療藥物”的認定標準與此高度一致,同時借鑒日本的做法,建議對于2020 年之后上市的藥品使用“突破性治療藥物”作為源頭創新的認定標準。藥品評審報告數據顯示,在2020 年—2021 年所有申請“突破性治療藥物”的藥物中,僅有18.8%能夠最終成功獲得該認定[18,19]。由此可見,能夠獲得“突破性治療藥物”認定的藥物數量遠少于Ⅰ類新藥,這也能夠確保基于該創新分類的差異化管理不會帶來醫保基金支出的顯著增加。
2.2 基于創新程度差異化設置創新藥醫保準入政策
為構建與醫藥創新發展相匹配的醫保準入政策,建議我國探索在綜合評審、價格測算等階段針對源頭創新藥品設置差異化的醫保準入政策和標準。
在綜合評審階段:(1)源頭創新藥品因其臨床急需性,往往會被納入優先審評審批,在醫保準入機制中,也應將源頭創新藥品優先納入醫保藥品準入談判范圍,給予談判資格,以更快地讓患者獲益;(2)差異化設置評審維度的權重,對于源頭創新藥品,適當增加其創新性指標權重。
在價格測算階段:(1)源頭創新藥品往往在剛上市時臨床研究數據有限,藥物經濟學研究缺乏合適參照藥,可適當簡化或豁免CEA等申報材料;(2)在現有基礎上,探索基于創新程度、臨床價值的提升、填補臨床空白等因素給予源頭創新藥品一定的溢價,比如適當提高ICER 閾值等;(3)針對經過預算影響評估后被認定為基金影響有限的源頭創新藥品,探索實施先準入、后評價、再動態調整的醫保動態調整機制。
2.3 降低源頭創新藥品醫保準入的不確定性風險
源頭創新藥品的創新程度顯著高于其他品種,較多基于單臂臨床試驗證據進行附條件批準上市,因而無法在上市前完整收集與參照藥品頭對頭的系統性臨床研究數據,導致療效和安全性的對比數據不足,使得源頭創新藥品準入醫保目錄時存在一定的不確定性,增加了醫保談判準入中的決策風險。為降低相關風險,建議我國探索以源頭創新藥品為試點對象,構建基于附條件準入的創新藥醫保準入機制,在提高源頭創新藥品可及性、激勵創新藥物研發的同時,有效降低因評價證據的有限性帶來的醫保準入不確定性風險。
在實施層面可以分四個階段有序開展:(1)在醫保初始談判階段,由綜合組、藥經測算組和基金測算組專家確定因證據不足導致的不確定性問題,匯總后由醫保部門反饋至企業;(2)在協議簽訂階段,除藥品支付標準協議外,醫保部門還應與企業簽訂關于不確定性問題解決的義務協議,即企業承諾在規定期限內按照要求完成相關研究,用于降低藥品初始準入時的不確定性;(3)在協議期內,企業應履行不確定性問題的解決義務,積極開展臨床研究、真實世界研究及準入后風險管理研究,并接受藥品審評中心的監督管理;(4)在續約準入階段,企業應提交補充研究材料并對不確定性問題進行說明,醫保部門據此和自己掌握的資料對續約藥品進行再評價,并將評價結果作為是否續約及確定續約支付標準的依據之一。
2.4 發揮多層次醫療保障體系支持創新的作用
我國是世界上最大的發展中國家,經濟增長較快但整體水平仍然不高,社會經濟承受能力有限,因而基本醫療保險籌資水平較低,保障能力有限。為滿足人民群眾日益增長的多層次醫療保障需求,我國出臺了《“健康中國”2030 規劃綱要》(2016)、《中共中央 國務院關于深化醫療保障制度改革的意見》(中發〔2020〕5 號)等政策法規,推動構建以基本醫療保險為主體,醫療救助為托底,補充醫療保險、商業健康保險、慈善捐贈、醫療互助共同發展的多層次醫療保障制度體系。
對于高創新價值、高臨床價值的源頭創新藥品,如果預算影響分析結果顯示確實超出醫保基金承受能力的,可以探索多層次醫療保障制度相互銜接、共同承擔的保障體系。如在量價協議中引入商業健康保險,規定超出風險點的部分由商業健康保險支付、充分發揮惠民保等城市定制型商業健康保險的補充作用、引入醫療救助和醫療互助對源頭創新藥品共同支付等。通過構建多層次醫療保障體系,拓寬源頭創新藥品支付渠道,在降低醫保基金壓力的同時,提高源頭創新藥品的可及性。
2.5 重視醫保談判定價對本土源頭創新藥品國際化發展的影響
因創新藥在上市初期難以形成臨床價值與價格之間的對應關系,其定價以及價格的管理顯得尤為重要。目前國際上存在包括外部參考定價在內的多種藥品定價機制,采取外部參考定價的國家有美國、加拿大、日本、部分歐盟成員國等。外部參考定價主要利用多個國家的藥品價格為依據制定藥品價格,能夠提高藥品價格的適宜性,在一定程度上降低決策風險。因此,外部參考定價正被越來越多的國家所使用。我國在醫保準入決策過程中,亦會參考該藥品在發達國家及周邊國家/地區的價格。
經濟發展水平、地理位置、市場特征等是大部分國家確定參考國的主要考量因素,部分國家如盧森堡會將原產國的價格作為重要參考依據。短期之內,隨著我國創新藥價格對國際市場價格的影響逐步加大,因為地理位置、醫療保險模式、創新能力等原因,我國創新藥尤其本土創新藥的價格將會被日本、韓國等周邊國家以及以原產國價格為參考的國家納入參考范圍,從而影響國際藥品價格的形成。從長期來看,隨著我國經濟發展水平的進一步提升、醫藥政策的逐步完善,我國將逐步被加拿大、法國、德國等醫藥產業發達國家納入“參考籃子”,我國創新藥品的國際影響力將進一步加大。以中國作為“首發國”的本土源頭創新藥品在我國的價格不僅影響國內市場的發展,未來也會影響國際市場的定價策略。因此,建議在醫保準入環節將本土源頭創新藥品是否進軍海外市場、參與國際競爭等因素適當納入考慮范疇,推動本土源頭創新藥品以更加合理的價格尋求海外發展,在價格方面“不輸在起跑線上”。

