高超二倍體核型兒童急性淋巴細胞白血病的臨床特征及預后
——福建省多中心回顧性研究
蔡春霞 鄭湧智 李健 溫紅 翁開枝 莊樹銓 吳興國 樂少華
(1.福建醫科大學附屬協和醫院小兒血液科,福建省血液病研究所,福建省血液病學重點實驗室,福建福州 350001;2.廈門大學附屬第一醫院,福建廈門 361000;3.福建醫科大學附屬漳州市醫院,福建漳州 363000;4.福建醫科大學附屬泉州第一醫院,福建泉州 362000;5.福建省南平市第一醫院,福建南平 353000)
急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)是兒童時期最常見的惡性腫瘤,隨著危險度分層的日趨精準、支持治療的不斷增強及對特殊融合基因亞型的靶向治療,目前兒童ALL的長期生存率已達到85%以上[1]。染色體核型獲得性改變是白血病細胞的主要特征之一,是危險度分層的主要依據之一,其中高超二倍體(high hyperdiploid,HHD)是兒童ALL最常見的染色體核型改變,也是其良好預后的標記[2]。但是,ALL異質性大,即使同為HHD亞型,不同的染色體增加或染色體增加數目不同,其基因組圖譜及預后也存在差異[3-4]。目前國內對伴HHD ALL的大樣本研究仍較少[5-6],而且僅作為兒童ALL一個亞型,討論其對預后的影響,而未對該亞型的臨床特征及預后因素進一步分析。本研究通過回顧性分析HHD ALL患兒的臨床特征及預后影響因素,探討更為合理的治療方案以進一步提高該亞型ALL患兒的生存率提供依據。
1 資料與方法
1.1 研究對象
福建省主要收治新診斷兒童ALL的醫院有5家,分別為福建醫科大學附屬協和醫院、廈門大學附屬第一醫院、福建醫科大學附屬漳州市醫院、福建醫科大學附屬泉州第一醫院、福建省南平市第一醫院,選擇上述5家醫院在2011年4月—2020年12月初診的1 414例ALL作為研究對象。納入標準:(1)起病年齡>1個月且≤14歲;(2)臨床表現符合ALL,并經骨髓細胞形態學、免疫分型、細胞遺傳學及分子生物學等檢查明確診斷[5];(3)初發患兒(來院就診前未經過任何ALL相關治療)。該研究已通過福建醫科大學附屬協和醫院倫理委員會批準并免除知情同意(2022IY172)。
1.2 染色體核型及HHD的診斷標準
所有患兒均進行骨髓細胞形態學、免疫分型、分子生物學(白血病相關融合基因)及細胞遺傳學(染色體核型)等檢查。免疫分型、分子生物學(白血病相關融合基因)及細胞遺傳學(染色體核型)等檢測均在北京海思特醫學檢驗實驗室進行,方法如下:取患兒治療前新鮮骨髓3~5 mL,用1640培養基+20%胎牛血清培養細胞24 h;0.4 μg/mL秋水仙酰胺處理1 h;離心去上清,0.4%氯化鉀溶液低滲處理40 min;10%體積固定液(甲醇∶乙酸=3∶1)進行預固定,混勻;固定液清洗3次;20 cm高度滴片;37℃老化過夜;75℃烤片3 h,0.05%胰酶處理30 s,清洗,吉姆薩染色4 min,掃描。核型描述依據人類細胞遺傳學國際命名體制2005(ISCN2005)[7]。在至少3個中期分裂相細胞中發現染色體數目>50即診斷為HHD。按是否伴HHD,分為伴HHD組(172例)和不伴HHD組(1 242例)。
1.3 伴HHD組治療方案及危險度分層
伴HHD組中,108例治療方案、危險分層、療效評價采用中國兒童白血病協作組-ALL 2008(Chinese Children Leukemia Group, CCLG-ALL 2008)方案治療[2],64例治療方案、危險分層、療效評價采用中國兒童腫瘤協作組-ALL 2015(Chinese Children's Cancer Group,CCCG-ALL 2015)方案[8]。兩種化療方案的對比及對嚴重不良事件(severe adverse event,SAE)的定義參照文獻[9]。
1.4 微小殘留病檢測
本研究中患兒在誘導化療期間使用流式細胞術監測微小殘留病(minimal residual disease,MRD),其中接受CCLG-ALL 2008方案治療的患兒在誘導化療第15天及第33天評估骨髓MRD;而接受CCCG-ALL 2015方案的患兒在誘導化療第19天及第46天評估骨髓MRD。
1.5 隨訪
所有患兒通過門診復查或電話進行隨訪,隨訪截至2021年12月31日。中位隨訪時間為48.3(范圍:0.7~126.0) 個月。總生存 (overall survival,OS)期為患兒開始治療至死亡或最后隨訪的時間;無事件生存(event-free survival,EFS)期為開始治療到發生任何事件的時間,包括任何原因所致死亡、疾病進展、復發或失訪。7例接受CCLG-ALL 2008方案的患兒,因治療中(病情無惡化)主動放棄治療或轉院,未納入預后分析。觀察患兒一般情況、復發及干預措施、生存情況,監測骨髓細胞形態學、骨髓MRD等。
1.6 統計學分析
采用SPSS 25.0軟件進行統計分析。計數資料用例數和率(%)表示,組間比較采用χ2檢驗或Fisher確切概率法。非正態分布計量資料用中位數(范圍)表示。采用Kaplan-Meier法估計生存率,log-rank檢驗分析各臨床因素對EFS率及OS率的影響。多因素分析采用Cox比例風險回歸模型。P<0.05為差異有統計學意義。
2 結果
2.1 臨床特征及早期治療反應
1 414例ALL患兒中,172例(12.16%)檢出HHD。伴HHD組中,115例(66.9%)染色體數目為 51~57,46例 (26.7%) 染色體數目為 58~67,11例(6.4%)染色體數目>67;染色體數目增加以+21最為常見 (91.9%,158/172),其次為+4(65.1%,112/172)和+14(61.0%,105/172);57例(33.1%)除了染色體數目增加,還伴有其他核型異常。伴HHD組初診有不良預后危險因素(起病年齡≥10歲或<1歲、初診白細胞計數≥50×109/L、T細胞表型)、常見融合基因陽性(TELAML1、BCR-ABL1、E2A-PBX1、MLL基因重排)的患兒比例均低于不伴HHD組(均P<0.05),而誘導化療第33天或第46天骨髓MRD<0.01%的患兒比例高于不伴HHD組(P<0.05)。見表1。
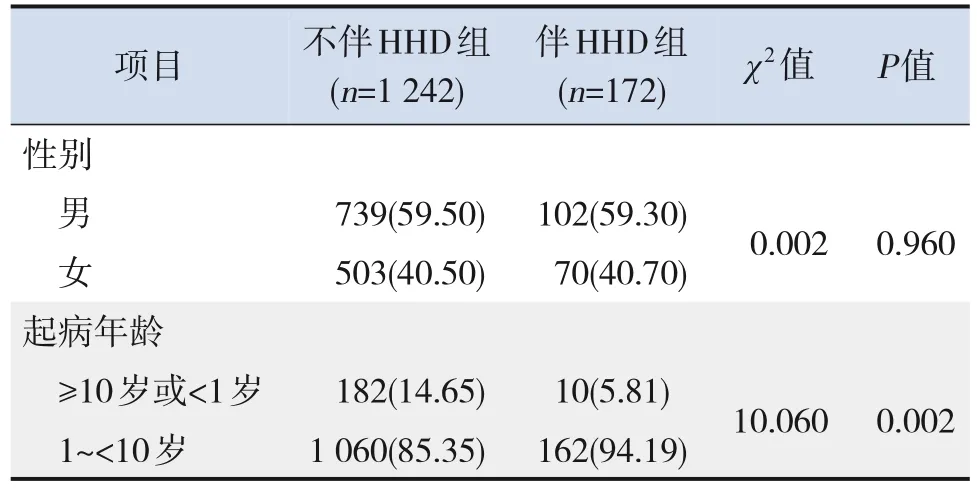
表1 伴HHD組和不伴HHD組的臨床特征及早期治療反應比較 [n(%)]
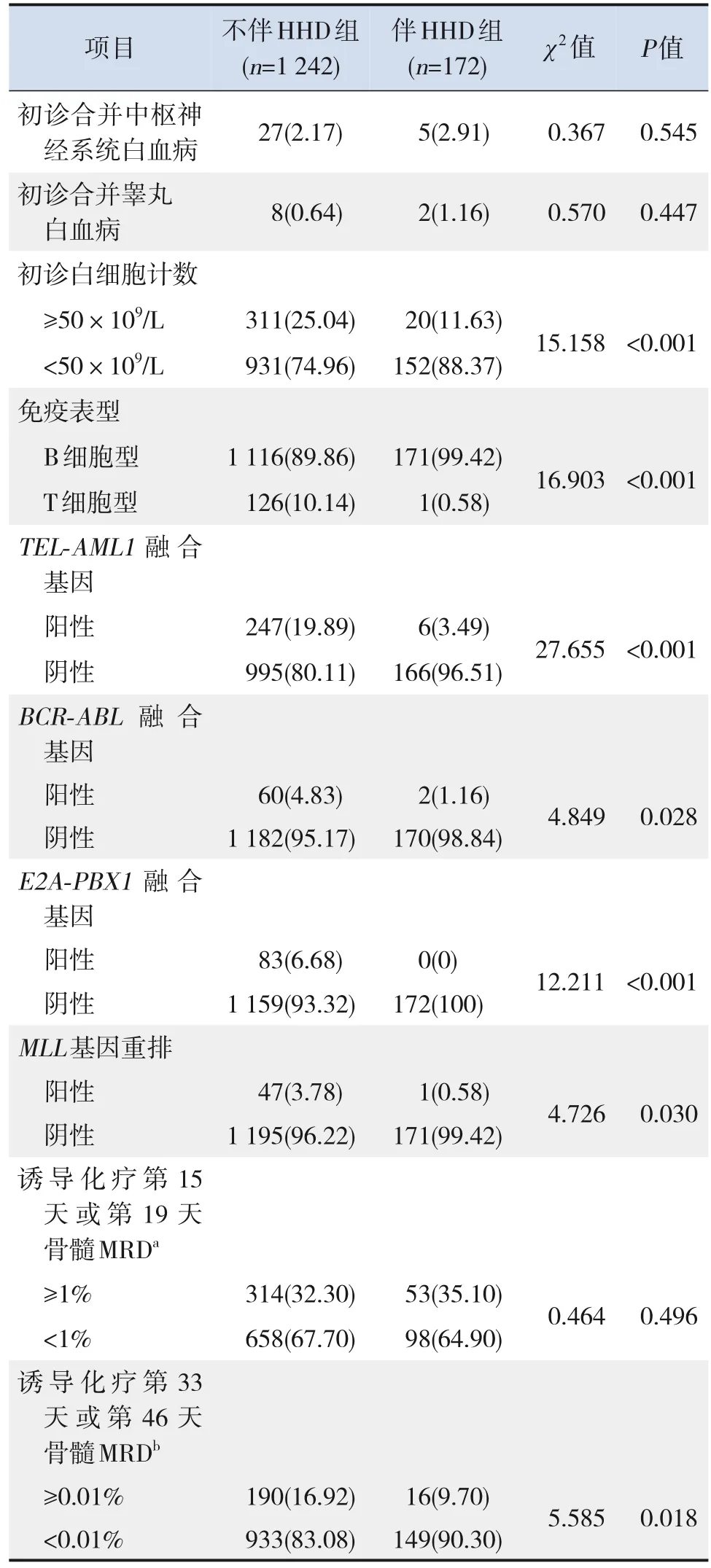
表1(續)
2.2 隨訪結局及遠期療效
172例伴HHD組中,6例(3.5%)在病情惡化前主動放棄,1例(0.6%)在治療中轉院治療;余165例(95.9%)(均為B-ALL)規范治療。153例(89.0%)截至最后隨訪時間仍EFS,3例(1.7%)發生化療相關死亡(死因均為重癥感染),9例(5.2%)復發,中位復發時間17.3(范圍:4.1~58.0)個月。伴HHD組預期10年EFS率(87.5%±2.8% vs 74.8%±1.5%,P=0.002) 及 OS 率(91.6%±2.6% vs 80.8%±1.4%,P=0.002)均高于不伴HHD組。剔除病情惡化前主動放棄或轉院的89例ALL患兒,伴HHD組的預期10年EFS率(91.3%±2.6% vs 80.7%±1.3%,P=0.003)及OS率(94.9%±2.3% vs 83.9%±1.3%,P=0.001)亦均高于不伴HHD組。見圖1。
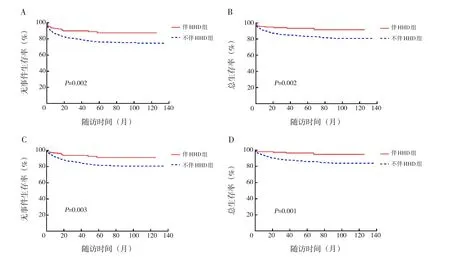
圖1 伴或不伴HHD ALL患兒的生存曲線 圖A為伴HHD組和不伴HHD組預期10年EFS率比較圖;圖B為伴HHD組和不伴HHD組預期10年OS率比較圖;圖C為剔除主動放棄或轉院89例ALL患兒,伴HHD組和不伴HHD組預期10年EFS率比較圖;圖D為剔除主動放棄或轉院89例ALL患兒,伴HHD組和不伴HHD組預期10年OS率比較圖。
2.3 預后影響因素分析
對165例規范治療的伴HHD ALL患兒進行單因素預后分析(表2),結果顯示,染色體數目58~66、10號染色體三體、17號染色體三體、誘導化療第15天或第19天骨髓MRD<1%、誘導化療第33天或第46天骨髓MRD<0.01%是高EFS率的影響因素(均P<0.05),而性別、起病年齡、初診白細胞計數、4號染色體三體、11號染色體三體、18號染色體三體對EFS率無顯著性影響(均P>0.05);10號染色體三體是高OS率的影響因素(P<0.05),而其他因素對OS率均無顯著性影響(均P>0.05)。
對EFS率單因素分析中差異有統計學意義的影響因素進一步行Cox比例風險回歸模型分析,結果顯示,17號染色體三體是高EFS率的獨立影響因素 (HR=0.090,95%CI:0.011~0.736,P=0.025),見表3。
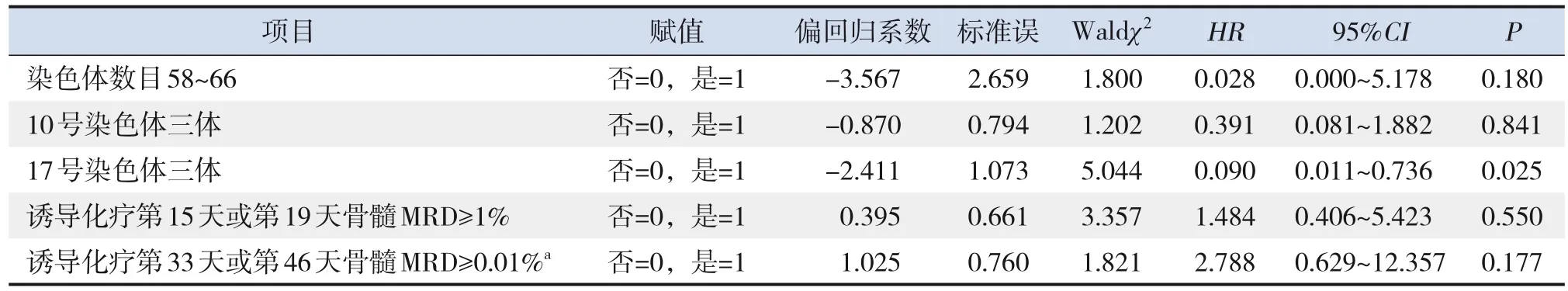
表3 165例規范治療的伴HHD ALL患兒EFS率的Cox比例風險回歸模型分析
2.4 不同治療方案治療的療效及SAE發生率
101例接受CCLG-ALL 2008規范治療的患兒中,46例(45.5%)按低危方案,38例(37.6%)按中危方案,17例(16.8%)按高危方案;28例(27.7%)發生SAE,其中20例發生感染相關SAE(12例血流感染,4例重癥肺炎,2例深部真菌感染,1例腸道感染相關腸梗阻,1例闌尾炎),8例非感染相關SAE(6例門冬酰胺酶相關胰腺炎,2例培門冬酶嚴重過敏反應),3例發生化療相關死亡。64例接受CCCG-ALL 2015方案規范治療的患兒中,43例(67.2%)按低危方案,21例(32.8%)按中危方案;9例(14.1%)發生SAE,其中5例發生感染相關SAE(4例血流感染,1例深部真菌感染),4例發生非感染相關SAE(門冬酰胺酶相關胰腺炎),無化療相關死亡病例。與接受CCLGALL 2008方案的患兒相比,接受CCCG-ALL 2015方案的患兒SAE(14.1% vs 27.7%,χ2=4.202,P=0.040) 及感染相關 SAE (19.8% vs 7.8%,χ2=4.380,P=0.036)發生率均更低,而預期5年EFS率 (100%±0% vs 87.5%±3.4%,χ2=6.624,P=0.010)、OS率(100%±0% vs 93.3%±2.7%,χ2=2.581,P=0.108)均更高,見圖2。
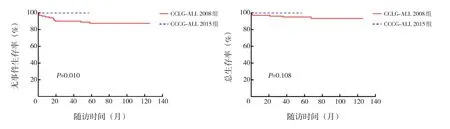
圖2 165例HHD ALL患兒中接受CCLG-ALL 2008方案(101例)和CCCG-ALL 2015方案(64例)的EFS率和OS率比較
3 討論
關于HHD的定義,不同研究定義略有不同,較多國外研究定義為染色體數目為51~67[10-11],也有定義為51~65或51~66或51~68[12-14];日本一項大樣本研究[4]及國內較多研究[5-6]及中國《兒童急性淋巴細胞白血病診療建議(第四次修訂)》[2]均將HHD定義為染色體數目>50,這也是本研究對HHD定義的依據。
HHD在不同兒童ALL研究中的檢出率有所不同。歐美國家報道:HHD在兒童ALL中的發生率為 20%~38%[12-13,15]。但日本的一項研究顯示,HHD在兒童ALL中的檢出率僅為12.8%[4]。國內報道HHD在兒童ALL的檢出率差異較大:一項來自武漢某醫院的研究檢出率為23.8%[16];一項天津某醫院研究的檢出率為8.9%[6];另有一項上海某醫院的檢出率為10.89%[17]。一項薈萃分析[18]顯示,東亞兒童ALL中HHD的檢出率顯著低于歐美國家(14.3% vs 25.2%,P<0.001)。本研究中,HHD的檢出率為12.2%,與日本[4]及我國研究結果[17]相似。
本研究中 HHD 以+4、+6、+10、+14、+17、+18、+21、+X染色體最為常見,染色體數目以51~57最為常見,初診時伴有不良預后危險因素(起病年齡≥10歲或<1歲、初診白細胞計數≥50×109/L、T細胞表型)患兒比例較低,早期治療反應好,長期生存率高于90%,這與文獻報道[3-4,10,12,14]相一致。
關于HHD的預后影響因素,不同研究報道結果不盡相同。美國兒童癌癥協作組研究[14]顯示,染色體數目54~58、+10、+17、+18是預后良好的指標,而+5是預后不良的指標。美國兒童癌癥協作組和兒童腫瘤協作組的共同研究[19]顯示,特定染色體三體(4、10、17)是HHD預后的獨立危險因素,而染色體數目≥53并非HHD預后的獨立危險因素。英國的一項研究顯示,年齡1~9歲、女性、+4、+18是預后良好獨立影響因素,尤其是在年齡≥10歲組,同時伴+4和+18者EFS率顯著提高[12]。英國另外一項研究顯示,+5、+17、+18、+20是影響HHD預后的危險因素,其中+17或+18且不伴有+5和+20是預后良好的影響因素[20]。德國的一項研究顯示,白細胞計數≥50×109/L和誘導化療第29天未達完全緩解是低EFS率及OS率的危險因素,而+4、+17、+18、+22染色體是高EFS率的影響因素[10]。日本的一項研究顯示,+11、+17是預后良好的影響因素[4]。歐洲的多中心研究顯示,染色體數目58~66、特定染色體三體(+4、+10、+17、+18)均與良好預后相關,其中染色體數目58~66是最相關的預后影響因素[3]。從以上研究可以看出,特定染色體三體及染色體數目是HHD預后最重要的影響因素。本研究顯示,+10、+17、染色體數目58~66、誘導化療中及結束時低MRD水平與高EFS率及OS率顯著相關,這與上述報道結果相符;但+11、+18對預后無顯著影響,與上述研究結果不一致,可能與樣本量大小、治療方案或種族不同有關。
化療強度高及粒細胞缺乏時間長是發生感染相關SAE最重要的危險因素,而感染正是兒童ALL化療相關死亡最常見的原因[21]。HHD復發率低,因此通過減低化療強度,在不影響生存率情況下,降低SAE及治療相關死亡,是進一步提高該亞型的主要思路[22]。許鳳玲等[8]報道了 CCCG-ALL 2015方案SAE的單中心研究,SAE發生率為7.6%。潘麗麗等[9]報道,相比于CCLG-ALL 2008方案,CCCG-ALL 2015方案能顯著降低感染相關SAE發生率(10.6% vs 22.4%,P=0.001)。本研究中,與CCLG-ALL 2008方案相比,CCCG-ALL 2015方案在不提高復發率情況下,顯著降低了SAE發生率,尤其是感染相關SAE的發生率,并且未出現化療相關死亡病例,分析其原因與其減低總體化療強度有關。如初診危險度分層,在CCLG-ALL 2008方案中,需要同時滿足HHD、起病年齡1~10歲、初診白細胞計數<50×109/L才劃分為低危型,而在CCCG-ALL 2015方案中,只要是HHD,不論起病年齡及初診白細胞計數,均劃分為低危型;另外,對于中危型,在誘導緩解階段,CCLG-ALL 2008方案的3~4次柔紅霉素減量為2次,縮短了誘導期間中性粒細胞缺乏的持續時間,這樣就避免了發生重癥感染最常見的誘導第3周柔紅霉素的使用。
綜上所述,本研究發現伴HHD組初診時不良預后危險因素較少,早期治療反應較好,復發率低,總體預后良好;10號染色體三體、17號染色體三體、誘導化療中及結束時低MRD水平與高EFS率及OS率相關;而通過適當減低化療強度的CCCG-ALL 2015,比CCLG-ALL 2008方案有更低的感染相關SAE及治療相關病死率,可能進一步提高該亞型ALL患兒的長期生存率。
利益沖突聲明:所有作者均聲明不存在利益沖突關系。

