多組學分析眾麥1號和糯麥116兩種制曲小麥的特征
張原頔,陳小雪,吳 鵬,史利霞,韓北忠
(1.中國農業大學 食品科學與營養工程學院 食品質量與安全北京實驗室,北京 100083;2.中國農業大學 營養與健康系,北京 100083;3.河南順鑫大眾種業有限公司,河南 鄭州 450003)
小麥是白酒固態釀造糖化發酵劑—高溫和中溫大曲的主要原料,富含淀粉、蛋白質和多種維生素,為發酵微生物產酶和代謝提供營養基質和發酵微環境[1]。微生物可以利用小麥中的淀粉和蛋白質等組分產生風味物質[2],因此,不同理化特性尤其是營養組分含量不同的小麥影響大曲的品質。以小麥為原料的制曲過程對小麥籽粒的營養組分含量均有一定的要求,如需要較高的淀粉含量,蛋白質含量在12%左右,含有適量的無機鹽、纖維素等[3]。不同的淀粉含量對制曲過程中的水分、酸度、淀粉、糖化力、液化力、發酵力和主要微生物類群均可以產生一定的影響[4]。
小麥源微生物是影響小麥制曲的另一重要因素,DU H等[5]研究發現,制曲原料是大曲菌群的重要來源之一,不同原料顯著影響微生物的代謝物譜;LIU C C等[6]研究發現,原料中的糖譜能調節發酵過程中產風味菌群的演替進而影響風味代謝物的產生;ZHANG Y D等[7]研究發現,小麥源微生物參與高溫大曲培菌初期菌群的組裝并影響初期代謝物的形成。因此,關注制曲原料源微生物有助于理解原料的選擇對大曲品質的影響作用。
本研究通過理化檢測、高通量測序、頂空固相微萃取-氣相色譜-質譜聯用(headspace solid phase microextractiongas chromatography-mass spectrometry,HS-SPME-GC-MS)和氣相色譜-離子遷移譜聯用(gaschromatography-ionmobility spectroscopy,GC-IMS)技術比較了兩種制曲小麥(ZW1和N116)的理化性質、微生物組成和風味輪廓的差異,為優選制曲原料提供理論支撐。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
小麥樣品:小麥樣品采集于河南某種業公司,所采集的兩個品種小麥分別是眾麥1號(ZW1)和糯麥116(N116),兩種小麥均在糧食倉庫存放,在不同位置分別取3份裝于無菌袋,-80 ℃保存。
1.1.2 主要試劑
土壤基因組試劑盒:美國Omega Bio-Tek公司;ExTaq脫氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:美國英杰生命技術有限公司。其他試劑均為國產分析純。
1.2 儀器與設備
NR10QC色差儀:深圳市三思時科技有限翁司;BSA2202S電子天平:賽多利斯科學儀器(北京)有限公司;KDN-08凱氏定氮儀:上海新嘉電子有限公司;UV-1200型紫外可見分光光度計:上海美普達儀器有限公司;S-433D氨基酸分析儀:德國Sykam公司;FlavourSpec風味分析儀:德國GAS公司;7000-3氣質聯用儀、HP-5ms色譜柱(30 m×250 μm×0.25 μm):美國安捷倫公司。
1.3 方法
1.3.1 理化指標的檢測
色度值:兩個品種的小麥經人工去雜,剔除病害、雜粒和不飽滿粒后,稱取30 g籽粒,用色差計測量顏色參數。色差計先用白板校正,將種子倒滿測量平皿,用直尺沿平皿表面刮平后進行測量,獲得L*值、a*值、b*值,L*值越大,顏色越亮(白);a*值越大,顏色越偏紅色;b*值越大,顏色越偏黃色。
淀粉含量測定:參考國標GB 5009.9—2016《食品中淀粉的測定》;支鏈淀粉含量測定:參考國標GB/T 15683—2008《大米直鏈淀粉含量的測定》;蛋白質含量測定:參考國標GB 5009.5—2016《食品中蛋白質的測定》;脂肪含量測定:參考國標GB 5009.6—2016《食品中脂肪的測定》;單寧含量測定:參考國標GB/T 15686—2008《高粱單寧含量的測定》。
1.3.2 高通量測序
小麥粉碎后,采用OMEGA Soil DNA Kit提取微生物基因組,DNA質檢合格后,以其為模板對細菌的16S rDNA V5-V7區基因序列及真菌的ITS區基因序列進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增,細菌的PCR擴增引物為799F(5'-AACMGGATTAGATACCCKG-3')和1193R(5'-ACGTCATCCCCACCTTCC-3'),真菌的PCR擴增引物為ITS5F(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS1R(5'-GCTGCGTTCTTCATCGATGC-3')。PCR擴增體系(25 μL):5×reaction buffer 5 μL,5×GC buffer 5 μL,脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)2 μL,上下游引物(10 μmmol/L)各1 μL,DNA模板2μL,雙蒸水(ddH2O)8.75μL,Q5DNAPolymerase 0.25μL。其余條件參照ZHANG Y D等[7]的方法。采用1%瓊脂糖凝膠電泳對PCR擴增產物進行檢測,將檢驗合格的PCR擴增產物送至上海派森諾生物技術有限公司進行高通量測序。
1.3.3 生信分析
采用Illumina平臺對DNA片段進行雙端測序,使用DADA2方法對序列進行去引物,質量過濾,去噪,拼接和去嵌合體,合并擴增子序列變異體(amplicon sequence variants,ASVs)特征序列和ASV表格,并去除singletons ASVs,基于相應功能基因的seeds蛋白序列,對核酸序列中的插入和缺失錯誤進行糾正。小麥源細菌16S rRNA基因在Greengenes數據庫進行對比注釋,真菌通過Unite 8數據庫對比注釋。使用QIIME2(2019.4)軟件對微生物進行物種組成分析,以樹圖的形式繪制微生物分類等級樹。使用PICRUSt 2軟件預測樣本功能豐度[8]。
1.3.4 風味物質檢測
不同品種小麥的風味物質通過頂空固相微萃取-氣相色譜-質譜聯用(HS-SPME-GC-MS)結合氣相色譜-離子遷移譜聯用(GC-IMS)技術檢測分析。
HS-SPME-GC-MS檢測:稱取小麥粉4.0 g,加入16.0 mL超純水,超聲30 min,8 000×g離心10 min,取上清8 mL,加入3.0 g氯化鈉。具體分析條件參考胡雨楠等[9]的方法。利用Agilent Masshunter Qualitative Analysis 10依據美國國家標準技術研究所(national institute of standards and technology,NIST)14標準譜庫對揮發性風味物質進行定性分析。利用SIMCA 14.0 軟件對GC-MS結果進行正交偏最小二乘法判別分析(orthogonal partial least-squares discriminate analysis,OPLS-DA)篩選差異代謝物,并通過Prism 8和R-Studio v 4.1.1進行數據處理和可視化分析。
GC-IMS檢測:稱取小麥粉水提液2.0 mL,置于20 mL頂空瓶中,80 ℃孵育20 min后進樣分析。分析條件:分析時間20 min,MXT-5色譜柱(15 m×0.53 mm×1.0 μm),柱溫60 ℃,載氣為氮氣(N2),IMS溫度45 ℃,進樣體積500 μL,孵育時間20min,孵育溫度80℃,進樣針溫度85℃,孵化轉速500r/min,流速起始為2 mL/min,10 min后流速升至10 mL/min[10]。使用VOCal查看分析譜圖和數據的定性定量,通過軟件內置的NIST數據庫和IMS數據庫對物質進行定性分析;使用Reporter插件對比樣品之間的譜圖差異;使用Gallery Plot插件進行指紋圖譜對比,比較不同樣品之間的揮發性有機物差異。
1.3.5 數據處理
理化檢測結果通過Prism 8進行t檢驗,計算樣品間的差異顯著性(P<0.05),數據可視化主要通過R studio v4.1.1完成。
2 結果與分析
2.1 不同品種小麥籽粒表皮的色度值
兩個品種小麥籽粒表皮的顏色參數見圖1。由圖1可知,兩個品種的小麥籽粒表皮顏色存在顯著差異,ZW1小麥籽粒表皮的L*值顯著高于N116小麥(P<0.05),說明ZW1小麥籽粒表皮顏色更亮;N116小麥籽粒表皮的a*值顯著高于ZW1小麥,表明N116小麥籽粒表皮顏色更偏紅;兩種小麥籽粒表皮的b*值無顯著差異(P>0.05)。結果表明,小麥外觀特征可作為區分不同品種小麥的方法,通過大量數據采集進行色度值的區分有助于快速準確地鑒別小麥品種,對大曲生產過程中制曲原料的選擇有輔助作用。
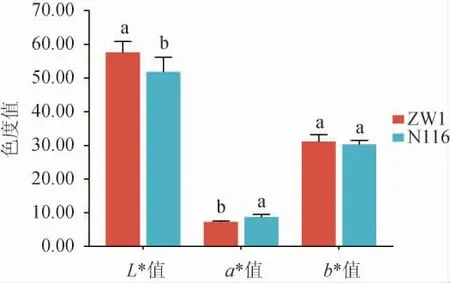
圖1 不同品種小麥籽粒表皮的色度值Fig.1 Color values of grain epidermis of different wheat varieties
2.2 不同品種小麥的營養組分含量
兩種小麥的營養組分見圖2。由圖2可知,N116小麥的平均蛋白質含量(15.16 g/100 g)和脂肪含量(1.61 g/100 g)均顯著高于ZW1(11.79 g/100 g,1.41 g/100 g)(P<0.05),兩種小麥總淀粉含量無顯著性差異(P>0.05)。最值得注意的是,ZW1小麥中直鏈淀粉的含量(22.78 g/100 g)顯著高于N116小麥(0.53 g/100 g)(P<0.05),說明兩種小麥的淀粉種類存在巨大差異,ZW1小麥的淀粉中直鏈淀粉較高,而N116小麥中的淀粉幾乎全部是支鏈淀粉。直鏈淀粉和支鏈淀粉都是淀粉中的多聚糖成分,前者的D-葡萄糖基主要以直鏈狀結構α-(1,4)糖苷鍵連接而成,后者在分支位點主要以支鏈狀結構α-(1,6)糖苷鍵連接而成[11]。梅懷文等[12]研究發現,在青稞酒的釀造過程中,直鏈淀粉在發酵過程中從占比15%左右降至0,而支鏈淀粉從60%左右降至12%左右。李秋濤等[13]比較了不同直、支鏈淀粉含量的大米、高粱的糊化情況和蒸煮香氣,并進行了實驗室和窖池發酵試驗,結果表明,同種糧食直鏈淀粉含量越高,淀粉結構越緊密,糊化時間越長,糧香越濃;不同種類的糧食淀粉顆粒大小、結構不同,糊化時間也不同。楊佳等[14]將糯小麥以不同比例添加到普通小麥用于制曲,結果發現,糯小麥對大曲品質有積極影響,并認為這是由于糯小麥支鏈淀粉比例高,更容易吸收水分子,糊化起始溫度低,糊化更充分,有利于微生物的繁殖和代謝產酶。從酒的香氣角度講,生產淡雅型酒用支鏈淀粉高的糧食原料較好,生產濃郁型酒用直鏈淀粉高的糧食原料較好。以上分析說明,制曲小麥淀粉中直鏈淀粉和支鏈淀粉的比例不同會對大曲培菌的過程產生一定影響,淀粉種類對微生物代謝的具體作用還需進一步研究。
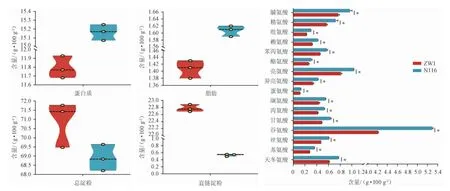
圖2 不同品種小麥的營養組分含量Fig.2 Contents of nutrient components in different wheat varieties
此外,兩種小麥水解氨基酸的含量也存在差異,在所有測得的16種氨基酸中,N116小麥的含量均高于ZW1小麥,這與N116小麥中蛋白質的含量顯著高于ZW1小麥有直接關聯。其中,谷氨酸、亮氨酸、脯氨酸和天冬氨酸的含量差異最為明顯。侯陽陽等[15]在釀酒酵母(Saccharomyces cerevisiae)發酵模擬葡萄汁進入穩定期時分別補加了不同氨基酸,分析了釀酒酵母生長、發酵速率以及最終乙醇、有機酸和高級醇含量的變化,結果表明,丙氨酸和纈氨酸能顯著增加釀酒酵母的生物量并提高發酵速率,提高最終乙醇和異丁醇含量,而高濃度的半胱氨酸和賴氨酸抑制釀酒酵母生長和發酵速率,顯著增加了有機酸含量。張雙梅等[16]在桑葚果汁中分別添加異亮氨酸、亮氨酸、苯丙氨酸和纈氨酸制備桑葚酒,探究外源添加氨基酸對桑葚酒風味和品質的影響,結果表明,外源添加單一氨基酸可顯著提高桑葚酒的揮發性風味物質含量和口感評分。氨基酸是酵母可同化氮的主要來源之一,可被酵母吸收并用于生長和產生代謝產物,如產生高級醇及酯類物質,在酵母生長穩定期添加精氨酸,可促進酯類物質的生成[17]。不同種類的氨基酸經微生物代謝后可產生不同代謝物而影響發酵食品的風味和品質,如支鏈氨基酸(纈氨酸、亮氨酸、異亮氨酸)與苯丙氨酸可顯著提高葡萄酒中相應高級醇及其乙酸酯的含量[18]。
總之,不同品種制曲小麥營養組分的差異可能對制曲過程中微生物的演替產生一定影響,微生物以此為底物進一步代謝產生不同的風味,最終造成大曲的品質差異。
2.3 不同品種小麥的微生物組成分析
由圖3a可知,在細菌門水平,兩種小麥源微生物相對豐度最高的細菌門均為變形菌門(Proteobacteria),相對豐度均>80%,其次為放線菌門(Actinobacteria)和厚壁菌門(Firmicutes),此外,擬桿菌門(Bacteroidetes)在N116小麥中的相對豐度(4.60%)明顯高于ZW1小麥(0.39%)。在細菌科水平,兩種小麥的微生物菌群組成有較大差異,ZW1小麥中相對豐度最高的細菌科為腸桿菌科(Enterobacteriaceae)(38.92%),其次為鹽單胞菌科(Halomonadaceae)(11.85%)、草酸桿菌科(Oxalobacteraceae)(9.09%)和假單胞菌科(Pseudomonadaceae)(4.35%)。N116小麥中相對豐度最高的細菌科為鹽單胞菌科(Halomonadaceae),相對豐度>40%,其次為腸桿菌科(Enterobacteriaceae)(20.61%)和草酸桿菌科(Oxalobacteraceae)(4.92%),此外,紫單胞菌科(Porphyromonadaceae)、普雷沃菌科(Prevotellaceae)、韋榮氏菌科(Veillonellaceae)和消化鏈球菌科(Peptostreptococcaceae)的相對豐度均在N116小麥中>1%,且未在ZW1小麥中檢出。由圖3b可知,兩種小麥源真菌組成相似且單一,在真菌門水平上,子囊菌門(Ascomycota)相對豐度占絕對優勢。在真菌科水平上,格孢腔菌科(Pleosporaceae)占據絕對優勢,相對豐度>98%。KANG J M等[19]研究發現,部分腸桿菌科(Enterobacteriaceae)是馥郁香型白酒在冬季的固態糖化發酵過程中最重要的細菌;PANG X N等[20]通過研究清香型白酒原料預處理過程菌群的組成和功能發現,腸桿菌科(Enterobacteriaceae)的相對豐度與2-乙基-3,5-二甲基-吡嗪含量呈強正相關。草酸桿菌科(Oxalobacteraceae)通常在作物的根際被檢出,因此不同種植區域的小麥攜帶的微生物可能存在差異,通過種植區的選擇可以對制曲小麥的品質進行控制[21];ZOU W等[22]提出,部分紫單胞菌科(Por phyromonadaceae)與濃香型白酒的發酵存在密切關系,是窖泥、黃水中的優勢微生物,這說明N116小麥中的紫單胞菌科(Porphyromonadaceae)可能參與制曲培菌過程中甚至白酒發酵過程中的微生物演替,而ZW1小麥中卻未檢出;SU C等[23]通過對小曲酒發酵劑的菌群研究發現,普雷沃菌科(Prevotellaceae)與十六烷酸甲酯、乙醛、3-辛酮和乙偶姻具有很強的相關性,且對酸度有一定影響,同樣,普雷沃菌科(Prevotellaceae)只在N116小麥中被檢出且作為優勢微生物之一。綜上,兩個品種小麥攜帶的細菌菌群存在明顯差異,而小麥源真菌組成高度相似,因此,后續研究小麥源微生物對大曲群落組裝的作用應該將重點放在細菌菌群,這與之前的研究結論一致[5]。不同的細菌菌群結構可能對大曲培菌期的微生物群落組成產生不同的作用,進一步影響大曲的品質。
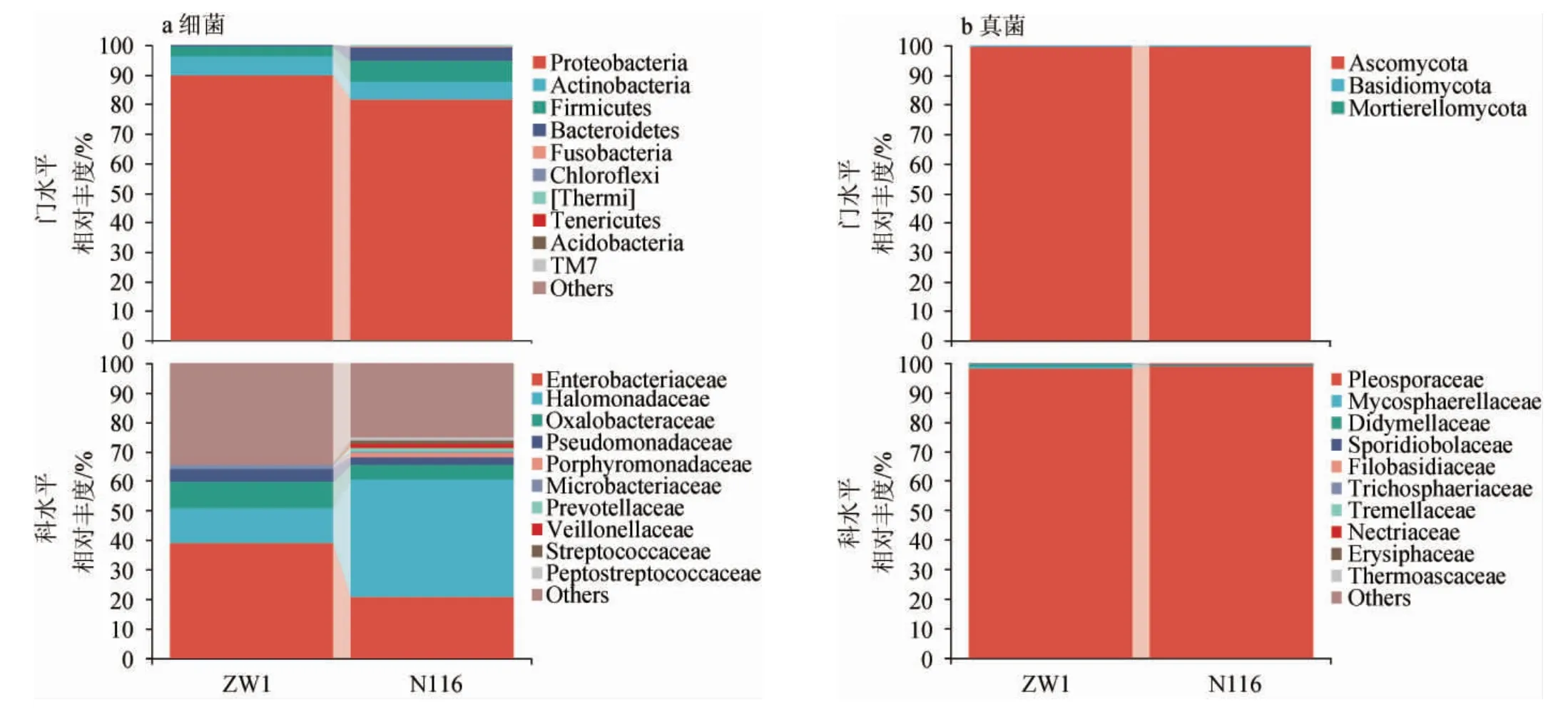
圖3 眾麥1號和糯麥116的細菌(a)和真菌(b)在不同分類學水平的群落結構Fig.3 Community structure of bacteria (a) and fungi (b) from wheat ZW1 and N116 at different taxonomic levels
基于兩種小麥攜帶細菌和真菌菌群的組成分析結果,進一步深入分析細菌菌群的差異,結果見圖4。由圖4a可知,ZW1和N116小麥特有的ASVs數目分別為902個和752個,共有的ASVs數目為247個。由圖4b可知,β-變形菌綱(Betaproteobacteria)和α-變形菌綱(Alphaproteobacteria)更多分布在ZW1小麥中,而擬桿菌綱(Bacteroidia)和梭菌綱(Clostridia)則主要分布于N116小麥中,這一結果從不同分類學水平說明了兩種小麥細菌群落結構的差異。
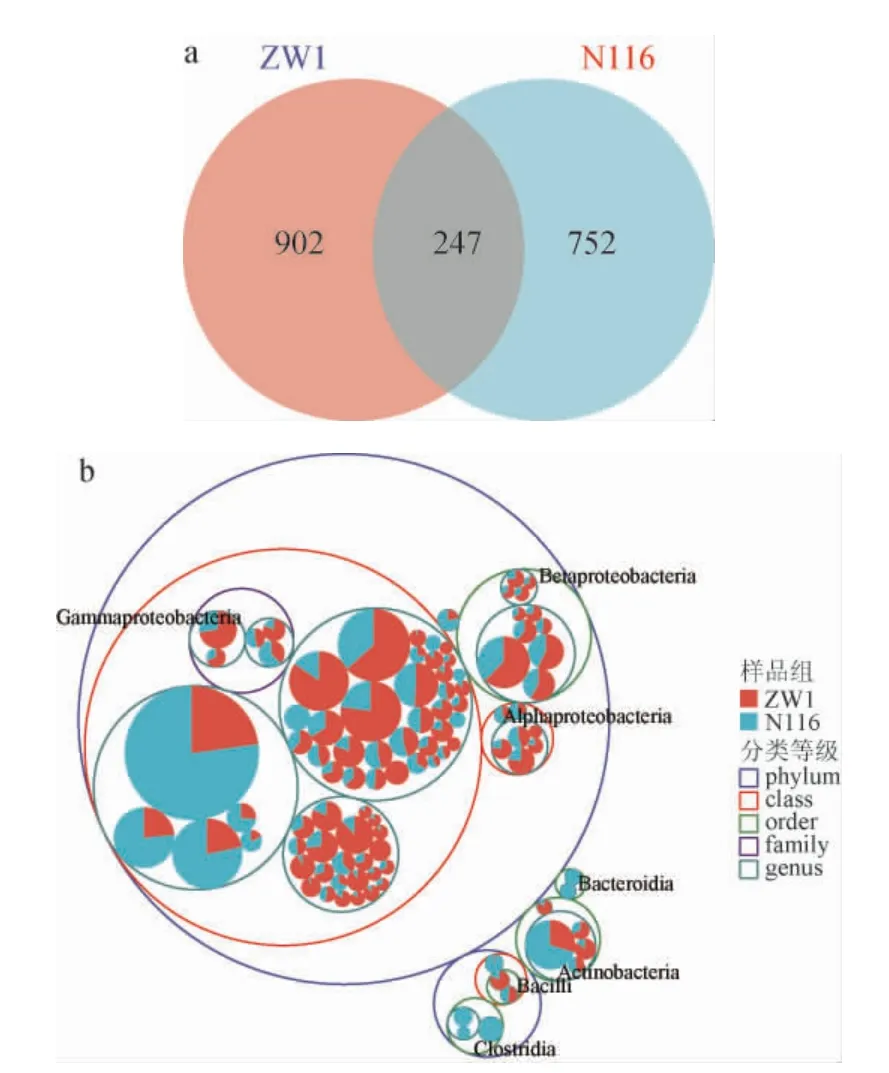
圖4 眾麥1號和糯麥116細菌菌群ASVs數目的韋恩圖(a)及分類等級樹圖(b)Fig.4 Venn diagram (a) and classification tree (b) of ASVs number of wheat ZW1 and N116
2.4 PICRUSt 2功能預測
使用PICRUSt 2軟件對不同品種小麥細菌菌群的基因功能進行預測,二級功能類群統計結果見圖5。
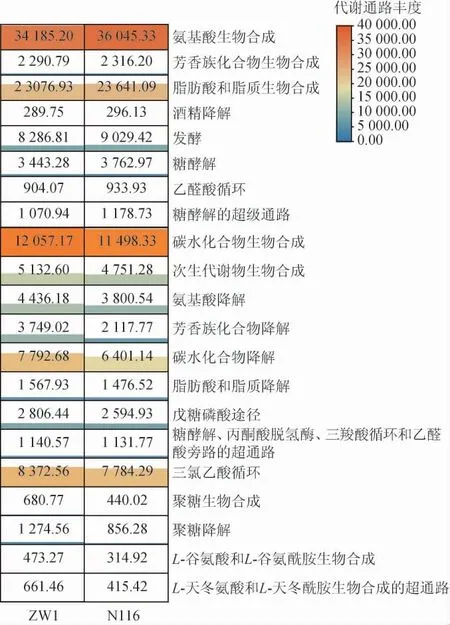
圖5 不同品種小麥細菌菌群的二級功能類群統計結果Fig.5 Statistical results of secondary functional groups of bacterial flora of different wheat varieties
由圖5可知,N116小麥樣品中的細菌菌群在8個代謝通路(氨基酸生物合成、芳香族化合物生物合成、脂肪酸和脂質生物合成、酒精降解、發酵、糖酵解、乙醛酸循環、糖酵解的超級通路)上的相對豐度更高,ZW1小麥樣品的細菌菌群在13個代謝通路(碳水化合物生物合成、次生代謝物生物合成、氨基酸降解、芳香族化合物降解、碳水化合物降解、脂肪酸和脂質降解、戊糖磷酸途徑等)中具有更高的豐度。進一步地,將通路與物種進行關聯,使用分層的樣本代謝通路豐度表進行通路的物種組成分析。本研究選取代謝通路統計結果中差異倍數較大且在發酵過程中有重要作用的通路加以說明,結果見圖6。
微生物群落結構的研究結果顯示,ZW1小麥源細菌中腸桿菌科(Enterobacteriaceae)的相對豐度明顯高于N116小麥,由圖6可知,腸桿菌科在關鍵的差異代謝通路中貢獻最突出,尤其是糖類和氨基酸代謝相關的通路,包括D-葡萄糖酸降解Ⅰ、D-葡萄糖二酸和D-半乳糖酸降解的超通路、酮葡萄糖酸代謝、D-半乳糖酸降解Ⅰ、L-精氨酸和L-鳥氨酸降解的超通路、鳥氨酸降解超通路、L-精氨酸、腐胺和4-氨基丁酸降解的超通路。腸桿菌科是大曲發酵過程中的優勢菌之一,許多研究都指出腸桿菌科與很多重要風味物質的產生具有很強的相關性[24],這佐證了其在糖類和氨基酸類物質代謝中的重要作用。值得注意的是,部分植物相關的腸桿菌科是條件致病菌,在低水分的介質中可存活較長時間導致感染[25]。這啟示我們攜帶不同菌群的制曲原料可能對大曲培菌過程的部分代謝功能產生不同作用,同時也要警惕小麥源致病微生物可能對大曲菌群產生的不良影響。

圖6 PICRUSt2預測代謝途徑的微生物群落組成Fig.6 Predicted microbial community composition of metabolic pathways by PICRUSt2
2.5 不同品種小麥揮發性風味物質分析
采用HS-SPME-GC-MS對ZW1和N116小麥的揮發性風味物質進行全面分析,結果見圖7。
由圖7a可知,采用HS-SPME-GC-MS從兩個品種小麥中共篩選得到44種揮發性風味物質,包括1種醇類、4種醛酮類、6種酚酸類、17種酯類和16種其他類。由圖7b可知,對解析出的小麥揮發性風味物質進行OPLS-DA發現,每種小麥樣品組內聚類效果較好,樣品重復性良好,結果具有較高的可信度,說明ZW1小麥和N116小麥的揮發性風味物質輪廓具有明顯的差異。由圖7c可知,從不同種類揮發性物質的含量來看,N116小麥中的酯類物質、酚酸類物質總含量高于ZW1小麥,具體主要體現在對甲酚、百里酚、4-叔丁基環己基甲基乙基膦酸酯、重氮乙酸,2-異丙基-5-甲基環己酯和咪唑-2-酰肼-1-羧酸甲酯等的含量。值得注意的是,百里酚是一種制作香精的原料,天然存在于一些植物中,具有抗真菌的功能,最突出的作用是殺蟲,已有研究表明百里酚及其類似物可作為殺蟲劑應用于病蟲的防治[26]。本研究預測小麥中檢出的百里酚可能是小麥種植過程中噴灑的殺蟲劑的成分之一,因此可根據小麥的代謝物檢測進行優選和質控。

圖7 不同小麥樣品揮發性風味物質GC-MS分析結果Fig.7 Analysis results of volatile flavor components in different wheat samples by GC-MS
采用GC-IMS技術對ZW1和N116小麥的揮發性風味 物質進行分析,結果見圖8。
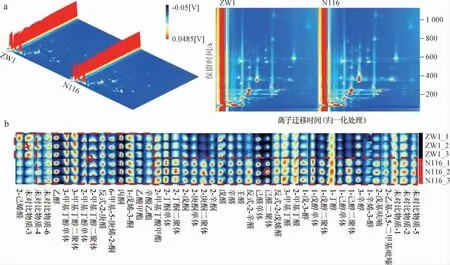
圖8 GC-IMS檢測不同小麥樣品中揮發性風味物質的3D和2D譜圖(a)和指紋圖譜(b)Fig.8 3D and 2D spectrum (a) and fingerprint (b) of volatile flavor compounds in different wheat samples by GC-IMS
由圖8a可知,兩種小麥的揮發性風味物質的種類和含量存在差異,總的來說,N116小麥樣品中揮發風味物質的種類和相對含量更高,即風味物質的豐富度更高。由圖8b可知,圖中A區域物質(2-己烯醛)在ZW1小麥樣品中含量較高;B區域物質在ZW1和N116小麥樣品中分布相似,主要包括乙醇、3-甲基丁醇、2-甲基丁醇、E-2-庚醛、6-甲基5-庚烯2-酮、丙酮、1-戊烯-3-酮、乙酸甲酯和辛酸乙酯;C區域物質在N116小麥樣品中更豐富,主要有2-甲基丁酸甲酯、2-丁酮、2-戊酮、2-庚酮、2-辛酮、1-戊烯-3-醇、1-戊醇、1-丁醇、1-己醇、3-辛醇、1-辛烯-3-醇、2-戊基呋喃和2-乙基-3,5對甲基吡嗪等。2-己烯醛可以產生類似綠草的清新氣味[27],2-甲基丁酸甲酯可以產生典型的甜瓜香氣,2-丁酮可以產生略強烈、甜味、刺激性、類似丙酮樣的風味,常在豆類中被檢出[28-29],這表明N116小麥具有更豐富此類風味物質成分。
3 結論
通過對ZW1和N116兩個品種制曲小麥的理化特性、微生物菌群組成和揮發性風味物質分析發現,兩種小麥表皮色度存在差異,N116小麥籽粒的蛋白質和脂肪含量更高,而ZW1小麥籽粒中的直鏈淀粉含量更高。高通量測序結果表明,ZW1小麥中腸桿菌科(Enterobacteriaceae)的相對豐度明顯高于N116小麥,腸桿菌科在一些糖類和氨基酸代謝相關的通路中功能豐度更高。N116小麥中的鹽單胞菌科(Halomonadaceae)的相對豐度明顯高于ZW1小麥。揮發性代謝物檢測結果表明,兩種小麥的風味特征存在較大差異,主要體現在酯類、醇類和醛酮類的含量上,總的來說N116小麥中的風味物質含量更豐富。本研究對兩個品種的制曲小麥的微生物和風味特征作了全面的比較分析,為優選制曲小麥品種、質檢和品控提供了理論支撐。

