KCl替代NaCl對東北酸菜細菌菌群多樣性的影響
解雙瑜,孫 波,李 智,柳 凱,趙子偉
(東北農業大學 食品學院,黑龍江 哈爾濱 150030)
東北酸菜是一種東北傳統發酵蔬菜制品[1-2]。其做法是將白菜完全浸入一定濃度的鹽水(NaCl)中壓實密封后接菌或自然發酵[3]。在酸菜發酵過程中,涉及到許多微生物的增殖與代謝作用[4-6],其中以乳酸菌等能夠產生乳酸的微生物為主[7-8],同時還包含一些不利于酸菜發酵的有害菌,這些有害菌的耐鹽性通常弱于乳酸菌,此時添加一定量的鹽能夠起到抑制雜菌滋生及調節白菜細胞滲透壓的作用,因此傳統酸菜中鹽的添加量通常在3%~5%甚至更高[9-11]。而目前越來越多的研究表明,食鹽中的鈉攝入過多會增加人們患心腦血管疾病的風險[12-13],因此減鹽成為食品加工業發展的一大趨勢。
在減鹽的同時為了保證食品的品質,最有效的方式就是用其他鹽類替代鈉鹽,最常用的就是氯化鉀[14-16]。由于K+和Na+對于細胞滲透壓和物質交換速率的影響程度不同[17],氯化鉀與氯化鈉對于相同微生物的增殖與代謝會產生不同的影響[18-20]。而且在酸菜發酵過程中采用氯化鉀替代氯化鈉,也會對其中的微生物種群產生影響,這種影響可能會在一定程度上改變酸菜的品質。因此,通過比較不同KCl替代量對東北酸菜細菌菌群多樣性的影響,研究K+和Na+對于東北酸菜發酵特性影響的差異性,為低鈉酸菜產業的發展提供理論參考依據。
本研究以添加NaCl的酸菜作為對照組,采用不同比例的KCl替代其中的NaCl,使用高通量測序分析比較不同替代鹽體系下自然發酵酸菜樣品中細菌菌群多樣性的變化,并分析其感官品質的變化。旨在保證東北酸菜發酵產品品質的同時,降低東北酸菜中的鈉含量,為未來低鈉酸菜的研究與開發提供依據。
1 材料與方法
1.1 材料與試劑
大白菜:黑龍江省哈爾濱市;精制食用鹽(食品級):中鹽天津市長蘆鹽業有限公司;氯化鉀(食品級):河南萬邦實業有限公司;TIANamp Bacteria基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)Kit提取試劑盒(離心柱型):天根生化科技有限公司。
1.2 儀器與設備
DDY-6C電泳儀:北京市六一儀器廠;Bio-rad T100梯度聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國BIO-RAD公司;Illumina NovaSeq 6000測序平臺:美國Illumina公司。
1.3 方法
1.3.1 東北酸菜的制備和取樣
東北酸菜的制備:取150 kg大缸,將75 kg挑選后的白菜原料洗凈瀝干后整顆碼入缸中壓實,在碼放過程中按照白菜質量的3%加入具有不同氯化鉀含量的鹽。其中,SC1:100%NaCl;SC2:25%KCl+75%NaCl;SC3:50%KCl+50%NaCl;SC4:75%KCl+25%NaCl;SC5:100%KCl。碼放完畢后每缸中加入75 kg水。自然發酵60 d后取樣。
1.3.2 高通量測序分析
采用TIANamp Bacteria DNA Kit提取酸菜樣品的DNA,然后用1%瓊脂糖凝膠電泳對基因組DNA的純度和濃度進行檢測[21]。檢測合格后,用無菌水將基因組DNA樣本稀釋至1 ng/μL,并以此作為模板,使用通用引物314F(5'-CCTAYGGGRBGCASCAG-3')和806R(5'-GGACTACNNGGGTATCTAAT-3')對16S rRNA基因的V3-V4區基因序列進行PCR擴增。PCR擴增體系:Phusion Master Mix(2×)15 μL,Primer 3 μL,模板DNA(1 ng/μL)10 μL,雙蒸水(ddH2O)2 μL。PCR擴增條件:98 ℃預變性1 min;98 ℃變性10 s,50 ℃退火30 s,72 ℃延伸30s,共30個循環;72 ℃再延伸5 min。PCR擴增產物經2%瓊脂糖凝膠電泳檢測合格后,委托天津諾禾致源生物信息科技公司基于Illumina測序平臺,利用雙端測序的方法,構建小片段文庫進行雙端測序。
1.3.3 感官品質評價
參考CHOI Y J等[22-23]的方法對東北酸菜樣品的感官品質進行評價。挑選20名經過訓練后的品評人員(10名男性和10名女性)組成感官小組,采用9點偏好量表從酸味、咸味、苦味、顏色、整體評價對酸菜進行質量描述分析。其中酸味、咸味和苦味采用9分制評分,1=很弱,3=弱,5=中等,7=強,9=非常強。顏色和整體評價使用9分制進行評分,其中1=非常不喜歡,3=不喜歡,5=無喜惡,7=喜歡,9=非常喜歡。所有樣品在不告知感官評價小組成員的條件下隨機編號。感官評價小組成員每品嘗完一個樣品后,用清水漱口,再進行下一個樣品的品嘗。
1.3.4 數據處理及分析
采用SPSS 27.0分析處理實驗數據,結果以“平均值±標準差”表示,并進行顯著性分析,當顯著水平P<0.05時,具有統計學意義;采用Origin 9.0軟件處理作圖。
2 結果與分析
2.1 不同酸菜樣品的細菌菌群Alpha多樣性分析
稀釋曲線和等級聚類曲線是常見的描述組內細菌物種多樣性的曲線,不同酸菜樣品細菌菌群的稀釋曲線與等級聚類曲線見圖1。由圖1可知,各酸菜樣品的稀釋曲線在30 000時趨向平穩,說明測序數據量漸進合理。等級聚類曲線可直觀的反映細菌物種豐富度和均勻度[24]。由圖1亦可知,SC5樣品細菌菌群的豐富度與均勻度最高。
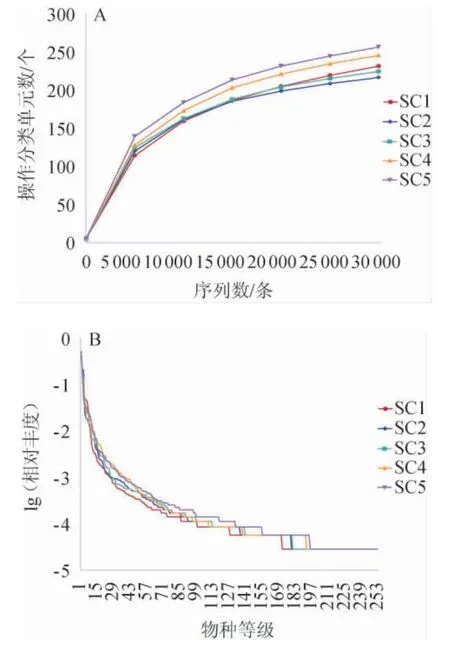
圖1 不同酸菜樣品細菌菌群的稀釋曲線(A)與等級聚類曲線(B)Fig.1 Dilution curves (A) and hierarchical clustering curves (B) of bacterial flora in different sauerkraut samples
不同KCl替代量酸菜樣品的細菌菌群Alpha多樣性分析結果見表1。Observed-species、Chao1指數和ACE指數代表細菌菌群的豐富度;數值越大,細菌菌群豐富度越高。Shannon指數和Simpson指數代表細菌多樣性;Shannon值越大,Simpson指數越小,細菌多樣性越高[25]。由表1可知,隨著KCl替代量的增加,細菌菌群多樣性整體呈現持續增加的趨勢,豐富度呈現先降低后增加的趨勢。當KCl替代量達到100%時,其細菌菌群多樣性與豐富度均高于未添加KCl的樣品,這與等級聚類曲線所示結果相同。

表1 不同酸菜樣品細菌菌群的Alpha多樣性分析結果Table 1 Alpha diversity analysis results of bacterial flora in different sauerkraut samples
2.2 不同酸菜樣品細菌菌群結構分析
2.2.1 基于門水平不同酸菜樣品細菌菌群結構分析結果
從酸菜樣品中共檢測到20個細菌菌門,其中KCl替代量為50%的酸菜樣品菌門種類最少(11個),KCl替代量為100%的酸菜樣品菌門種類最多(17個)。基于門水平,不同KCl替代量酸菜樣品的細菌菌群結構見圖2。由圖2可知,在所有酸菜樣品中,占據最優勢地位的門是厚壁菌門(Firmicutes),其在KCl替代量為50%的酸菜樣品中相對最高達94.6%,在KCl替代量為100%的酸菜樣品中相對豐度最低為63.3%。KCl替代量為0的酸菜樣品中還存在29.2%的變形菌門(Proteobacteria),但在含有KCl的所有酸菜樣品中變形菌門(Proteobacteria)的相對豐度均<8%。此外KCl替代量為100%的酸菜樣品中還存在著27.0%的放線菌門(Actinobacteriota),而其相對豐度在其他酸菜樣品中均<2%。結果表明,KCl替代量的增加會導致酸菜中出現新的優勢菌門,但酸菜中優勢菌門的相對豐度可能與KCl替代量之間無線性關系。

圖2 基于門水平不同酸菜樣品細菌菌群結構分析結果Fig.2 Analysis results of bacterial community structure of different sauerkraut samples based on phylum level
2.2.2 基于屬水平不同酸菜樣品細菌菌群結構分析結果
從酸菜樣品中共檢測到454個細菌菌屬,其中KCl替代量為50%的酸菜樣品菌屬種類最少(222個),KCl替代量為100%的酸菜樣品菌屬種類最多(252個)。基于屬水平,不同KCl替代量酸菜樣品的細菌菌群結構見圖3。由圖3可知,在每個酸菜樣品中,乳酸桿菌屬(Lactobacillus)的相對豐度都是最高的。在KCl替代量為0的酸菜樣品中,Lactobacillus的相對豐度為66.5%,當KCl替代量增加至25%時,酸菜樣品中Lactobacillus的相對豐度為85.8%,隨后隨著KCl替代量的增加逐漸下降,當KCl替代量為100%時,酸菜樣品中的Lactobacillus相對豐度為58.6%。明串珠菌屬(Leuconostoc)與乳球菌屬(Lactococcus)存在于每個酸菜樣品中,且均在KCl替代量為50%的酸菜樣品中最高,此時Leuconostoc與Lactococcus的相對豐度分別為5.4%和1.8%。此外,在KCl替代量為0的酸菜樣品中存在5.1%的克雷伯桿菌屬(Klebsiella),在KCl替代量為100%的酸菜樣品中存在17.1%的雙歧桿菌屬(Bifidobacterium),這兩種菌屬雖然在其他樣品中也存在,但其相對豐度均<0.1%。拉恩氏菌屬(Rahnella1)只存在于KCl替代量為0的酸菜樣品中,而鹽池棲菌屬(Halostagnicola)在KCl替代量為0的酸菜樣品中未檢出,其余酸菜樣品中均能檢測到,且其相對豐度隨KCl替代量的增加而逐漸增加,當KCl替代量達到100%時,其相對豐度達到3.6%。
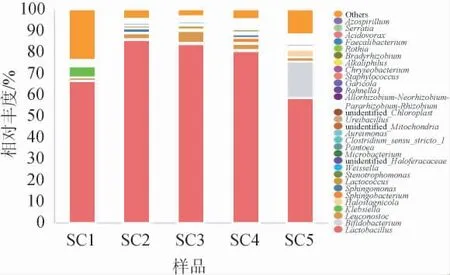
圖3 基于屬水平不同酸菜樣品的細菌菌群結構分析結果Fig.3 Analysis results of bacterial community structure of different sauerkraut samples based on genus level
2.3 不同酸菜樣品基于OTU的Venn圖
不同酸菜樣品基于操作分類單元(operationaltaxonomic units,OTU)的韋恩圖見圖4。由圖4可知,在酸菜的發酵過程中,大部分的細菌屬都是相同的,但仍有部分細菌屬隨KCl替代量的變化而有所不同。隨著KCl替代量的增加,不同酸菜樣品的特有OTU數量呈現先減少后增加的趨勢。當KCl替代量為100%時,其特有OTU數量最高為47個,當KCl替代量為50%時,其特有OTU數量最低為15個。結果表明,在酸菜樣品中同時存在NaCl與KCl時,樣品中的菌群種類相似度較高,而當樣品中只有NaCl或KCl時,樣品中就會出現與其他樣品中不同的菌群種類。
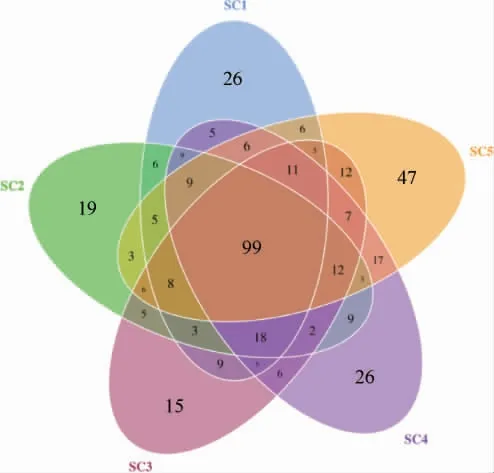
圖4 不同酸菜樣品操作分類單元的Venn圖Fig.4 Venn diagram of operational taxonomic unit of different sauerkraut samples
2.4 不同酸菜樣品物種差異性分析
選取平均相對豐度排名前30的細菌屬,根據其在每個酸菜樣本中的相對豐度信息,從物種和樣本兩個層面進行聚類分析,結果見圖5。
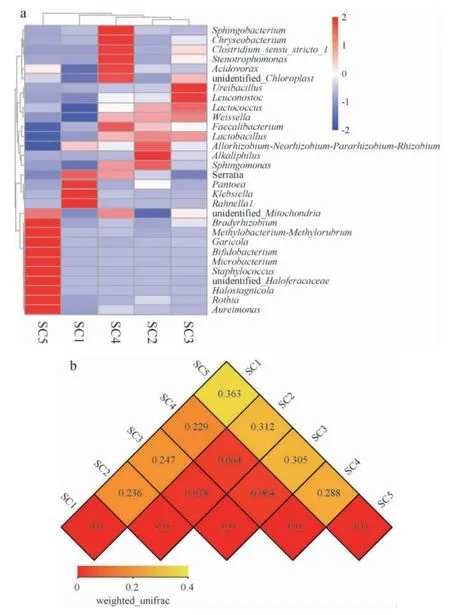
圖5 不同酸菜樣品物種豐度聚類熱圖(a)及β多樣性指數熱圖(b)Fig.5 Heatmap of species abundance clustering (a) and β diversity index (b) of different sauerkraut samples
由圖5a可知,SC2樣品與SC3樣品之間的相似度比較高,其次是SC4樣品。說明當KCl替代量在25%~75%時,酸菜樣品之間細菌群落的相似度較高,而KCl替代量為0與100%時,與其他樣品之間的相似度較低。由圖5b可知,差異最小的兩個樣品為SC2與SC3樣品,其相異系數為0.038,差異最大的兩個樣品為SC1和SC5,其相異系數為0.363。SC2、SC3樣品與SC4樣品的相異系數均為0.064。且SC1、SC5樣品與其他樣品間的相異系數均>0.2。說明當KCl替代量為0或100%時,其樣品與其他樣品之間的菌群差異較大,這與物種豐度聚類熱圖的分析結果一致。
2.5 不同酸菜樣品的感官品質評價
不同酸菜樣品的感官品質評價見圖6。由圖6可知,KCl替代量對于酸菜的咸味與顏色并沒有顯著的影響(P>0.05)。而對酸菜的酸味、苦味與整體評價有顯著的影響(P<0.05)。當KCl替代量為0時,酸菜的酸味評分與整體評價分別為7.0分和7.9分,這兩個評分隨著KCl替代量的增加而減少,當KCl替代量達到100%時,酸味評分與整體評價分別顯著降低至4.8分和2.0分(P<0.05)。當KCl替代量為0時,酸菜的苦味評分為1.4分,其評分隨著KCl替代量的增加而逐漸增加,當KCl替代量達到100%時,苦味評分增加至5.7分。同時從圖7亦可知,當KCl替代量到達50%時,酸菜的苦味與整體評價發生了顯著性的變化。這說明KCl替代NaCl的量不宜超過50%。

圖6 不同酸菜樣品的感官評價Fig.6 Sensory evaluation of different sauerkraut samples
3 結論
本研究采用高通量測序技術分析了KCl替代NaCl對于東北酸菜中細菌菌群多樣性的影響。結果表明,KCl替代NaCl會增加酸菜細菌菌群的多樣性和豐富度,同時當KCl替代量逐漸增加時酸菜中會出現新的細菌菌群,其相對豐度也會隨著KCl替代量的改變而發生變化,但這種變化與KCl替代量不呈現線性相關。當KCl替代量在25%~75%時,酸菜樣品之間細菌群落的相似度較高,而KCl替代量為0與100%時,與其他酸菜樣品之間的相似度較低。當KCl替代量>50%時,酸菜會出現明顯的苦味,整體感官評分顯著下降。因此KCl替代NaCl的比例不宜超過50%。該實驗結果能為未來低鈉酸菜的研究與開發提供依據。未來的研究還應圍繞對酸菜發酵工藝的改進,以期達到在保障酸菜品質的同時減少NaCl添加量的目的。

