基于PI3K/Akt/FoxO1 通路探討大黃酸對2 型糖尿病大鼠腎損傷的作用
喬 進,趙 彥,陳 霞,竇志華*,孟國梁,吳 鋒,徐濟良
(1.南通大學附屬南通第三醫院,江蘇 南通 226006; 2.南通大學,江蘇 南通 226006)
糖尿病腎病是糖尿病患者容易發生的并發癥之一,是發展為終末期腎病的主要病因,也是糖尿病患者致死的重要原因之一,大約有30%~45% 的糖尿病患者會出現糖尿病腎病[1-2]。糖尿病腎病在臨床上缺少有效的治療方法,至今為止,其發病機制尚不清楚。中藥單體在糖尿病腎病的治療中發揮一定作用,如姜黃素、丹酚酸B 等[3-6]。大黃蒽醌類化合物大黃酸在降血糖、抗氧化、抗炎、抗癌等方面有重要作用[7-8]。大黃酸已被證實可通過TGF-β1/Smad信號轉導途徑對糖尿病腎病大鼠腎臟發揮保護作用[9],本研究基于PI3K/Akt/FoxO1 信號轉導通路,通過構建STZ 誘導的2 型糖尿病大鼠模型,從氧化應激指標、腎組織病理形態學及目標蛋白表達等情況,進一步探討大黃酸對糖尿病腎病大鼠腎臟的保護作用。
1 材料
1.1 試劑與藥物 大黃酸購自上海笛柏生物科技有限公司,純度>98.0%,批號DK05,用含0.5%羥甲基纖維素鈉(CMC)的0.9%NaCl 溶液配置成相應劑量的混懸液;陽性對照藥二甲雙胍購自上海信宜天平藥業有限公司,批號67100507。鏈脲佐菌素(STZ)購自美國Sigma 公司,臨用前用0.1 mol/L 檸檬酸緩沖液配置成1% 溶液;丙二醛(MDA)試劑盒、超氧化物歧化酶(SOD)試劑盒、谷胱甘肽過氧化物酶(GSH-Px)試劑盒購自南京建成生物工程研究所;β-actin 抗體購自上海康成生物工程有限公司;PI3K、Akt、FoxO1 抗體購自美國CST 公司;預染蛋白Marker 購自美國New England Biolabs 公司;蛋白濃度測定試劑盒購自海門碧云天生物技術有限公司。
1.2 儀器 One Touch 血糖儀(美國強生公司);BH-NICB 型倒置顯微鏡(日本Olympus 公司);蛋白電泳儀(美國Bio-Rad 公司);SH-100 型凝膠圖像分析儀(上海復旦高技術公司)。
1.3 動物 成年SD 大鼠70 只,雌雄各半,體質量160~180 g,飼養于南通大學實驗動物中心,實驗動物生產許可證號SCXK(蘇)2018-001,分籠飼養,每籠4 只,環境溫度24~26 ℃,相對濕度55%~60%,飼料與水充足。
2 方法
2.1 造模、分組與給藥 隨機取10 只大鼠為正常組,其余60 只為造模組。正常組大鼠給予普通飼料,造模組大鼠先給予高脂飲食(普通飼料70%、蛋黃粉5%、奶粉5%、脂肪20%)4 周后,在其胰島素抵抗后禁食12 h,給予小劑量STZ(35 mg/kg)腹腔注射。1 周后,大鼠空腹血糖值大于11.1 mmol/L,提示造模成功。取48 只造模成功的大鼠隨機分為模型組,大黃酸高、低劑量組(150、75 mg/kg),二甲雙胍組(300 mg/kg),每組12 只,繼續給予高脂飲食,每天給藥1 次,正常組與模型組大鼠給予0.9%NaCl 灌胃,持續12 周。
2.2 血糖測定 給藥12 周末,各組大鼠禁食12~14 h 后經尾靜脈取血測空腹血糖。
2.3 體質量與腎臟指數測定 給藥12 周末,取腎臟,用0.9%NaCl 溶液沖洗,濾紙吸干,稱重并計算腎臟指數,腎臟指數=雙側腎臟質量/大鼠體質量×100%。
2.4 腎組織MDA 水平和SOD、GSH-Px 活性檢測 按照試劑盒說明檢測各組大鼠腎臟組織中MDA 水平和SOD、GSH-Px 活性。
2.5 腎組織病理形態學觀察 取腎臟置于4%多聚甲醛中固定24 h,石蠟包埋,切片,行HE 與Masson 染色,通過光鏡觀察腎組織病理形態學變化,拍照,每只大鼠選取5個典型視野進行統計分析,以系膜基質百分比為依據進行腎小球損傷評分。
2.6 免疫組化法檢測FoxO1 蛋白表達 組織切片后進行脫蠟,使用檸檬酸緩沖液進行抗原修復,3% 雙氧水滅活,FoxO1(1∶200)4 ℃孵育過夜,37 ℃復溫30 min,PBS 洗滌,二抗(1∶1 000)37 ℃孵育30 min,洗滌,DAB 顯色,蘇木素復染,透明,封片,采用JEDA801D 型形態學軟件測定陽性信號的面積與平均灰度。
2.7 Western blot 法檢測PI3K、Akt 與FoxO1 蛋白表達取100 mg 腎組織,組織裂解液提取蛋白,BCA 法進行蛋白定量。用8% SDS-PAGE 凝膠電泳分離蛋白,隨后轉移至PVDF 膜上,置于5%脫脂牛奶TBST 溶液中室溫封閉2 h,分別加入一抗與β-actin 抗體4 ℃搖床孵育過夜,TBST 洗滌2 次,加二抗室溫反應1 h,TBST 洗滌2 次后于暗室加入ECL 試劑,X 線膠片曝光顯影定影,測定各組蛋白與內參(β-actin)條帶灰度值的比值,取平均值。
2.8 統計學分析 通過SPSS 20.0 軟件進行處理,計量資料以(±s)表示,組間比較采用單因素方差分析。P<0.05 為差異有統計學意義。
3 結果
3.1 各組大鼠空腹血糖變化 與正常組比較,模型組大鼠空腹血糖升高(P<0.05);與模型組比較,大黃酸高劑量組與二甲雙胍組大鼠空腹血糖降低(P<0.05),見表1。
表1 各組大鼠空腹血糖比較(±s)
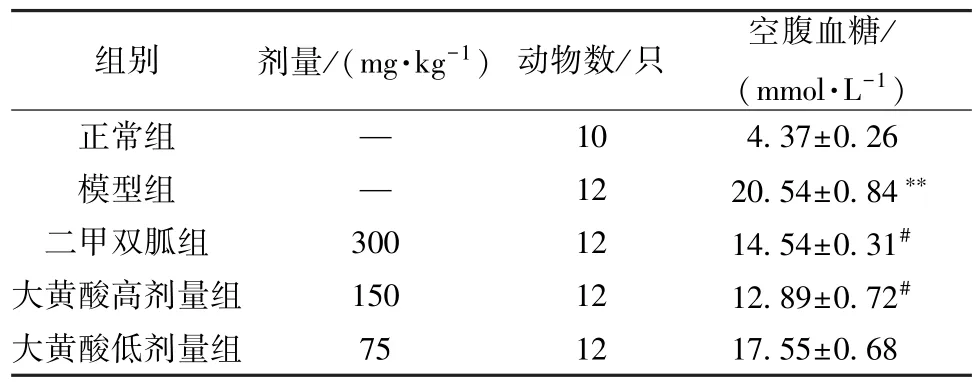
表1 各組大鼠空腹血糖比較(±s)
注:與正常組比較,**P<0.01;與模型組比較,#P<0.05。
3.2 各組大鼠一般狀態、體質量與腎臟指數變化 正常組大鼠活動狀態良好,行動靈敏,外表毛發整齊;模型組與大黃酸低劑量組大鼠多數安靜不動,外表毛發臟亂;大黃酸高劑量組與二甲雙胍組大鼠活動狀態良好,行動靈敏,毛發色澤較光亮。與正常組比較,模型組大鼠體質量下降,腎臟指數升高(P<0.05);與模型組比較,大黃酸高劑量組與二甲雙胍組大鼠體質量升高,腎臟指數下降(P<0.05),見表2。
表2 各組大鼠體質量與腎臟指數比較(±s)

表2 各組大鼠體質量與腎臟指數比較(±s)
注:與正常組比較,*P<0.05;與模型組比較,#P<0.05。
3.3 各組大鼠腎臟MDA 水平和SOD、GSH-Px 活性變化與正常組比較,模型組大鼠腎臟組織MDA 水平升高,SOD、GSH-Px 活性降低(P<0.01);與模型組比較,大黃酸各劑量組與二甲雙胍組大鼠腎組織MDA 水平降低,SOD、GSH-Px 活性升高(P<0.05,P<0.01),見表3。
表3 各組大鼠腎臟MDA 水平和SOD、GSH-Px 活性比較(±s)

表3 各組大鼠腎臟MDA 水平和SOD、GSH-Px 活性比較(±s)
注:與正常組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
3.4 各組大鼠腎組織病理形態學變化 肉眼觀察正常組大鼠腎臟表面顏色為暗紅色,包膜清晰易剝離;模型組大鼠腎臟體積較大,顏色較正常組蒼白;其余給藥組大鼠腎臟外觀性狀介于正常組與模型組之間。HE 染色顯示,正常組大鼠腎臟結構清晰,間質無炎癥細胞浸潤;模型組大鼠腎組織增生明顯,細胞外基質增多;各給藥組大鼠上述病變均有不同程度改善,部分腎小球增大、系膜細胞增生等均可見不同程度改善。通過腎小球損傷指數分析,與正常組比較,模型組大鼠腎組織損傷加重(P<0.01);與模型組比較,大黃酸各劑量組腎組織損傷減輕(P<0.01),見圖1~2、表4~5。

圖1 各組大鼠腎臟HE 染色圖(×100)

圖2 各組大鼠腎臟Masson 染色圖(×400)
表4 各組大鼠腎組織HE 染色腎小球損傷指數比較(±s)

表4 各組大鼠腎組織HE 染色腎小球損傷指數比較(±s)
注:與正常組比較,**P<0.01;與模型組比較,##P<0.01。
表5 各組大鼠腎組織Masson 染色腎小球損傷指數比較(±s)

表5 各組大鼠腎組織Masson 染色腎小球損傷指數比較(±s)
注:與正常組比較,**P<0.01;與模型組比較,##P<0.01。
3.5 各組大鼠腎組織FoxO1 蛋白表達變化 與正常組比較,模型組腎組織FoxO1 表達增多(P<0.05);與模型組比較,大黃酸高劑量組與二甲雙胍組FoxO1 表達降低(P<0.05),見圖3、表6。

圖3 各組大鼠腎組織FoxO1 蛋白免疫組化染色圖(×400)
表6 各組大鼠腎組織FoxO1 蛋白表達比較(±s)

表6 各組大鼠腎組織FoxO1 蛋白表達比較(±s)
注:與正常組比較,**P<0.01;與模型組比較,##P<0.01。
3.6 各組大鼠腎組織PI3K、Akt、FoxO1 蛋白表達變化與正常組比較,模型組大鼠腎組織PI3K、Akt 蛋白表達降低(P<0.05),FoxO1 蛋白表達升高(P<0.05);與模型組比較,大黃酸高劑量組與二甲雙胍組大鼠腎臟組織PI3K、Akt 蛋白表達升高(P<0.05),FoxO1 蛋白表達降低(P<0.05),見圖4、表7。
表7 各組大鼠腎組織PI3K、Akt、FoxO1 蛋白表達比較(±s)

表7 各組大鼠腎組織PI3K、Akt、FoxO1 蛋白表達比較(±s)
注:與正常組比較,**P<0.01;與模型組比較,##P<0.01。

圖4 各組大鼠腎組織PI3K、Akt、FoxO1 蛋白條帶圖
4 討論
糖尿病腎病是糖尿病人群較重要的并發癥之一,慢性高血糖及腎小球濾過增高導致的蛋白尿是其主要的臨床表現,嚴重者甚至引起腎衰竭,危及生命。微量白蛋白尿是診斷糖尿病腎病的標志[9]。中草藥在糖尿病治療中的運用逐年增多,在治療由糖尿病引起的各種并發癥方面有著獨特的療效。大黃酸對糖尿病大鼠的腎臟病變具有預防和保護作用[10-14]。本實驗結果顯示,模型組大鼠的高血糖狀態直接影響了其腎臟的功能。氧化應激指標檢測發現,模型組大鼠腎組織MDA 水平均升高,SOD 與GSH-Px 活性降低,提示模型大鼠腎臟可能處于氧化應激損傷的狀態,導致腎臟損害。給藥干預12 周后,大黃酸高劑量組腎臟組織MDA水平降低,SOD 與GSH-Px 活性升高,提示大黃酸可減輕糖尿病對腎臟帶來的損害。
PI3K/Akt/FoxO1 信號轉導通路是胰島素信號轉導的主要途徑,是生物體內調控血糖的主要信號轉導通路[15],其通過減輕高脂、高能量飲食帶來的胰島素抵抗,促進外周組織對葡萄糖的攝取。FoxO1 為一種多功能的蛋白,它是Forkhead 大家族中的一個蛋白亞群,在胰腺β 細胞與肝細胞中均有表達。FoxO1 可以抑制α 細胞向β 細胞轉化,保護β 細胞免受氧化應激損傷,維持β 細胞終末分化狀態以及抑制胰腺祖細胞分化為β 細胞[16]。Akt 是胰島素信號傳導途徑中一個重要的下游分子,活化狀態的Akt 可促進機體葡萄糖轉運與糖原合成,提高機體對胰島素的敏感,發揮降糖作用。同時,活化的Akt 使FoxO1 磷酸化而失去活性,降低糖異生基因G6P 及PEPCK 水平,從而減少糖異生,使血糖降低[17]。當2 型糖尿病患者體內胰島素受體表達降低,干擾PI3K 活化,間接影響Akt 的活化,出現血糖升高。當PI3K/Akt/FoxO1 信號通路上任何一個因子代謝出現異常均可導致體內的胰島素抵抗,極有可能誘發2 型糖尿病[18-19]。通過腎組織病理形態學觀察,模型組大鼠腎組織增生明顯,細胞外基質增多;而各給藥組大鼠腎小球增大、腎小球系膜細胞增生等病變有所改善,其中以大黃酸高劑量組最為明顯。大黃酸高劑量組與二甲雙胍組大鼠腎臟組織PI3K 與Akt 表達升高,FoxO1 表達降低,表明其可能通過干預腎臟PI3K/Akt/FoxO1 信號轉導通路,降低血糖,保護腎臟。

