氟苯尼考脅迫對土壤解磷菌解磷能力的影響
陶松若,廖翠怡,彭金菊,張騰月,戴 悅,馬 驛,2,3*
(1.廣東海洋大學濱海農業學院動物醫學系,廣東湛江 524088;2.嶺南現代農業科學與技術廣東省實驗室茂名分中心,廣東茂名 525032;3.粵西地區畜禽遺傳資源與種質創新重點實驗室,廣東湛江 524088)
土壤環境中存在著大量具有解磷能力的微生物,能夠將難溶性磷酸鹽轉化為植物可吸收利用的磷素[1]。據研究報道,施入解磷菌群能有效提高土壤中的有效磷、全磷含量以及堿性磷酸酶活性,進而促進油菜的生長發育,其中細菌的促進效果最明顯[2]。將解磷菌制成解磷菌肥施入土壤能提高玉米株高、氮磷含量,增加土壤的可溶性磷含量[3]。此外,解磷微生物釋放的磷素還可以降低土壤中重金屬的活性,減弱因外部環境使用含磷物質而導致的污染[4]。
氟苯尼考為動物專用抗生素,廣泛應用于動物細菌性疾病的防治[5]。氟苯尼考進入動物機體后,一部分藥物會在動物體內殘留,另一部分藥物及其代謝物隨著動物排泄物進入土壤中,給生態環境帶來污染[6]。抗生素進入土壤環境中能影響土壤微生物群落功能多樣性[7]。目前,有關氟苯尼考對解磷菌解磷能力的影響鮮見報道。該試驗利用鉬銻抗分光光度法,測定解磷菌在不同濃度氟苯尼考的條件下培養解磷能力之間的差異,旨在為氟苯尼考在環境中殘留對環境微生物產生的生態毒理影響提供理論依據。
1 材料與方法
1.1 材料
1.1.1供試土壤。采自廣東海洋大學校內菜地,經檢測不含氟苯尼考。土壤理化性質:pH 5.42、堿解氮22.16 mg/kg、全氮0.55 g/kg、速效磷46.80 mg/kg、速效鉀263.25 mg/kg、有機質10.97 g/kg、鹽度88 μS/cm。
1.1.2藥品與試劑。氟苯尼考(含量98%,山東國邦藥業有限公司,批號701-2005101);LB液體培養基、固體培養基(北京路橋技術股份有限公司);無機磷固體培養基(青島海博生物技術有限公司);無機磷液體培養基(北京酷來搏科技有限公司);抗壞血酸、酒石酸銻鉀、鉬酸銨、KH2PO4(上海易恩化學技術有限公司);無水乙醇、濃H2SO4均為分析純;氟苯尼考藥液(ρ=1 mg/mL):稱取0.05 g的氟苯尼考粉末,加入無水乙醇溶解,完全溶解后移入50 mL容量瓶中,用蒸餾水稀釋至刻度線。
1.1.3鉬銻抗分光光度法試劑。鉬銻抗分光光度法所需試劑參照王明歡等[8]的方法進行配制。①10%抗壞血酸:將10 g抗壞血酸(AR)用少量蒸餾水溶解后定容至100 mL,用棕色瓶保存于4 ℃。②13%鉬酸銨溶液:將13 g鉬酸銨(AR)用少量蒸餾水溶解后定容至100 mL。③0.35%酒石酸銻鉀溶液:將0.35 g酒石酸銻鉀(AR)用少量蒸餾水溶解后定容至100 mL。④硫酸溶液:將150 mL的濃硫酸(AR)用玻璃棒緩緩引流入150 mL蒸餾水中,配制成300 mL的硫酸溶液。⑤鉬酸鹽溶液:將13%鉬酸銨溶液用玻璃棒引流徐徐加入硫酸溶液中,再用玻璃棒攪拌充分混勻,待溶液冷卻后再緩緩加入0.35%酒石酸銻鉀溶液,冷卻后儲存在棕色玻璃瓶中于4 ℃保存。⑥磷酸鹽儲備溶液(ρ=100 mg/L):稱取0.439 0 g KH2PO4經105 ℃烘干2 h后溶于200 mL蒸餾水中,加入5 mL(1+1)濃硫酸,轉入1 000 mL容量瓶中,用蒸餾水定容至刻度。⑦磷酸鹽標準使用液(ρ=5 mg/L):量取5 mL 的磷酸鹽儲備溶液于100 mL容量瓶中,用蒸餾水定容至刻度,現配現用。
1.1.4主要儀器。可調微量移液器(Eppendorf,德國);生化培養箱(SPX-250,上海福絮實驗室儀器設備廠);不銹鋼手提式滅菌器(DSX-280B,上海滬粵明科學儀器有限公司);超凈工作臺(SW-CJ-1D,上海博迅實業有限公司醫療設備廠);電子天平(JJ323BC,常熟市萬杰測試儀器廠);臺式恒溫搖床(TS-100C,金壇市精達儀器制造有限公司);可見分光光度計(V-1000,上海翱藝儀器有限公司)。
1.2 方法
1.2.1解磷菌的分離培養。稱取土壤樣品用蒸餾水稀釋制備濃度適合的菌懸液,吸取菌懸液于無機磷固體培養基上,均勻涂布,30 ℃培養72 h。挑取具有明顯、透明溶磷圈的單一菌落,接種于LB液體培養基,30 ℃,180 r/min搖床振蕩培養24 h后加30%甘油于-20 ℃保存。采用DNA提取試劑盒提取細菌基因組并擴增16S rDNA片段,將擴增產物送至生物公司測序,測序結果在NCBI上Blast后對比分析。
1.2.2繪制磷標準曲線。分別吸取5 mg/L磷標準貯備液0、1、2、3、4、5、6 mL于50 mL容量瓶中,用蒸餾水定容至刻度,得到0.1、0.2、0.3、0.4、0.5、0.6 mg/L系列標準磷溶液,加入1 mL 抗壞血酸,充分混勻后加入2 mL鉬酸鹽,顯色20 min后用分光光度計讀取700 nm的吸光度。以蒸餾水作為參照,標準磷濃度作為橫坐標、OD700值作為縱坐標繪制標準曲線。
1.2.3磷含量測定。將菌株接種至LB液體培養基中,30 ℃培養過夜,作為種子液。于50 mL無機磷液體培養基中加入氟苯尼考使培養基中含藥濃度分別為0、0.1、1.0、10.0、50.0 μg/mL,按照1%的接種量將種子液加入藥物培養基中,加入等體積的蒸餾水作為空白對照,每組3個重復;在30 ℃的條件下,160 r/min搖床振蕩5 d,每24 h取2 mL培養液10 000 r/min離心10 min,取1 mL上清液移入50 mL 容量瓶中,用蒸餾水定容至刻度線,加入1 mL抗壞血酸,充分混勻后加入2 mL鉬酸鹽溶液,顯色20 min后用分光光度計讀取700 nm的吸光度。可溶性磷含量(mg/L)的計算公式為P=K×V/V1,式中,P為可溶性磷含量;K為從標準曲線得到的速效磷含量(mg/L);V為顯色液總體積(mL);V1為上清液體積(mL)[9]。
1.2.4細菌濃度測定。于培養的第5天量取細菌培養液,用LB液體培養基稀釋到適合的濃度。吸取不同濃度的細菌懸液各10 μL涂布于LB固體培養基上,30 ℃培養72 h,之后選取菌落長勢良好的平板進行細菌計數,菌液濃度計算公式:菌液濃度(CFU/mL)=(菌落數×稀釋度)/0.01。
1.3 數據統計與處理用Origin 2021函數繪圖軟件整理數據并作圖;試驗數據采用IBM SPSS Statistics 23統計分析軟件進行解磷菌溶磷含量的差異顯著性分析。
2 結果與分析
2.1 解磷菌16S rDNA鑒定結果測序結果經Blast后對比分析,分離的10株土壤優勢解磷菌主要為伯克霍爾德菌屬、羅爾斯頓菌屬和窄食單胞菌屬細菌。
2.2 磷標準曲線的繪制從圖1可以看出,磷標準溶液濃度及對應的吸光度的標準曲線方程為y=0.252 5x-0.000 7(R2=0.998 9),表明線性回歸良好。
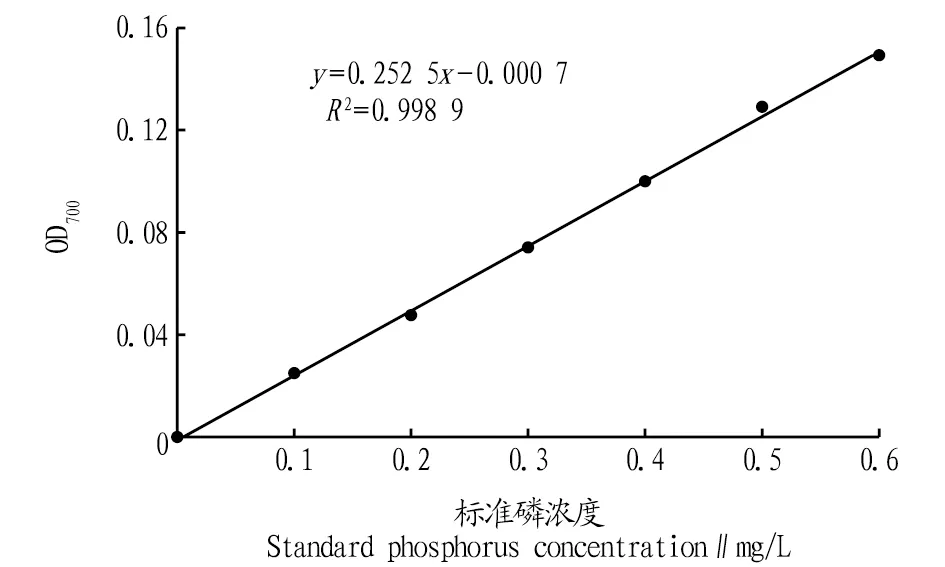
圖1 磷標準曲線Fig.1 Phosphorus standard curve
2.3 磷含量將從土壤中分離出的10株解磷菌于不同濃度氟苯尼考的條件下培養,每24 h測量其培養液中的速效磷含量,選取最具代表性的培養時間的測定值繪制曲線圖,10株解磷菌在不同藥物濃度下的溶磷效果見表1。從表1可以看出,10株解磷菌在50.0 μg/mL藥物濃度下,培養基中速效磷含量明顯低于其他藥物濃度組。其中,菌株P64、P33、P51、P53、P32、P42的溶磷含量隨藥物濃度的增加逐漸下降,與藥物濃度呈反比;菌株P35、P93在藥物濃度為0~0.1 μg/mL時,溶磷含量上升,藥物濃度為>0.1~50.0 μg/mL時,溶磷含量下降;而菌株P62、P13并沒有表現出規律的溶磷效果,P13的溶磷效果波動較大。

表1 10株解磷菌在不同藥物濃度下培養的溶磷效果
2.3 細菌濃度從10株解磷菌在第5天時菌液濃度(表2)可以看出,菌株P42的菌液濃度在藥物濃度為0~50.0 μg/mL 時整體呈上升趨勢;菌株P64在藥物濃度為0~10.0 μg/mL時,菌液濃度逐漸下降,在50.0 μg/mL時反而回升;菌株P51在藥物濃度為0~1.0 μg/mL時菌液濃度逐漸下降,在10.0 μg/mL時上升之后又回降;菌株P53的菌液濃度在藥物濃度為0~50.0 μg/mL時呈逐漸下降趨勢,在50.0 μg/mL 時降至0;而其他菌株在藥物濃度0~50.0 μg/mL時,菌液濃度并沒有太大變化。

表2 10株解磷菌培養第5天時菌液濃度
對10株解磷菌培養至第5天時的速效磷含量和菌液濃度進行相關性分析,結果如圖2所示。從線性方程可以看出,10株菌的速效磷含量與菌液濃度均無明顯相關性,r值為-0.311~0.879,P≥0.05,說明10株解磷菌溶磷效果的降低與菌體的生長繁殖并無明顯關聯。
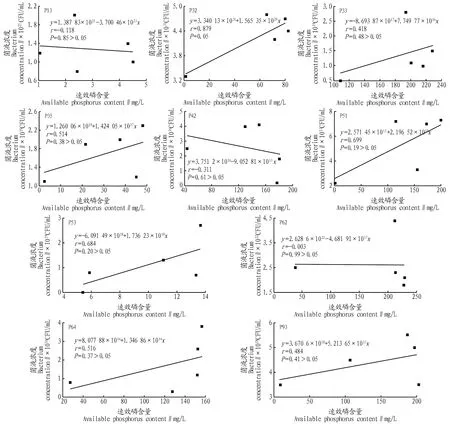
圖2 速效磷含量與菌液濃度相關性分析Fig.2 Correlation analysis between available phosphorus content and bacterial solution concentration
3 討論與結論
解磷菌主要有3種不同的解磷機理:一是解磷菌自身能分泌大量酸性物質,包括檸檬酸、草酸、酒石酸、乙酸、甲酸和琥珀酸等,這些酸性物質能溶解土壤中的難溶性磷酸鹽;二是解磷菌在進行呼吸作用時釋放出二氧化碳等物質,能增加土壤的酸度,從而增強難溶性磷酸鹽的溶解度[10];三是通過分泌磷酸酶、植酸酶等物質使有機磷酸酯或有機磷酸鹽降解,從而提高土壤中有效磷含量[11]。有學者研究發現,生物炭理化性質能夠刺激解磷微生物的生長與活性,增強解磷菌分泌磷酸酶的能力,從而提升解磷效果[12]。羅利均[13]通過紫外線-氯化鋰對解磷菌誘導變異,結果顯示,菌株的植酸酶基因phyC上的第81、89、148位氨基酸發生變異,該區域屬于植酸酶的結構功能域,菌株增加了2個對Ca2+的結合位點,進而增強了菌株的解磷能力。郭藝鵬等[14]對解磷菌進行常規培養發酵和滅活后培養發酵,發現常規培養的解磷菌都表現出較好的解磷能力,滅活后的解磷菌解磷能力基本消失。張晶晶等[15]將從土壤中分離得到的14株解磷菌用利福平進行標記,結果顯示,大多數解磷菌的解磷能力下降,有些菌株甚至失去解磷能力。該研究設置不同濃度的氟苯尼考對解磷菌的生長進行脅迫,當藥物濃度為50.0 μg/mL時,培養基中速效磷含量明顯比其他藥物濃度組的低;6株菌(P64、P33、P51、P53、P32、P42)的溶磷含量隨藥物濃度的增加逐漸下降;菌株P35、P93在藥物濃度為0~0.1 μg/mL時,溶磷含量上升,藥物濃度為0.1~50.0 μg/mL時,溶磷含量下降;而菌株P62、P13并沒有表現出規律的溶磷效果,P13的溶磷效果有較大的波動。在高濃度藥物條件下,菌株的溶磷效果下降,然而對應的菌液濃度卻沒有太大的變化,相關性分析結果顯示,10株菌的培養液中速效磷含量與菌液濃度并無明顯相關性,說明菌株溶磷效果的下降與菌液的生長繁殖關聯并不大。
抗生素在微生物環境中殘留,會增加細菌產生耐藥性的風險,抗生素的種類和濃度的增加也可能改變微生物群落結構多樣性和功能[16],還會對微生物的碳源利用率、特殊菌群的功能結構及酶活性等產生抑制作用[17]。當土壤中磺胺甲噁唑的殘留濃度達到100 mg/kg時,土壤中微生物種群密度在7 d后能觀察到明顯下降,且對糖類的利用率也有抑制作用[18]。土壤中土霉素的殘留濃度達到140 mg/kg時,微生物利用碳源的種類被顯著改變,土壤中脲酶活性及堿性磷酸酶活性受到明顯抑制[19]。該研究在培養基中加入不同濃度的氟苯尼考,當藥物濃度為50.0 μg/mL時,解磷菌的解磷能力顯著下降,說明高濃度氟苯尼考對解磷菌的解磷功能產生了抑制。

