淡豆豉炮制過(guò)程中不產(chǎn)毒黃曲霉菌的分布特征及其對(duì)產(chǎn)毒菌的拮抗作用
李翠英,賀 婧,戴家齊,龍 凱,王立元,周立分,楊安金,徐 佳,翁美芝*,謝小梅*
淡豆豉炮制過(guò)程中不產(chǎn)毒黃曲霉菌的分布特征及其對(duì)產(chǎn)毒菌的拮抗作用
李翠英1,賀 婧2#,戴家齊1,龍 凱1,王立元1,周立分1,楊安金3,徐 佳1,翁美芝1*,謝小梅1*
1. 江西中醫(yī)藥大學(xué),江西 南昌 330004 2. 南昌大學(xué)轉(zhuǎn)化醫(yī)學(xué)研究院,江西 南昌 330031 3. 江西中醫(yī)藥大學(xué)附屬醫(yī)院,江西 南昌 330006
明確淡豆豉炮制中不產(chǎn)毒黃曲霉菌的分布特征及其拮抗能力。按實(shí)驗(yàn)室前期已建立的規(guī)范炮制工藝制備淡豆豉,獲取淡豆豉炮制中9個(gè)不同時(shí)間點(diǎn)的樣本,各樣本用氯硝胺18%甘油培養(yǎng)基(DG-18)進(jìn)行培養(yǎng)、分離純化,經(jīng)形態(tài)學(xué)初篩、分子生物學(xué)鑒定為黃曲霉菌。通過(guò)紫外熒光法初篩和超高效液相色譜-串聯(lián)質(zhì)譜法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)測(cè)定黃曲霉菌產(chǎn)毒能力,確定為不產(chǎn)毒黃曲霉菌(簡(jiǎn)稱(chēng):不產(chǎn)毒菌)。用平板對(duì)峙法檢測(cè)不產(chǎn)毒菌及其代謝產(chǎn)物對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株(產(chǎn)毒菌)生長(zhǎng)的影響。從淡豆豉炮制過(guò)程中共篩選出21株不產(chǎn)毒菌,其中“黃衣上遍”過(guò)程中的第3、6天分別篩選出3、6株,“再悶”過(guò)程中的第3、6、9天分別篩選出2、7、3株,再悶第6天篩選到的不產(chǎn)毒菌最多。不產(chǎn)毒菌對(duì)產(chǎn)毒菌的生長(zhǎng)抑制率在26.75%~36.69%,抑制效果最好的是F6-L8(指第1批在“黃衣上遍”階段的發(fā)酵第6天樣品中篩選到的第8株疑似黃曲霉菌),為36.69%,發(fā)酵上清液對(duì)產(chǎn)毒菌的抑制率在14.29%~43.23%,抑制效果最好的是Z3-X1(指第2批在“再悶”階段的第3天樣品中篩選到的第1株疑似黃曲霉菌),達(dá)43.23%。淡豆豉炮制過(guò)程中存在不產(chǎn)毒黃曲霉菌,且在炮制的不同時(shí)間點(diǎn)其數(shù)量變化呈現(xiàn)“上升-下降-再上升-再下降”的獨(dú)特趨勢(shì),不產(chǎn)毒菌及其發(fā)酵液具有抑制產(chǎn)毒菌生長(zhǎng)的作用。為進(jìn)一步研究不產(chǎn)毒黃曲霉菌在淡豆豉炮制過(guò)程中的作用、黃曲霉毒素污染的生物防控提供實(shí)驗(yàn)依據(jù)。
淡豆豉;黃曲霉毒素;不產(chǎn)毒黃曲霉菌;超高效液相色譜-串聯(lián)質(zhì)譜技術(shù);拮抗能力;黃衣上遍;再悶
淡豆豉是豆科大豆屬植物大豆(L.) Merr.的成熟種子的發(fā)酵品,以黑色種皮品系大豆為主料,桑葉、青蒿為輔料經(jīng)自然發(fā)酵而成的藥食兩用傳統(tǒng)中藥。黃曲霉毒素(aflatoxins,AFTs)是黃曲霉菌、寄生曲霉菌等產(chǎn)生的一類(lèi)劇毒次生代謝產(chǎn)物,目前發(fā)現(xiàn)AFTs有20多種,其中以黃曲霉毒素B1(aflatoxin B1,AFB1)毒性最強(qiáng),具有強(qiáng)烈的致癌、致畸和致突變作用[1]。在我國(guó)產(chǎn)AFTs的曲霉菌主要為黃曲霉菌,并不是所有的黃曲霉菌都產(chǎn)AFTs,產(chǎn)毒黃曲霉菌(簡(jiǎn)稱(chēng):產(chǎn)毒菌)約占自然界黃曲霉菌的30%~80%,從世界各地分離的黃曲霉菌產(chǎn)AFTs能力有很大差別,不產(chǎn)毒黃曲霉菌(簡(jiǎn)稱(chēng)不產(chǎn)毒菌)在我國(guó)常作為曲種應(yīng)用于黃酒生產(chǎn)[2]。
迄今未見(jiàn)我國(guó)傳統(tǒng)發(fā)酵豆制品中黃曲霉菌的相關(guān)研究,僅本實(shí)驗(yàn)室從2021年開(kāi)始關(guān)注淡豆豉炮制中的黃曲霉菌、AFTs。本課題組前期研究已發(fā)現(xiàn)在淡豆豉炮制過(guò)程中AFTs含量呈動(dòng)態(tài)變化[3];用曲霉素培養(yǎng)基從淡豆豉炮制不同時(shí)間點(diǎn)樣本中分離出不同產(chǎn)毒能力的7株黃曲霉菌,3株不產(chǎn)毒菌[4]。研究表明,不產(chǎn)毒菌能夠有效抑制產(chǎn)毒菌的產(chǎn)毒[5]。
基于此,本研究應(yīng)用黃曲霉菌的最佳培養(yǎng)基——氯硝胺18%甘油培養(yǎng)基(DG18),嘗試從淡豆豉炮制過(guò)程的不同時(shí)間點(diǎn)樣本中分離出更多的不產(chǎn)毒菌,并同時(shí)考察其對(duì)產(chǎn)毒菌的拮抗作用。研究成果對(duì)揭示淡豆豉的炮制機(jī)制、將不產(chǎn)毒菌應(yīng)用于中藥材、發(fā)酵類(lèi)中藥和食品加工中消除AFTs污染開(kāi)辟新途徑。
1 材料與儀器
產(chǎn)毒黃曲霉標(biāo)準(zhǔn)株,購(gòu)于中國(guó)普通微生物菌種保藏中心,編號(hào)CGMCC3.4408;溜曲霉菌(MA3)、黑曲霉菌(JC2)、桔青霉菌(ME3)均為本實(shí)驗(yàn)室從淡豆豉炮制過(guò)程中篩選鑒定并保存,由江西中醫(yī)藥大學(xué)謝小梅教授和王立元副教授鑒定和命名;曲霉素瓊脂培養(yǎng)基,批號(hào)20191026,青島海博生物技術(shù)有限公司;DG18瓊脂基礎(chǔ),批號(hào)20210916,北京奧博星生物技術(shù)有限責(zé)任公司;AFTs混合對(duì)照品(AFB1、AFB2、AFG1、AFG2),批號(hào)2A00I21,質(zhì)量濃度分別為1.0、0.3、1.0、0.3 μg/mL,質(zhì)量分?jǐn)?shù)≥98.0%,Pribolab公司;植物基因組DNA提取試劑盒、2×Taq PCR master Mix,批號(hào)Cat#DP305-02、Cat.CW0632S,北京天根生化科技有限公司;HypersilGold(100 mm×2.1 mm,1.7 μm)柱,賽默飛世爾科技有限公司;甲醇、乙腈,批號(hào)2003191、20022221,上海易恩化學(xué)技術(shù)有限公司。MJ-150I型霉菌培養(yǎng)箱,上海一恒科技有限公司;Nexera X2型超快速液相色譜儀,日本島津公司;AB Sciex QTRAP 4500型三重四極桿線性離子肼串聯(lián)質(zhì)譜儀,美國(guó)AB Sciex公司。
2 方法與結(jié)果
2.1 淡豆豉的炮制和取樣
本課題組參照《中國(guó)藥典》2010年版已建立規(guī)范的淡豆豉炮制工藝(歷版《中國(guó)藥典》記載的淡豆豉制法相同,含2020年版)。本實(shí)驗(yàn)按此法制備淡豆豉并分別獲取炮制過(guò)程中不同時(shí)間點(diǎn)樣本。具體操作如下:取桑葉90 g、青蒿100 g,分次加入10、8倍生藥量的水煎煮1 h,濾過(guò),合并濾液并濃縮至1000 mL,晾涼拌于1000 g凈黑大豆中,浸泡6 h,待黑大豆充分膨脹,煎煮液吸收完全,1.5 h隔水蒸透,取出,稍晾,再置容器內(nèi),用煎過(guò)的桑葉、青蒿渣鋪底并覆蓋豆粒,放置于溫度為(30±2)℃,濕度為70%的恒溫恒濕培養(yǎng)箱中發(fā)酵6 d至“黃衣上遍”。取出,除去藥渣,洗凈,置于陶瓷罐內(nèi),在溫度為(30±2)℃,濕度為70%的恒溫恒濕培養(yǎng)箱“再悶”15 d(每3天翻動(dòng)1次)。至充分發(fā)酵、香氣溢出時(shí),取出,隔水蒸0.5 h,干燥即得。“黃衣上遍”階段中,取發(fā)酵第0、3、6天樣品,記為F0、F3、F6;“再悶”階段中,取再悶第3、6、9、12、15天樣品和蒸后成品,依次記為Z3、Z6、Z9、Z12、Z15和SSP,各樣品放4 ℃冰箱儲(chǔ)存,在1周之內(nèi)檢測(cè)。
2.2 淡豆豉炮制過(guò)程中黃曲霉菌的篩選和分離
取適量淡豆豉炮制不同時(shí)間點(diǎn)樣品,研碎,精密稱(chēng)取研碎后的樣品各10 g,加90 mL無(wú)菌生理鹽水,搖床振蕩30 min,取1 mL液體,用無(wú)菌生理鹽水依次梯度稀釋?zhuān)玫?.1、0.01、0.001、1×10?4、1×10?5、1×10?6、1×10?7的稀釋液,F(xiàn)3、Z3、Z6選擇0.001、1×10?4、1×10?5稀釋液,F(xiàn)6選擇1×10?4、1×10?5、1×10?6稀釋液,F(xiàn)0、Z9、Z12、Z15、SSP選擇0.1、0.01、0.001稀釋液,分別取100 μL加入到DG18培養(yǎng)基平皿中涂布均勻,每個(gè)稀釋度做3個(gè)平行,于培養(yǎng)箱中28 ℃避光培養(yǎng)5~8 d。
待培養(yǎng)皿上開(kāi)始形成孢子時(shí),將呈明黃色疑似黃曲霉菌的單菌落孢子轉(zhuǎn)接到新的DG18培養(yǎng)基上,在28 ℃避光倒置培養(yǎng)3~5 d。用液體石蠟斜面保存初篩菌株并編號(hào)。菌株命名遵循以下規(guī)律:“F”和“Z”分別表示“黃衣上遍”階段和“再悶”階段,“L”表示第1批篩選的菌株,“X”表示第2批擴(kuò)篩的菌株(先后2批菌株是在同1批次淡豆豉樣本中篩選,用“L”和“X”編號(hào)區(qū)分),如“F6-L5”指第1批在“黃衣上遍”階段的發(fā)酵第6天樣品中篩選到的第5株疑似黃曲霉菌;“Z3-X1”指第2批在“再悶”階段的第3天樣品中篩選到的第1株疑似黃曲霉菌,依此類(lèi)推。
2.3 不產(chǎn)毒黃曲霉菌的篩選和鑒定
2.3.1 形態(tài)學(xué)初步鑒定[6]將分離的疑似黃曲霉菌于曲霉素瓊脂培養(yǎng)基(AFPA)平皿上培養(yǎng)3~5 d,選擇培養(yǎng)基背面為亮橘色的菌株進(jìn)行分子鑒定。結(jié)果有61株待測(cè)菌在AFPA培養(yǎng)基背部形成了溜曲霉菌、黑曲霉菌、桔青霉菌等截然不同的亮橙黃色的特征菌落,如圖1所示,初步鑒定為黃曲霉菌。
2.3.2 紫外熒光法初篩 將初步篩選的疑似黃曲霉菌接種在含有2,6-二甲基-β-環(huán)糊精的PDA培養(yǎng)基上,于28 ℃霉菌培養(yǎng)箱培養(yǎng)5~8 d。將培養(yǎng)基置于波長(zhǎng)365 nm紫外燈下觀察。利用黃曲霉毒素在該波長(zhǎng)紫外燈下顯藍(lán)紫色或者黃綠色熒光這一特性,可初步區(qū)分產(chǎn)毒和不產(chǎn)毒的黃曲霉菌。結(jié)果產(chǎn)毒黃曲霉菌菌落周?chē)@藍(lán)紫色,如圖2所示。
2.3.3 分子生物學(xué)鑒定 采用植物基因組DNA提取試劑盒提取各菌株DNA,18S rDNA通用引物ITS1/ITS4(ITS1:5’-CTTGGTCATTTAGAGGAAG- TAA-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’)進(jìn)行擴(kuò)增。PCR反應(yīng)體系:模板DNA 2 μL,上下游引物各1 μL(濃度10 μmol/L),2×Taq PCR master Mix 12.5 μL,補(bǔ)充ddH2O至25 μL。反應(yīng)程序:94 ℃、1 min;94 ℃、30 s,56 ℃、30 s,72 ℃、1 min,30個(gè)循環(huán);72 ℃、10 min。
擴(kuò)增產(chǎn)物用1%瓊脂糖凝膠電泳,將PCR產(chǎn)物送測(cè)序公司測(cè)序。測(cè)序結(jié)果在NCBI網(wǎng)站上比對(duì)、下載同源性高的序列及模式菌株的序列在MEGA 7.0軟件上建系統(tǒng)發(fā)育樹(shù)。結(jié)果與黃曲霉菌相似度達(dá)99%以上,鑒定為黃曲霉菌,結(jié)果見(jiàn)表1。構(gòu)建系統(tǒng)發(fā)育樹(shù)如圖3所示。
2.4 UPLC-MS/MS法測(cè)定黃曲霉菌的產(chǎn)AFTs能力
本課題組前期已建立UPLC-MS/MS法測(cè)定黃曲霉菌的產(chǎn)AFTs能力。具體色譜及質(zhì)譜條件參考本實(shí)驗(yàn)室前期實(shí)驗(yàn)結(jié)果[4]。
2.4.1 對(duì)照品溶液的制備 精密吸取AFTs混合對(duì)照品(AFB1、AFB2、AFG1、AFG2質(zhì)量濃度分別為1.00、0.03、1.00、0.03 μg/mL)溶液0.5 mL于1 mL棕色量瓶中,用甲醇稀釋至刻度,于?20 ℃冰箱避光保存,備用。
2.4.2 供試品溶液的制備[4]將活化好的黃曲霉菌分別加入適量無(wú)菌生理鹽水洗脫孢子,無(wú)菌紗布濾過(guò)制成孢子懸浮液,血球計(jì)數(shù)板計(jì)數(shù),調(diào)整孢子濃度為1×106.59cfu/mL。吸取2 mL各孢子懸浮液于25 mL液體發(fā)酵培養(yǎng)基中,置28 ℃、120 r/min搖床中培養(yǎng)5 d。分別吸取1.5 mL發(fā)酵液于2 mL離心管中,10 000×離心10 min,取1 mL各發(fā)酵上清液用氮?dú)獯抵两桑蛹状紡?fù)溶,12 000×離心10 min,取上清液經(jīng)0.22 μm濾膜濾過(guò),上機(jī)測(cè)定。
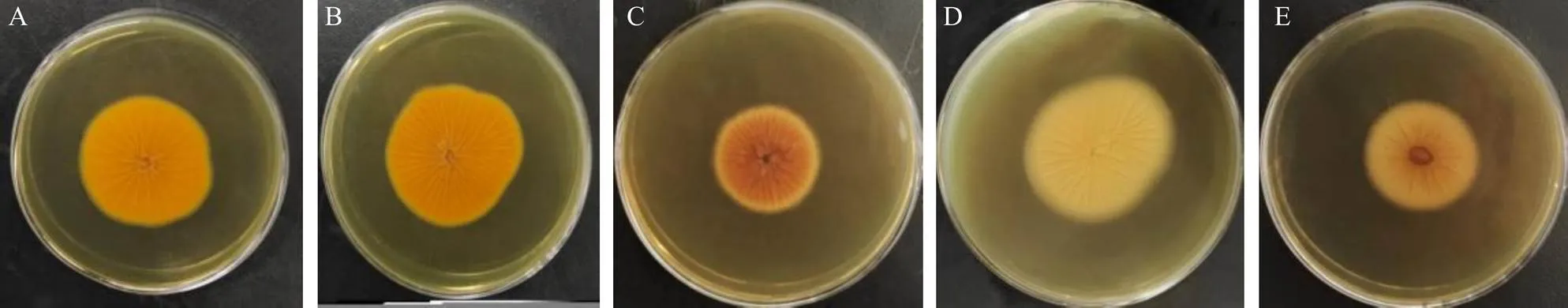
A-產(chǎn)毒標(biāo)準(zhǔn)黃曲霉菌 B-淡豆豉中分離的黃曲霉菌 C-溜曲霉菌 D-黑曲霉菌 E-桔青霉菌

A-產(chǎn)毒標(biāo)準(zhǔn)黃曲霉菌 B-淡豆豉中分離的產(chǎn)毒黃曲霉菌 C、D-不產(chǎn)毒黃曲霉菌

表1 黃曲霉菌NCBI基因序列比對(duì)結(jié)果
2.4.3 UPLC-MS/MS法方法學(xué)考察
(1)線性關(guān)系考察:精密吸取AFTs混合對(duì)照品溶液,用甲醇稀釋成建立標(biāo)準(zhǔn)曲線的系列質(zhì)量濃度,混勻,上機(jī)測(cè)定。將質(zhì)量濃度作為橫坐標(biāo)(),各質(zhì)量濃度對(duì)應(yīng)的峰面積作縱坐標(biāo)(),進(jìn)行線性回歸,得回歸方程:AFB1=4300+849,= 0.999 1;AFB2=3570+107,=0.999 4;AFG1=1930+255,=0.999 4;AFG2=3760-50.5,=0.999 9;結(jié)果表明,AFB1、AFG1在0.5~200.0 ng/mL線性關(guān)系良好,AFB2、AFG2在0.3~60.0 ng/mL線性關(guān)系良好。
(2)精密度考察:配制AFTs混合對(duì)照品溶液(AFB1和AFG1質(zhì)量濃度為5 ng/mL,AFB2和AFG2質(zhì)量濃度為1.5 ng/mL),連續(xù)重復(fù)進(jìn)樣6次。AFB1、AFB2、AFG1、AFG2峰面積的RSD分別為1.26%、1.48%、0.85%、2.52%,表明儀器精密度良好。
(3)穩(wěn)定性考察:取無(wú)菌發(fā)酵液1份,加AFTs混合對(duì)照品(AFB1和AFG1加入量為5 ng/mL,AFB2和AFG2加入量為1.5 ng/mL)制備供試品溶液,分別于0、4、8、12、16、20、24 h測(cè)定,以4種AFTs質(zhì)量分?jǐn)?shù)來(lái)計(jì)算,RSD分別為1.60%、1.82%、2.38%、2.10%,表明供試品溶液在24 h內(nèi)穩(wěn)定性良好。
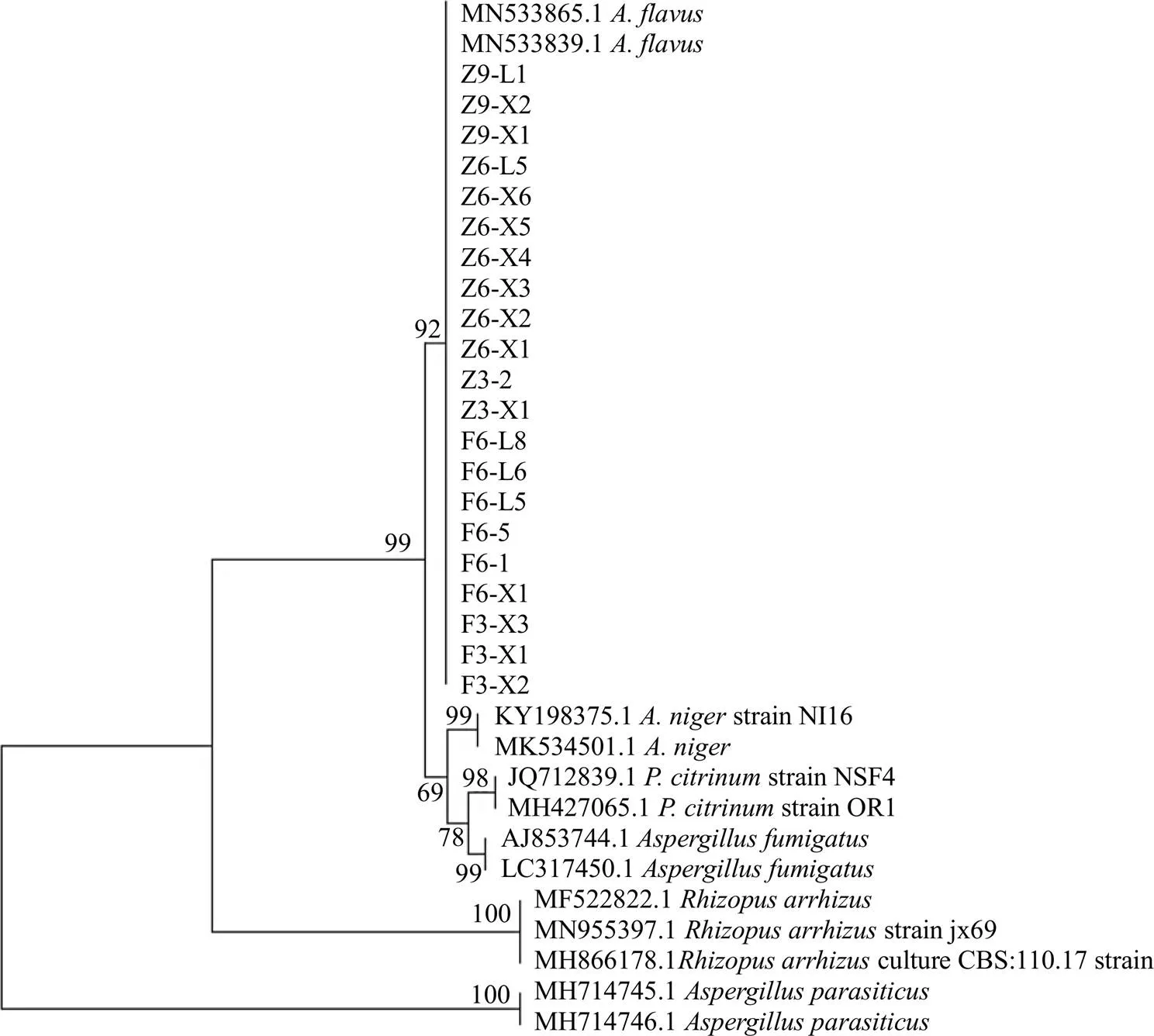
圖3 曲霉菌系統(tǒng)發(fā)育樹(shù)
(4)重復(fù)性考察:平行取無(wú)菌發(fā)酵液6份,精密加AFTs混合對(duì)照品(AFB1、AFG1加入量為5 ng/mL,AFB2、AFG2加入量為1.5 ng/mL)溶液,分別進(jìn)樣2 μL進(jìn)行測(cè)定,以4種AFTs質(zhì)量分?jǐn)?shù)來(lái)計(jì)算,AFB1、AFB2、AFG1、AFG2的RSD分別為1.69%、2.89%、1.04%、2.39%,表明該方法重復(fù)性良好。
(5)加樣回收率考察:平行取無(wú)菌發(fā)酵液6份,分別精密加入低、中、高3種質(zhì)量濃度的AFTs混合對(duì)照品溶液(AFB1和AFG1分別添加5、50、100 ng/mL,AFB2和AFG2分別添加1.5、15、30 ng/mL),每種質(zhì)量濃度各3份,計(jì)算加樣回收率,4種AFTs的加樣回收率為92.63%~98.84%,RSD在1.14%~2.23%。
2.4.4 黃曲霉菌的產(chǎn)毒能力分析 采用UPLC-MS/ MS法測(cè)定黃曲霉菌的產(chǎn)毒能力,結(jié)果得到18株不產(chǎn)毒的黃曲霉菌株,見(jiàn)圖4。本課題組前期已篩選出10株黃曲霉菌,其中3株是不產(chǎn)毒黃曲霉菌[4]。結(jié)合本課題組前期的篩選結(jié)果,本實(shí)驗(yàn)室一共篩選到71株黃曲霉菌,其中21株為不產(chǎn)毒的黃曲霉菌,不產(chǎn)毒黃曲霉菌在淡豆豉炮制過(guò)程中不同時(shí)間點(diǎn)的分布情況見(jiàn)表2。

A、B-產(chǎn)毒黃曲霉菌F6-L7、Z6-L2 C、D-不產(chǎn)毒黃曲霉菌F3-X2、Z9-L1

表2 淡豆豉炮制過(guò)程中不產(chǎn)毒黃曲霉菌在不同時(shí)間點(diǎn)的分布情況
不產(chǎn)毒菌占比=不產(chǎn)毒菌株數(shù)/黃曲霉菌株數(shù)
proportion of non-toxic bacteria = number of non-toxic bacteria/number of
2.5 不產(chǎn)毒菌的拮抗能力測(cè)定
2.5.1 兩點(diǎn)對(duì)峙培養(yǎng)法檢測(cè)不產(chǎn)毒菌對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株CGMCC3.4408生長(zhǎng)的抑制作用 將1×105cfu/mL的標(biāo)準(zhǔn)株孢子液10 μL接于PDA培養(yǎng)基的一側(cè),于另一側(cè)相同距離處接種等體積的各待測(cè)菌孢子液。以僅接種1×105cfu/mL的標(biāo)準(zhǔn)株孢子于培養(yǎng)基的一側(cè)作為對(duì)照組,分別置于28 ℃霉菌培養(yǎng)箱培養(yǎng)5 d,量取并記錄標(biāo)準(zhǔn)株菌落直徑,每組3個(gè)平行。結(jié)果見(jiàn)表3和圖5,平板對(duì)峙法發(fā)現(xiàn)有4株不產(chǎn)毒黃曲霉對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株生長(zhǎng)的抑制作用相對(duì)明顯,抑制率達(dá)到了35%以上,分別為F3-X2 36.41%、Z9-X2 36.13%、F6-L8 36.69%和F6-L5 35.15%。
抑菌率=(對(duì)照組菌落直徑-實(shí)驗(yàn)組菌落直徑)/對(duì)照組菌落直徑
2.5.2 不產(chǎn)毒菌發(fā)酵上清液對(duì)產(chǎn)毒菌的抑制作用 取各待測(cè)菌發(fā)酵液離心,上清液過(guò)濾除菌后吸取8 mL加入培養(yǎng)皿中,傾注20 mL PDA培養(yǎng)基與之混勻,在平皿中央接種20 μL 1×105cfu/mL的黃曲霉標(biāo)準(zhǔn)株孢子液,以平皿中央僅接種1×105cfu/mL黃曲霉標(biāo)準(zhǔn)株孢子液作對(duì)照。分別置28 ℃霉菌培養(yǎng)箱培養(yǎng)5 d,記錄菌落直徑,計(jì)算抑菌率,每組3個(gè)平行[7]。結(jié)果見(jiàn)表3和圖6,有4株不產(chǎn)毒黃曲霉發(fā)酵液對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株生長(zhǎng)的抑制作用相對(duì)明顯,抑制率達(dá)到了35%以上,分別為Z3-X1(43.23%)、Z6-X3(35.71%)、Z6-X4(35.09%)、Z9-X2(42.36%)。
表3 不產(chǎn)毒菌孢子液及其發(fā)酵上清液對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株生長(zhǎng)的影響(, n = 3)
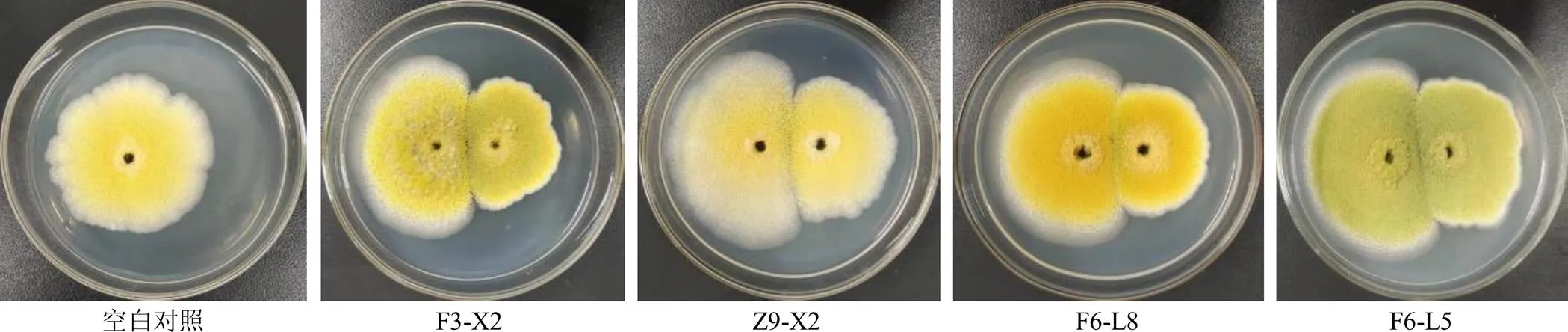
左側(cè)為產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株,右側(cè)為各不產(chǎn)毒黃曲霉菌

圖6 各不產(chǎn)毒菌發(fā)酵上清液對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株的影響
3 討論
自然界中存在大量產(chǎn)毒能力不同的黃曲霉菌。國(guó)內(nèi)外從大豆、花生等農(nóng)產(chǎn)品以及酒類(lèi)制品中篩選不產(chǎn)毒黃曲霉的報(bào)道屢見(jiàn)不鮮[8-10]。但從發(fā)酵制品、中藥材中篩選分離出不產(chǎn)毒黃曲霉菌的報(bào)道很少,僅在一些發(fā)酵茶的發(fā)酵過(guò)程中發(fā)現(xiàn)有黃曲霉菌大量生長(zhǎng),黃曲霉菌的生長(zhǎng)受到了原料茶中微生物、抗氧化組分等的抑制作用,黃曲霉菌的產(chǎn)毒能力大大減弱,甚至檢測(cè)不到黃曲霉毒素[11-12]。
本研究借鑒研究者對(duì)我國(guó)土壤、花生中黃曲霉菌的研究成果[13],從淡豆豉炮制不同時(shí)間點(diǎn)中分離出黃曲霉菌71株,經(jīng)紫外熒光初篩和UPLC-MS/MS篩選到21株不產(chǎn)毒菌。經(jīng)分析,淡豆豉自然發(fā)酵過(guò)程中,不同時(shí)間點(diǎn)樣品中黃曲霉菌的數(shù)量分布存在呈現(xiàn)出“上升-下降-再上升-再下降”的“M”型獨(dú)特趨勢(shì)。其中“黃衣上遍”階段的發(fā)酵第6天(F6)和“再悶階段”第6天(Z6)樣品中黃曲霉菌株數(shù)量較多,分別為27株和18株,發(fā)酵第0天(F0)樣品和淡豆豉成品(SSP)中均未篩選到黃曲霉菌,說(shuō)明在淡豆豉炮制中,產(chǎn)毒菌與不產(chǎn)毒菌既不由原料中攜帶,也并未出現(xiàn)在淡豆豉成品中,只在炮制過(guò)程中產(chǎn)生和分布。值得注意的是,從淡豆豉炮制不同時(shí)間點(diǎn)樣品中篩選到的不產(chǎn)毒黃曲霉菌株數(shù)量和黃曲霉菌株數(shù)量分布呈現(xiàn)相似的“M”型變化趨勢(shì)(表3),這表明樣本中黃曲霉菌的基數(shù)與能篩選到的不產(chǎn)毒黃曲霉菌數(shù)量呈正相關(guān)。
黃曲霉菌不產(chǎn)毒,與其毒素合成基因以及調(diào)控毒素次級(jí)代謝的相關(guān)基因的缺失或非正常表達(dá)有密切聯(lián)系[14],在淡豆豉自然發(fā)酵過(guò)程中,拮抗微生物和炮制逆環(huán)境的雙重作用加大了黃曲霉毒素合成基因和調(diào)控基因突變和抑制表達(dá)的可能。這可能也是淡豆豉炮制中所篩選到的黃曲霉菌不產(chǎn)毒率相較自然環(huán)境高的主要原因。且從產(chǎn)毒菌和不產(chǎn)毒菌呈現(xiàn)相似分布趨勢(shì)的實(shí)驗(yàn)結(jié)果來(lái)看,淡豆豉炮制中某一時(shí)間點(diǎn)黃曲霉菌基數(shù)越大,不產(chǎn)毒黃曲霉菌分布也就越多,反之亦然。這可能是因?yàn)樵诘刽谥频奶厥猸h(huán)境下,某一時(shí)間點(diǎn)較大的黃曲霉菌基數(shù)同時(shí)也增大了相關(guān)毒素合成和調(diào)控基因的突變頻率,使不產(chǎn)毒黃曲霉菌數(shù)隨之增加,反之亦然。
本實(shí)驗(yàn)從淡豆豉炮制過(guò)程中分離出的產(chǎn)毒菌和不產(chǎn)毒菌株數(shù)量呈現(xiàn)的這種獨(dú)特“M”型趨勢(shì),不僅和淡豆豉炮制工藝及發(fā)酵環(huán)境有直接聯(lián)系,還與發(fā)酵過(guò)程中其他微生物數(shù)量的更迭密切相關(guān),“黃衣上遍”階段中發(fā)酵第0~6天,由于處于開(kāi)放環(huán)境,O2含量充足且溫濕度適宜,空氣中黃曲霉、溜曲霉、酵母菌等需氧真菌數(shù)量上升,該過(guò)程對(duì)應(yīng)“M”型趨勢(shì)的”上升”段,進(jìn)入“再悶”前需洗去黃衣,該操作將豆粒表面包括黃曲霉菌在內(nèi)的多種微生物數(shù)量減少,對(duì)應(yīng)“M”型趨勢(shì)的”下降”段,進(jìn)入“再悶”階段初始黃曲霉菌數(shù)量有所上升,可能原因如下:(1)洗凈操作清除了大部分發(fā)酵微生物,有利于黃曲霉菌的競(jìng)爭(zhēng)繁殖;(2)發(fā)酵環(huán)境密閉,但O2還有部分殘留,能使需氧的黃曲霉菌等微生物數(shù)量有所上升;(3)由于O2含量的驟減,厭氧細(xì)菌的繁殖也會(huì)抑制黃曲霉菌的繁殖,使得“再悶”階段前期黃曲霉菌的增長(zhǎng)速度不及之前,該過(guò)程反應(yīng)對(duì)應(yīng)于于“M”型趨勢(shì)的“再上升”段;至“再悶”第6天黃曲霉菌數(shù)再達(dá)峰值之后,由于枯草芽孢桿菌和乳酸菌等細(xì)菌逐漸成為優(yōu)勢(shì)菌[15],加之O2含量的進(jìn)一步減少等因素,“再悶”第9天黃曲霉菌數(shù)量開(kāi)始下降,直至“再悶”第12天后再未篩選到黃曲霉菌,對(duì)應(yīng)“M”型趨勢(shì)的“再下降”段。
一系列拮抗微生物,如細(xì)菌[7,16]、酵母和真菌已用于黃曲霉毒素污染的生物防治[17]。使用不產(chǎn)毒黃曲霉菌抑制AFTs合成也是減少黃曲霉毒素污染的有效策略[18]。研究表明,不產(chǎn)毒黃曲霉菌會(huì)對(duì)產(chǎn)毒菌形成競(jìng)爭(zhēng)抑制作用[19]。另外,部分研究表明不產(chǎn)毒菌株釋放的揮發(fā)性有機(jī)化合物組合可以顯著減少產(chǎn)毒菌株產(chǎn)生的AFTs和環(huán)哌唑酸[20]。本實(shí)驗(yàn)結(jié)果表明不產(chǎn)毒菌對(duì)產(chǎn)毒黃曲霉菌標(biāo)準(zhǔn)株生長(zhǎng)抑制率在26.75%~36.69%,提示不產(chǎn)毒菌對(duì)標(biāo)準(zhǔn)黃曲霉菌形成了明顯的競(jìng)爭(zhēng)抑制。
另外,本實(shí)驗(yàn)還采用除菌后的不產(chǎn)毒菌發(fā)酵上清液對(duì)產(chǎn)毒標(biāo)準(zhǔn)株進(jìn)行抑制實(shí)驗(yàn),排除了不產(chǎn)毒菌菌株本身的干擾,結(jié)果顯示抑制率在14.29%~43.23%。這表明不產(chǎn)毒黃曲霉菌發(fā)酵次級(jí)代謝產(chǎn)物也會(huì)對(duì)產(chǎn)毒標(biāo)準(zhǔn)株形成抑制,本研究可為淡豆豉AFTs的精準(zhǔn)防控提供科學(xué)依據(jù),將不產(chǎn)毒菌應(yīng)用于中藥材、發(fā)酵類(lèi)中藥和食品加工中消除AFTs污染開(kāi)辟新途徑。本實(shí)驗(yàn)室后續(xù)將進(jìn)一步研究不產(chǎn)毒黃曲霉菌的不產(chǎn)毒機(jī)制和拮抗機(jī)制。
利益沖突 所有作者均聲明不存在利益沖突
[1] 張寧慧, 王瑱, 毛垣元, 等. 植物精油及活性成分防控黃曲霉生長(zhǎng)及其毒素產(chǎn)生的研究進(jìn)展 [J]. 中草藥, 2020, 51(20): 5348-5359.
[2] 夏艷秋, 朱強(qiáng), 汪志君. 高產(chǎn)糖化酶黃曲霉菌的選育及初步應(yīng)用 [J]. 微生物學(xué)通報(bào), 2009, 36(10): 1542-1546.
[3] 馬書(shū)偉, 李春玲, 周鴻, 等. 淡豆豉炮制過(guò)程中黃曲霉毒素含量的動(dòng)態(tài)變化規(guī)律分析 [J]. 中國(guó)醫(yī)院藥學(xué)雜志, 2022, 42(21): 2216-2219.
[4] 李春玲, 賀婧, 王立元, 等. 淡豆豉炮制中黃曲霉毒素產(chǎn)毒株的篩選鑒定和產(chǎn)毒能力測(cè)定 [J]. 中草藥, 2022, 53(5): 1411-1417.
[5] Schamann A, Schmidt-Heydt M, Geisen R. Analysis of the competitiveness between a non-aflatoxigenic and an aflatoxigenicstrain on maize kernels by droplet digital PCR [J]., 2022, 38(1): 27-36.
[6] 劉俊, 張國(guó)朋, 張智猛, 等. 不產(chǎn)毒黃曲霉菌株的篩選鑒定及分子機(jī)理研究 [J]. 花生學(xué)報(bào), 2018, 47(3): 8-13.
[7] 李春玲, 賀婧, 王立元, 等. 淡豆豉炮制過(guò)程中拮抗菌對(duì)黃曲霉毒素B1的拮抗能力考察 [J]. 中草藥, 2021, 52(12): 3544-3551.
[8] 邢福國(guó), 劉陽(yáng), 王利敏,等. 不產(chǎn)毒黃曲霉在降解黃曲霉毒素方面的應(yīng)用: 中國(guó), CN107279686A [P]. 2017-10-24.
[9] Vaamonde G, Patriarca A, Pinto V F,. Variability of aflatoxin and cyclopiazonic acid production bysection flavi from different substrates in[J]., 2003, 88(1): 79-84.
[10] 惠明, 尚小利, 田青, 等. 酒曲中一株不產(chǎn)毒黃曲霉的分離與鑒定 [J]. 中國(guó)釀造, 2012, 31(12): 80-82.
[11] 李亞莉, 邢倩倩, 涂青, 等. 外源接種黃曲霉污染普洱茶安全性研究 [J]. 茶葉科學(xué), 2017, 37(5): 513-522.
[12] 張浩. 茶葉發(fā)酵過(guò)程中多酚變化及其對(duì)黃曲霉產(chǎn)毒的抑制效應(yīng)[D]. 楊凌: 西北農(nóng)林科技大學(xué), 2014.
[13] 張初署. 中國(guó)四個(gè)生態(tài)區(qū)花生土壤中黃曲霉菌分布、產(chǎn)毒特征及遺傳多樣性研究 [D]. 北京: 中國(guó)農(nóng)業(yè)科學(xué)院, 2013.
[14] 邢福國(guó), 李旭, 張晨曦. 黃曲霉毒素的產(chǎn)生機(jī)制及污染防控策略 [J]. 食品科學(xué)技術(shù)學(xué)報(bào), 2021, 39(1): 13-26.
[15] 朱海針, 謝衛(wèi)華, 龍凱, 等. PCR-DGGE技術(shù)研究淡豆豉炮制過(guò)程中微生物菌群的動(dòng)態(tài)變化 [J]. 中草藥, 2017, 48(9): 1757-1765.
[16] Shu X, Wang Y, Zhou Q,. Biological degradation of aflatoxin B1by cell-free extracts ofDY3108 with broad pH stability and excellent thermostability [J]., 2018, 10(8): 330.
[17] Ren X F, Zhang Q, Zhang W,. Control of aflatoxigenic molds by antagonistic microorganisms: Inhibitory behaviors, bioactive compounds, related mechanisms, and influencing factors [J]., 2020, 12(1): 24.
[18] 魏丹丹, 周露, 張初署, 等. 不產(chǎn)毒黃曲霉菌對(duì)產(chǎn)毒黃曲霉菌產(chǎn)毒抑制效果分析 [J]. 現(xiàn)代食品科技, 2014, 30(6): 92-97.
[19] Mehl H L, Cotty P J. Nutrient environments influence competition amonggenotypes [J]., 2013, 79(5): 1473-1480.
[20] Moore G G, Lebar M D, Carter-Wientjes C H. Cumulative effects of non-aflatoxigenicvolatile organic compounds to abate toxin production by mycotoxigenic[J]., 2022, 14(5): 340.
Distribution characteristics and antagonistic ability of atoxigenicin processing of
LI Cui-ying1, HE Jing2, DAI Jia-qi1, LONG Kai1, WANG Li-yuan1, ZHOU Li-fen1, YANG An-jin3, XU Jia1, WENG Mei-zhi1, XIE Xiao-mei1
1. Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Institute of Translational Medicine, Nanchang University, Nanchang 330031, China 3. The Affiliated Hospital of Jiangxi University of Chinese Medicine, Nanchang 330006, China
To clarify the distribution characteristics and antagonistic ability ofduring the processing of Dandouchi (, SSP).The fermenting process of SSP was based on the established a standardized fermentation processing technology of own laboratory, and samples were taken at nine different time points during the fermenting process of SSP.from each samples at different time points in the fermenting process of SSP were cultured, isolated and purified by clonitramine 18% glycerol medium (DG-18), and were identified by morphological primary screening and molecular biology. The toxin-producing ability ofwas determined by ultraviolet fluorescence method primary screening and ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS), and it was determined that it was a non-toxigenic(atoxigenic). The effects of atoxigenicand their metabolites on the growth of toxigenicstandard strain (toxigenic) was detected by plate confrontation method.A total of 21 strains of atoxigenicwere screened out from the process of SSP, among which three and six strains were screened out on the 3rdand 6thd of the “yellow cladding” stage respectively. During the “secondary fermentation” stage, two, seven, and three strains were screened out on the 3rd, 6thand 9thd respectively. The number of atoxigenicscreened on the 6thd of the “secondary fermentation” stage was the most. The growth inhibition rate of atoxigenicto toxigenicwas between 26.75% and 36.69%, and the best inhibitory effect was F6-L8 (referred to the eighth suspectedscreened from the first batch of samples on the 6thd of fermentation in the “yellow cladding” stage), which was 36.69%. The inhibition rate of fermentation supernatant to toxigenicwas 14.29%—43.23%, and Z3-X1 (referred to the first suspectedscreened from the second batch of samples on the 3rd d of the “secondary fermentation” stage) had the best inhibitory effect, reaching 43.23%.Atoxigenicwas found in the processing of SSP and its quantity change showed a unique trend of “rising - decreasing - rising-re-decreasing” at different time points during processing. The atoxigenicand its fermentation supernatant have an inhibitory effect on the growth of toxigenic. This result provides an experimental basis for further research on the role of atoxigenicin the processing of SSP and the biological control of aflatoxin pollution.
(SSP); aflatoxins; atoxigenic; ultra performance liquid chromatography- tandem mass spectrometry; antagonistic ability; yellow cladding; secondary fermentation
R283.6
A
0253 - 2670(2023)06 - 1775 - 08
10.7501/j.issn.0253-2670.2023.06.009
2022-10-09
國(guó)家自然科學(xué)基金項(xiàng)目(82060709);國(guó)家自然科學(xué)基金項(xiàng)目(81660664);國(guó)家自然科學(xué)基金項(xiàng)目(82060699);江西省教育廳科技研究項(xiàng)目(GJJ190634)
李翠英(1996—),女,江西永豐人,碩士研究生,從事藥理學(xué)研究。Tel: 18279613153 E-mail: 2507753468@qq.com
謝小梅(1964—),女,江西永新人,教授,博士,研究生導(dǎo)師,從事微生物學(xué)研究。Tel: (0791)87118707 E-mail: jxxm1964@sina.com
翁美芝(1982—),女,江西宜春人,副教授,博士,主要從事中藥溶栓研究。Tel: (0791)87118921 E-mail: meizhiweng@whu.edu.cn
#共同第一作者:賀 婧(1990—),女,江西南昌人,講師,博士,從事微生物學(xué)研究。Tel: 15972204520 E-mail: whuncuhejing@qq.com
[責(zé)任編輯 鄭禮勝]

