基于生物信息學(xué)分析肝細(xì)胞癌中l(wèi)ncRNA-miRNA-mRNA的調(diào)控網(wǎng)絡(luò)
張 政,盧鴻健,李明慧,高文博,田 宇,王嘉祺,張榮花,章廣玲
(1.華北理工大學(xué)臨床醫(yī)學(xué)院/河北省醫(yī)工融合精準(zhǔn)醫(yī)療重點(diǎn)實(shí)驗(yàn)室,河北 唐山 063000;2.華北理工大學(xué)基礎(chǔ)醫(yī)學(xué)院/河北省慢性疾病基礎(chǔ)醫(yī)學(xué)重點(diǎn)實(shí)驗(yàn)室,河北 唐山 063210)
肝細(xì)胞癌(hepatocellular carcinoma,HCC)是世界上常見的惡性腫瘤之一,占原發(fā)性肝癌的75%~85%。GLOBOCAN 的最新統(tǒng)計(jì)數(shù)據(jù)顯示[1],2020 年全球HCC 新發(fā)病例達(dá)91 萬,死亡病例83 萬,分別居腫瘤新發(fā)病率第6 位、死亡率第3 位;我國(guó)人口占世界的18%,但新發(fā)病例占全球的45%。HCC 的發(fā)生發(fā)展過程復(fù)雜,是一種異質(zhì)性較高的癌癥,大多數(shù)發(fā)現(xiàn)時(shí)已是中晚期,錯(cuò)過了手術(shù)的最佳時(shí)間且預(yù)后較差,其5 年總生存率只有12%[2]。因此,尋找HCC 發(fā)展過程中有效的靶點(diǎn)和信號(hào)通路并進(jìn)行相應(yīng)干預(yù),對(duì)延緩HCC 的進(jìn)展或者逆轉(zhuǎn)具有重要意義。研究表明[3],非編碼RNA(non-coding RNA,ncRNA)包括長(zhǎng)鏈非編碼RNA(long non-coding RNA,lncRNA)和微小RNA(microRNA,miRNA)等,其可能在HCC 的發(fā)生發(fā)展中發(fā)揮了重要的作用。miRNAs 分子由18~25個(gè)bp 組成的非編碼RNA,能夠通過堿基互補(bǔ)配對(duì)與靶基因的3' 端非編碼區(qū)(3'untranslated region,3'UTR)特異性結(jié)合,沉默或降解靶mRNAs 從而影響其翻譯功能。lncRNAs 分子是一種長(zhǎng)度超過200 bp 的非編碼核苷酸,含有miRNAs 的結(jié)合位點(diǎn),可以作為miRNAs 的“海綿”吸附miRNAs,從而競(jìng)爭(zhēng)性抑制miRNAs 對(duì)靶mRNAs 的作用[4]。本研究擬通過生物信息學(xué)方法探究癌癥基因組圖譜(TCGA)數(shù)據(jù)庫中HCC 組織中差異表達(dá)的基因,并構(gòu)建lncRNAmiRNA-mRNA 調(diào)控網(wǎng)絡(luò),為靶向診斷和治療HCC提供科學(xué)依據(jù)。
1 資料與方法
1.1 HCC 組織中差異表達(dá)基因的篩選 利用R 軟件DESeq2 包分析TCGA 數(shù)據(jù)庫中374 例HCC 組織與50 例正常肝組織中l(wèi)ncRNAs、miRNAs、mRNAs 的表達(dá)譜。使用R 軟件ggplot2 包對(duì)表達(dá)譜數(shù)據(jù)繪制火山圖,以|Log2FC|>1(fold change 差異倍數(shù)大于2 倍)且P<0.05 作為篩選標(biāo)準(zhǔn)。
1.2 miRNAs 轉(zhuǎn)錄因子的預(yù)測(cè) 利用FunRich 軟件預(yù)測(cè)差異表達(dá)miRNAs 的轉(zhuǎn)錄因子,根據(jù)其所調(diào)控的基因數(shù)和值進(jìn)行排序,選取富集程度最顯著的前10 個(gè)轉(zhuǎn)錄因子進(jìn)行展示。
1.3 基因功能(GO)和京都基因與基因組百科全書(KEGG)富集分析 利用R 軟件clusterProfiler 包分別分析miRNAs、mRNAs 各基因之間潛在的影響,并以調(diào)整后的P<0.05 為標(biāo)準(zhǔn),進(jìn)行GO 和KEGG分析,分別預(yù)測(cè)其主要生物功能和參與的主要信號(hào)通路。
1.4 miRNA-mRNA 調(diào)控網(wǎng)絡(luò) 使用FunRich 軟件預(yù)測(cè)miRNA 的候選靶基因,結(jié)合HCC 組織中差異表達(dá)的miRNAs 和mRNAs 的FC 值,篩選具有相互作用的miRNA-mRNA 關(guān)系。
1.5 PPI 網(wǎng)絡(luò)構(gòu)建 將篩選出的基因?qū)隨TRING 數(shù)據(jù)庫,分析蛋白之間的相互作用(protein-protein interaction,PPI),并將分析結(jié)果導(dǎo)入Cytoscape 中,構(gòu)建可視化PPI 蛋白互作網(wǎng)絡(luò)圖。
1.6 lncRNA-miRNA-mRNA 調(diào)控網(wǎng)絡(luò)構(gòu)建 利用Starbase 數(shù)據(jù)庫,預(yù)測(cè)miRNAs 的上游lncRNAs,結(jié)合HCC 中差異表達(dá)lncRNAs 的FC 值,篩選具有相互作用的lncRNA-miRNA 關(guān)系對(duì)。基于共享的miRNAs 通過Cytoscape 軟件對(duì)lncRNA-miRNAmRNA 調(diào)控網(wǎng)絡(luò)進(jìn)行可視化。
2 結(jié)果
2.1 差異表達(dá)lncRNAs、miRNAs、mRNAs 的篩選 利用R 軟件DESeq2 包分析374 例HCC 組織和50 例正常肝 組織中l(wèi)ncRNAs、miRNAs、mRNAs 的表達(dá)譜,根據(jù)P<0.05 和|Log2FC|>1 的標(biāo)準(zhǔn)篩選篩選出HCC 組織中差異表達(dá)的lncRNAs 2850 個(gè),其中上調(diào)2475 個(gè),下調(diào)375 個(gè);差異表達(dá)的miRNAs 38個(gè),其中上調(diào)31 個(gè),下調(diào)7 個(gè);差異表達(dá)的mRNAs 4455 個(gè),其中上調(diào)3199 個(gè),下調(diào)1256 個(gè),見圖1。
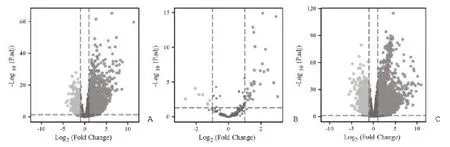
圖1 差異表達(dá)基因的火山圖
2.2 轉(zhuǎn)錄因子-miRNA 調(diào)控網(wǎng)絡(luò) 利用FunRich 軟件對(duì)38 個(gè)差異表達(dá)miRNAs 進(jìn)行轉(zhuǎn)錄因子預(yù)測(cè),共得到201 個(gè)轉(zhuǎn)錄因子,根據(jù)其所調(diào)控的基因數(shù)和P值,選取富集程度顯著的前10 個(gè)轉(zhuǎn)錄因子進(jìn)行展示,見圖2,其基本信息見表1,前10 個(gè)轉(zhuǎn)錄因子分別為EGR1、SP1、NKX6-1、POU2F1、LHX3、SP4、MEF2A、ARID3A、MSX2、HOXA9。

表1 差異表達(dá)前10 名轉(zhuǎn)錄因子的基本信息
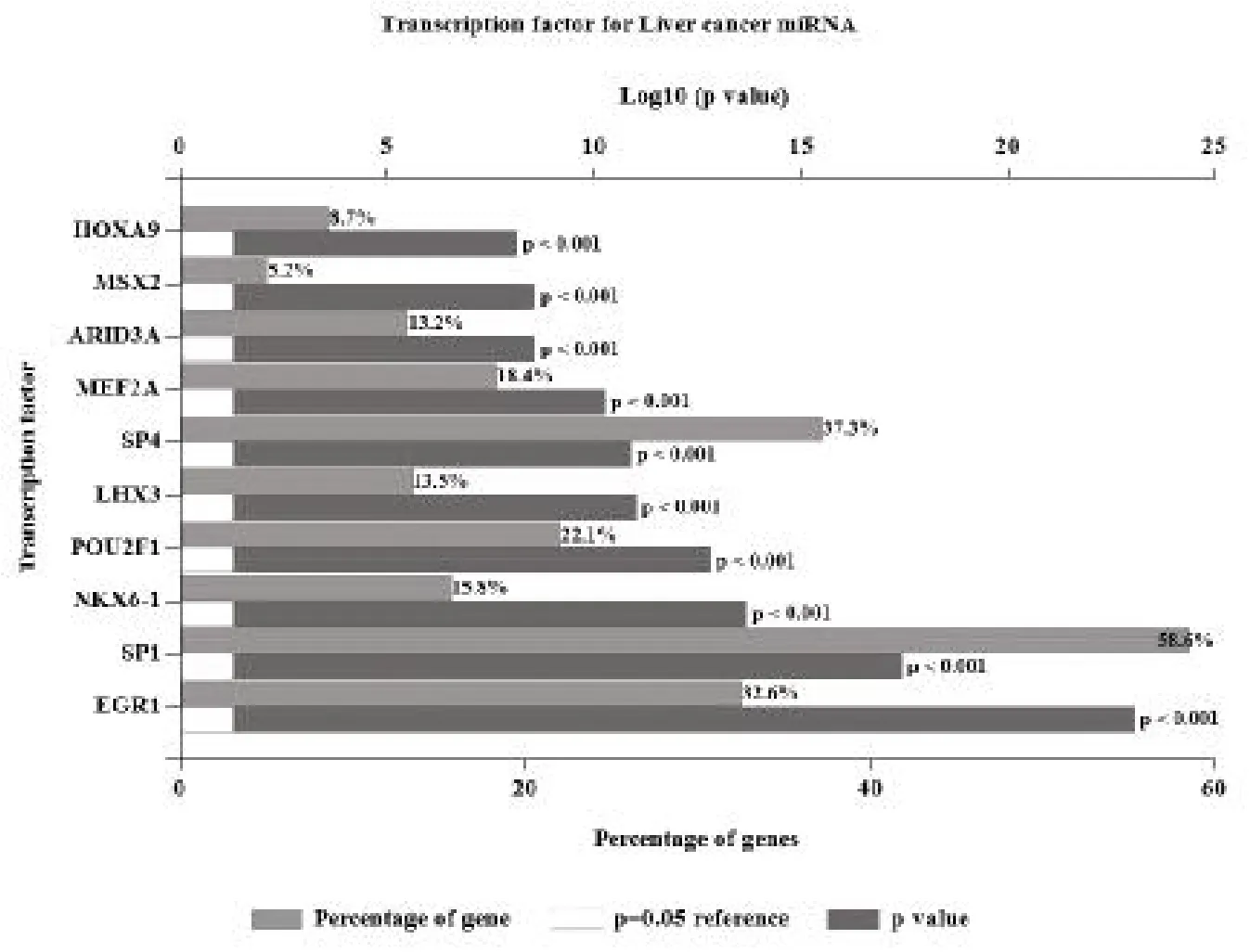
圖2 差異表達(dá)miRNAs 轉(zhuǎn)錄因子的預(yù)測(cè)
2.3 miRNAs 的GO 和KEGG 富集分析 對(duì)38 個(gè)差異表達(dá)的miRNAs 進(jìn)行GO 和KEGG 功能富集分析,其生物過程主要涉及血管內(nèi)皮細(xì)胞遷移的調(diào)節(jié)、血管內(nèi)皮細(xì)胞增殖調(diào)控與新生血管生成、內(nèi)皮細(xì)胞增殖的調(diào)節(jié)、血管內(nèi)皮細(xì)胞增殖與新生血管生成;分子功能主要涉及mRNA 結(jié)合參與轉(zhuǎn)錄后基因沉默、RNA 聚合酶Ⅱ復(fù)合物結(jié)合、RNA 聚合酶核心酶結(jié)合、基礎(chǔ)轉(zhuǎn)錄機(jī)制結(jié)合;KEGG 分析主要富集于miRNAs 在癌癥中的作用,見圖3。
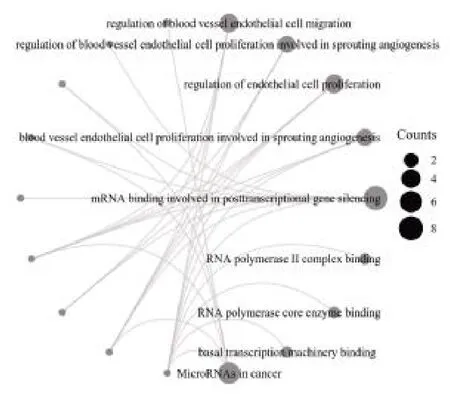
圖3 差異表達(dá)miRNAs 的GO 和KEGG 功能富集分析
2.4 miRNA-mRNA 調(diào)控網(wǎng)絡(luò) 通過FunRich 軟件預(yù)測(cè)差異表達(dá)的38 個(gè)miRNAs 的下游靶基因,共得到1530 個(gè)靶基因,然后與差異表達(dá)的4455 個(gè)mRNAs取交集獲得286 個(gè)候選靶基因,見圖4。通過Starbase 和MiRDB 數(shù)據(jù)庫比對(duì)分析,獲得14 302 對(duì)miRNA-mRNA,與差異表達(dá)的miRNA-mRNA 匹配后,最后篩選出交叉表達(dá)負(fù)調(diào)控的12 個(gè)miRNAs 和108 個(gè)mRNAs 作為后續(xù)研究對(duì)象。
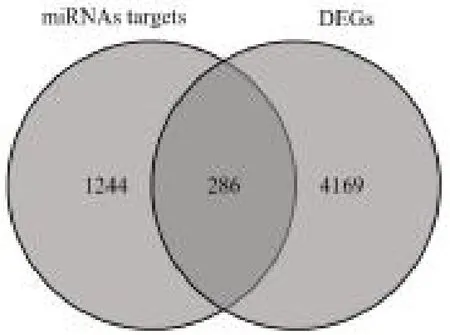
圖4 差異表達(dá)miRNAs 的下游靶基因與差異表達(dá)mRNAs 的韋恩圖
2.5 108 個(gè)mRNAs 的蛋白PPI 調(diào)控網(wǎng)絡(luò)及富集分析利用STRING 數(shù)據(jù)庫和Cytoscape 軟件構(gòu)建篩選出的108 個(gè)基因的PPI 網(wǎng)絡(luò),見圖5。圖中節(jié)點(diǎn)代表mRNAs,有相互作用關(guān)系的mRNAs 之間有連線,共有44 個(gè)節(jié)點(diǎn)和134 條邊;節(jié)點(diǎn)越大、顏色越深則介數(shù)中心度越大,邊的粗細(xì)代表連接評(píng)分,邊越粗,mRNAs 間的互作關(guān)系越大。
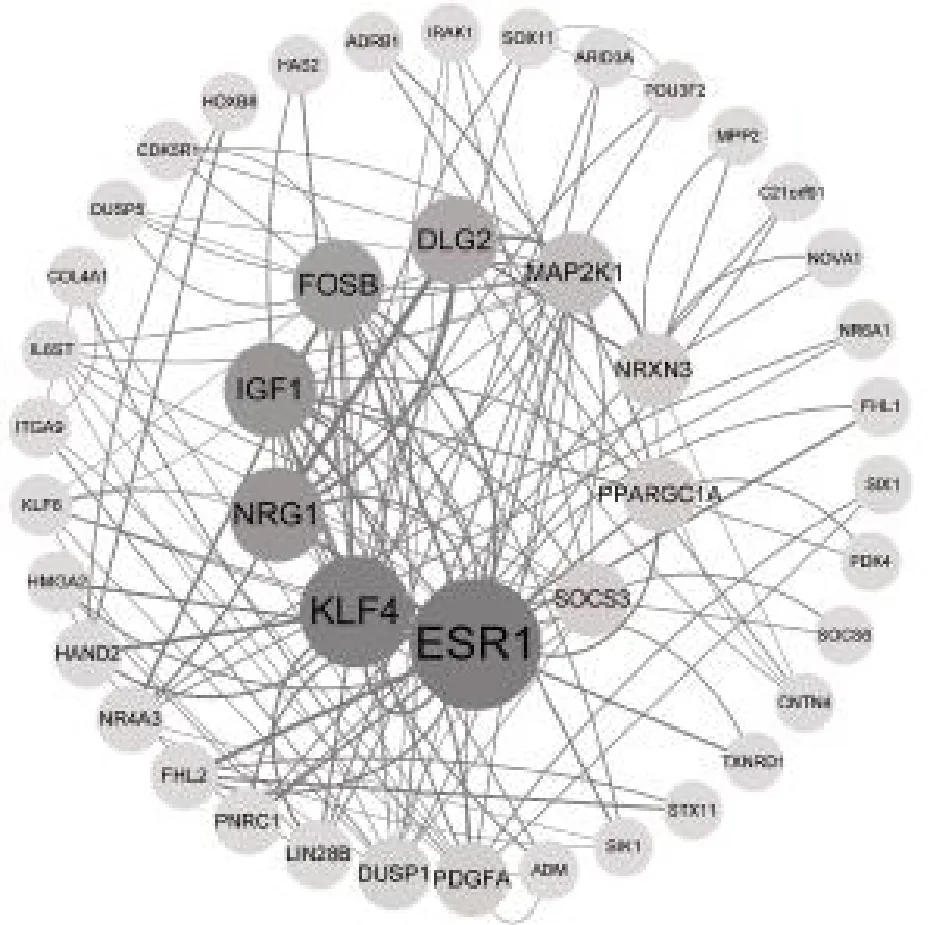
圖5 108 個(gè)mRNAs 的蛋白互作網(wǎng)絡(luò)圖
2.6 108 個(gè)mRNAs 的GO 與KEGG 富集分析 利用GO 功能分析篩選出的108 個(gè)mRNAs 的生物功能,生物過程主要涉及肌肉適應(yīng)、MAP 激酶活性的調(diào)節(jié)、胚胎器官發(fā)育、蛋白絲氨酸/蘇氨酸激酶活性的正調(diào)控;分子功能主要涉及MAP 激酶酪氨酸/絲氨酸/蘇氨酸磷酸酶活性、MAP 激酶磷酸酶活性、激酶調(diào)節(jié)活性、DNA 結(jié)合轉(zhuǎn)錄激活物活性和RNA 聚合酶Ⅱ特異性。KEGG 富集分析108 個(gè)mRNAs 參與的信號(hào)通路,主要涉及調(diào)節(jié)干細(xì)胞多能性的信號(hào)通路、催乳素信號(hào)通路、MAPK 信號(hào)通路、EGFR 酪氨酸激酶抑制劑耐藥性,見圖6。

圖6 108 個(gè)mRNAs 的GO 和KEGG 富集分析圖
2.7 構(gòu)建lncRNA-miRNA-mRNA 調(diào)控網(wǎng)絡(luò) 利用Starbase 數(shù)據(jù)庫,分析篩選出的12 個(gè)miRNAs 的上游lncRNAs 共221 個(gè),結(jié)合差異表達(dá)lncRNAs 的FC 值,篩選出5 對(duì)lncRNA-miRNA,包括2 個(gè)miRNAs(miR-23A 和miR-146B)與5 個(gè)lncRNAs(GAS5、MCM3AP-AS1、LINC00173、KCNQ1OT1、SNHG7);結(jié)合篩選出的2 個(gè)miRNAs 的與組織中差異表達(dá)mRNAs 的FC 值,共匹配42 對(duì)miRNAmRNA(包括40 個(gè)mRNAs)。通過Cytoscape 軟件對(duì)lncRNA-miRNA-mRNA 調(diào)控網(wǎng)絡(luò)進(jìn)行可視化處理,見圖7。
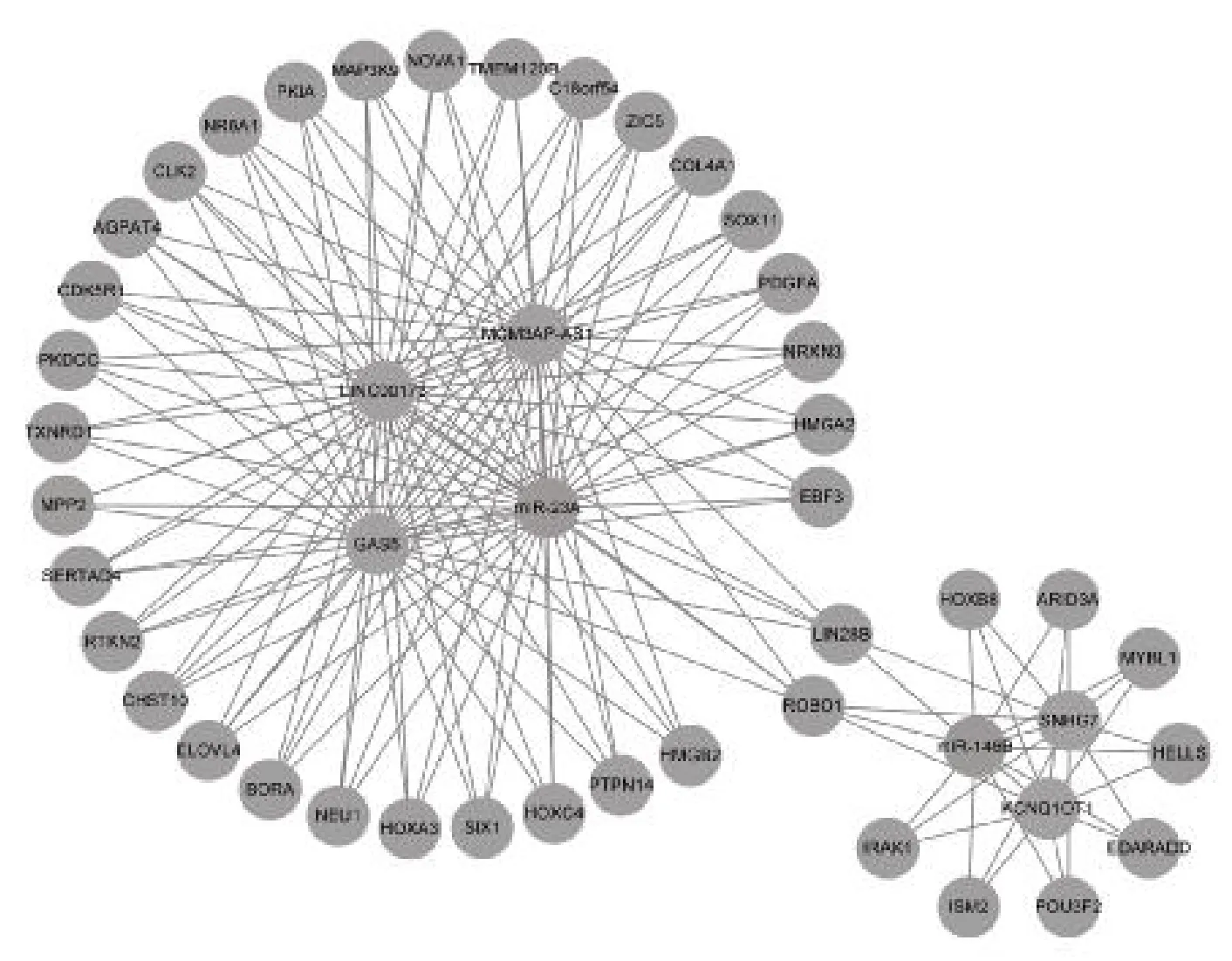
圖7 HCC 組織中l(wèi)ncRNA-miRNA-mRNA 的調(diào)控網(wǎng)絡(luò)
3 討論
HCC 是由肝細(xì)胞惡性病變引起的癌癥,患者發(fā)現(xiàn)時(shí)大多數(shù)已是中晚期,具有發(fā)病隱匿、進(jìn)展快、易耐藥、預(yù)后差以及易復(fù)發(fā)等特點(diǎn),且現(xiàn)有的治療效果并不理想[5]。因此尋找開發(fā)有效的HCC 診斷和預(yù)后的生物標(biāo)記物具有重要意義。越來越多的研究表明,lncRNAs 和miRNAs 等非編碼RNAs 與HCC 的發(fā)病密切相關(guān)。LncRNA n339260 通過降低miR-30e-5p的表達(dá)使TP53INP1 的表達(dá)增加,從而促進(jìn)肝細(xì)胞癌的進(jìn)展[6]。LncRNA ZEB1-AS1 通過調(diào)節(jié)miR-1224-5p/MAP4K4 軸,調(diào)節(jié)持續(xù)沙眼衣原體感染中線粒體介導(dǎo)的HeLa 細(xì)胞凋亡[7]。抑制lncRNA GAS6-AS2 通過調(diào)節(jié)miR-136-5p/OXSR1 軸能夠在體外和體內(nèi)水平減輕敗血癥相關(guān)的急性腎損傷[8]。然而在HCC 中尚沒有報(bào)道完整的lncRNA-miRNA-mRNA 調(diào)控網(wǎng)絡(luò),因此深入研究lncRNAs 和miRNAs 在HCC 發(fā)生發(fā)展中的作用及調(diào)控機(jī)制具有重要意義。
已有研究表明,轉(zhuǎn)錄因子調(diào)控miRNAs 的表達(dá),且這些轉(zhuǎn)錄因子在HCC 的發(fā)病過程中具有重要的調(diào)控作用。本研究預(yù)測(cè)了調(diào)控HCC 中差異表達(dá)miRNAs 的上游轉(zhuǎn)錄因子共201 個(gè),根據(jù)值篩選出差異顯著的前10 個(gè)轉(zhuǎn)錄因子分別為EGR1、SP1、NKX6-1、POU2F1、LHX3、SP4、MEF2A、ARID3A、MSX2、HOXA9,其中EGR1 差異最明顯。EGR1 是一種轉(zhuǎn)錄因子,可能參與腫瘤細(xì)胞的增殖、侵襲和轉(zhuǎn)移以及腫瘤血管生成,與癌癥的發(fā)生和發(fā)展密切相關(guān)[9]。有報(bào)道表明[10],EGR1 可能以轉(zhuǎn)錄因子方式調(diào)控hsa-miR-146b 的表達(dá)。EGR1 在miR-195 的上游啟動(dòng)子區(qū)有結(jié)合位點(diǎn),且調(diào)控miR-195 的表達(dá),EGR1 可抑制miR-195/AKT3 軸并抑制胃癌細(xì)胞凋亡[11]。EGR1 還能夠通過負(fù)調(diào)控miR-491-5p 促進(jìn)細(xì)胞增殖、生長(zhǎng)和遷移,并抑制細(xì)胞凋亡,從而抑制胃癌的進(jìn)程[12]。因此,研究轉(zhuǎn)錄因子對(duì)miRNAs 的調(diào)控作用可在系統(tǒng)層次上對(duì)疾病的發(fā)生提供理論依據(jù)。
近年來,伴隨著高通量測(cè)序技術(shù)的發(fā)展產(chǎn)生了大量的基因數(shù)據(jù),這為進(jìn)一步研究HCC 的發(fā)生發(fā)展及預(yù)后監(jiān)測(cè)提供了有力的基礎(chǔ)。本研究首先分析TCGA 數(shù)據(jù)庫中差異表達(dá)基因的表達(dá)譜,得到的差異表達(dá)的lncRNAs 2850 個(gè)、miRNAs 38 個(gè)、mRNAs 4455 個(gè)。對(duì)38 個(gè)差異表達(dá)的miRNAs 進(jìn)行GO 和KEGG 功能富集分析,顯示主要涉及血管內(nèi)皮細(xì)胞遷移和增殖、新生血管生成、內(nèi)皮細(xì)胞增殖的調(diào)節(jié)等生物過程,mRNA 結(jié)合參與轉(zhuǎn)錄后基因沉默等分子功能,且KEGG 分析顯示這些miRNAs 主要在癌癥中發(fā)揮作用。通過FunRich 軟件預(yù)測(cè)得到的miRNAs 靶基因與差異表達(dá)的mRNAs 交叉匹配,對(duì)篩選出的108 個(gè)mRNAs 進(jìn)行GO 分析發(fā)現(xiàn),主要在胚胎器官發(fā)育、MAP 激酶活性的調(diào)節(jié)等生物學(xué)過程富集,DNA 結(jié)合轉(zhuǎn)錄激活物活性和RNA 聚合酶Ⅱ特異性、激酶調(diào)節(jié)活性等分子功能富集。KEGG 分析發(fā)現(xiàn),靶基因參與的信號(hào)通路主要涉及調(diào)節(jié)干細(xì)胞多能性的信號(hào)通路、MAPK 信號(hào)通路等。因此可以得出在HCC 中差異表達(dá)的mRNAs 其生物功能主要與細(xì)胞增殖、形態(tài)分化和細(xì)胞遷移有關(guān)。同樣地,在PPI 網(wǎng)絡(luò)的Top 10 基因中KLF4、NRG1、FOSB、MAP2K1 也參與了上述生物學(xué)功能以及相關(guān)信號(hào)通路。研究發(fā)現(xiàn)[13],miR-146B 通過靶向KLF4 調(diào)節(jié)肝星狀細(xì)胞活化。NRG1 是鱗狀細(xì)胞癌分化的關(guān)鍵調(diào)節(jié)因子,抑制腫瘤細(xì)胞角化和終末鱗狀分化并促進(jìn)腫瘤細(xì)胞增殖[14]。TGF-β1通過誘導(dǎo)FOSB 促進(jìn)前列腺癌細(xì)胞遷移和侵襲[15]。CircRNA ZFR 通過上調(diào)MAP2K1 促進(jìn)HCC 的增殖[16]。
本研究尋找與miRNAs 相匹配的上游lncRNAs和下游mRNAs 構(gòu)建HCC 中l(wèi)ncRNA-miRNA-mRNA 的調(diào)控網(wǎng)絡(luò),其中包含2 個(gè)關(guān)鍵的miRNAs(miR-23A、miR-146B)以及與其匹配的5 個(gè)lncRNAs(GAS5、MCM3AP-AS1、LINC00173、KCNQ1OT1、SNHG7)和40 個(gè)mRNAs(ROBO1、LIN28B 等)。研究表明[17],miR-23A 是HCC 中下調(diào)最顯著的miRNA,可能是改善肝癌患者索拉非尼反應(yīng)性的潛在靶點(diǎn)。miR-146B 通過靶定PTP1B 抑制胃癌細(xì)胞的增殖并促進(jìn)其凋亡[18]。miR-146B 通過NF-κB(核因子κB)途徑靶向TLR4(Toll 樣受體4),抑制膽囊癌腫瘤的發(fā)生和轉(zhuǎn)移[19]。以上研究表明,miR-23A、miR-146B具有抑制腫瘤的作用。此外,lncRNA GAS5 靶向miR-23A 抑制CCl4 誘導(dǎo)的肝纖維化[20]。LncRNA SNHG7 通過調(diào)節(jié)miR-146B-5p/ROBO1 軸促進(jìn)胰腺癌進(jìn)展[21]。LncRNA SNHG17 通過抑制miR-23A-3p 來調(diào)節(jié)CXCL12 介導(dǎo)的血管生成,從而促進(jìn)結(jié)直腸腺癌細(xì)胞的增殖和遷移[22]。LncRNA KCNQ1OT1通過miR-146A-5p/ACER3 軸抑制HCC 的放射敏感性并促進(jìn)腫瘤發(fā)生[23]。
綜上所述,lncRNA-miRNA-mRNA 調(diào)控網(wǎng)絡(luò)的構(gòu)建,有望闡明HCC 的發(fā)生發(fā)展機(jī)制,為HCC 的臨床診斷和預(yù)后監(jiān)測(cè)提供有價(jià)值的標(biāo)記物。但是lncRNA-miRNA-mRNA 調(diào)控網(wǎng)絡(luò)的功能以及各差異基因的功能,還有待通過體內(nèi)外實(shí)驗(yàn)和臨床實(shí)驗(yàn)進(jìn)一步證實(shí)。

