植物病原細菌Ⅵ型分泌系統研究進展
夏雄飛 薄淑文 韓長志
關鍵詞:植物病原細菌;T6SS;結構域;功能;遺傳關系;研究綜述
中圖分類號:S432.1 文獻標識碼:A 文章編號:1001-1498(2023)04-0183-10
細菌可以引起植物、動物以及人類嚴重的病害,在其侵染過程中,主要通過多種分泌系統以完成與宿主之間的互作。其中,Ⅵ型分泌系統(T6SS,Type Ⅵ secretory system)可以通過釋放效應蛋白至鄰近靶細胞,包括對于宿主的攻擊性和種間競爭的防御性等作用。此外,T6SS還具有參與生物被膜形成等能力,在細菌的營養競爭、生存定殖、侵染宿主致病等過程中發揮著重要作用。
有關T6SS的研究可以追溯至1996年,當時,學者對霍亂弧菌(Vibrio cholerae)中一個缺乏可識別信號肽的序列HCP(Hemolysin CoregulatedProtein)橫跨細胞內外膜分泌蛋白開展研究,明確其對病原細菌的毒力、定殖能力以及環境適應性等有重要影響。2006年,Pukatzki等人發現除HCP外,V.cholerae中的VgrG蛋白同樣存在胞外輸出現象,然而,其均不含信號肽且與T3SS或T4SS并不相同,因此,首次提出了T6SS概念。此后,2012年《Nature》論文系統闡述了T6SS分泌模型,即一個通過獨特的基座結構與內膜相連,往復于延伸或收縮構象的長管外包彈簧狀結構鞘(主要由HCP、TssB/C組成),保持在組裝、快速收縮、釋放、拆卸和重新組裝之間循環,與T4噬菌體類似,基座結構將收縮信號傳遞給鞘,并且擁有保守的觸發機制。通常細菌基于T6SS系統以接觸依賴性傳輸毒性蛋白,諸如肽聚糖酶、磷脂酶、ATP酶等效應子,面對營養壓力時通過T6SS將其輸送至競爭細胞,從而導致靶細胞死亡。
學術界關于細菌中T6SS的研究多以銅綠假單胞菌(Pseudomonas aeruginosa)為主,而有關植物病原細菌T6SS的研究,最早見于2010年關于梨火疫病菌(Erwinnia amylovora)的報道。鑒于丁香假單胞菌(Pseudomonas syringae)、青枯雷爾氏菌(Ralstonia solanacearum)、根癌農桿菌(Agrobacterium tumefaciens)、梨火疫病菌、稻生黃單胞菌(Xanthomonas oryzaepv. oryzicola,Xoc)等5種植物病原細菌對農林業生產危害的嚴重性,有關上述細菌T6SS的調控機制、作用機制以及結構功能等研究報道逐年增加。然而,尚未見不同植物病原細菌中T6SS的系統性對比分析報道。因此,本研究以前人研究成果為基礎,對上述植物病原細菌中T6SS蛋白的數量、種類、遺傳分類以及結構功能進行綜述,以期明確不同植物病原細菌中T6SS在其功能蛋白及遺傳關系等方面存在的差異性,并指出了T6SS研究中存在的一些問題。
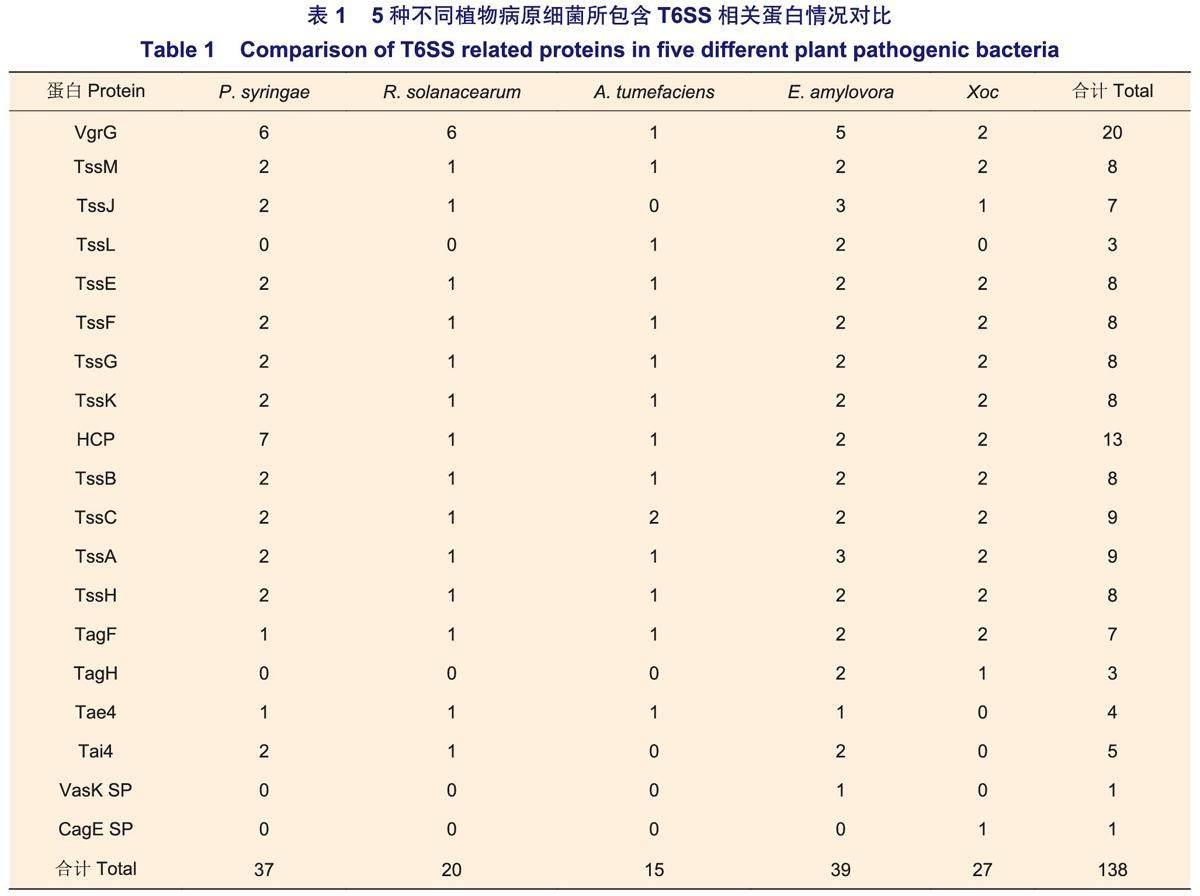
1 T6SS的結構
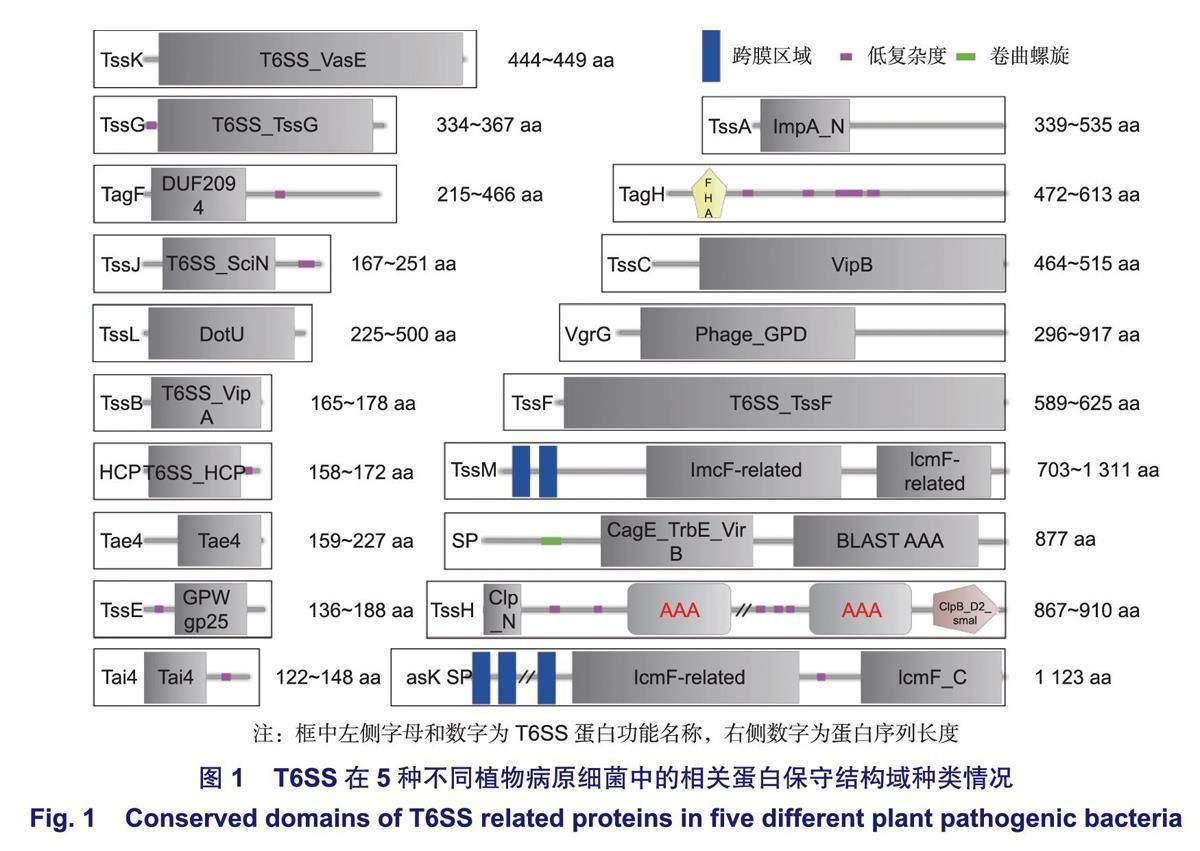
T6SS主要存在于革蘭氏陰性細菌中,以P.aeruginosa為例,典型的T6SS裝配結構與噬菌體尾部穿膜結構類似,存在于內外膜組織之間,是基于細胞接觸依賴性的多組件跨膜通道。筆者利用美國國立衛生院(NCBI)數據庫,對5種植物病原細菌(P.syringae、R.solanacearum、A.tumefaciens、E.amylovora、Xoc;登錄號分別為:GCF_016694755.2、GCF_001587155.1、GCF_003667905.1、GCF_000091565.1、GCF001021915.1)中共138個T6SS蛋白序列進行搜索下載、整理,利用蛋白保守結構域分析軟件SMART進行預測分析,發現19種T6SS蛋白存在于5種細菌中,且不同種細菌擁有蛋白的類別與數量不盡相同,具有一定多樣性。同時,除VgrG的蛋白序列長度在不同細菌之間差異較大,為296~917 aa,其余同種T6SS蛋白之間長度差別相對較小,具有一定保守性(圖1)。T6SS蛋白種類主要包括跨膜復合體TssM(ImcF)、TssJ(SciN)、TssL(DotU);基座亞基TssE(GPW_gp25)、TssF、TssG、TssK(VasE);彈簧狀伸縮鞘大亞基TssC(VipB)、小亞基TssB(VipA)、管狀蛋白HCP;尖端效應子結合蛋白VgrG(Phage_GPD);裝卸輔助蛋白TssA(ImpA_N);調控蛋白TagF(DUF2094)、TagH(FHA)、TssH(Clp_N);酰胺酶效應蛋白Tae4、酰胺酶免疫蛋白Tai4。此外,E.amylovora與Xoc分別獨有IcmF(Vask)、CagE_TrbE_VirB等結構域的T6SS分泌蛋白(蛋白ID分別為WP_004160264.1、WP_047340360.1)。通過對T6SS蛋白結構域進行解析,明確不同病原細菌具有相似的T6SS蛋白組成、不同的蛋白數量以及部分物種特有的結構域,與前人明確R.solanacearum中HCP、VgrG蛋白的三級結構分別與P.aeruginosa、大腸桿菌(Escherichiacoll)的HCP、VgrG相似等結果類似。
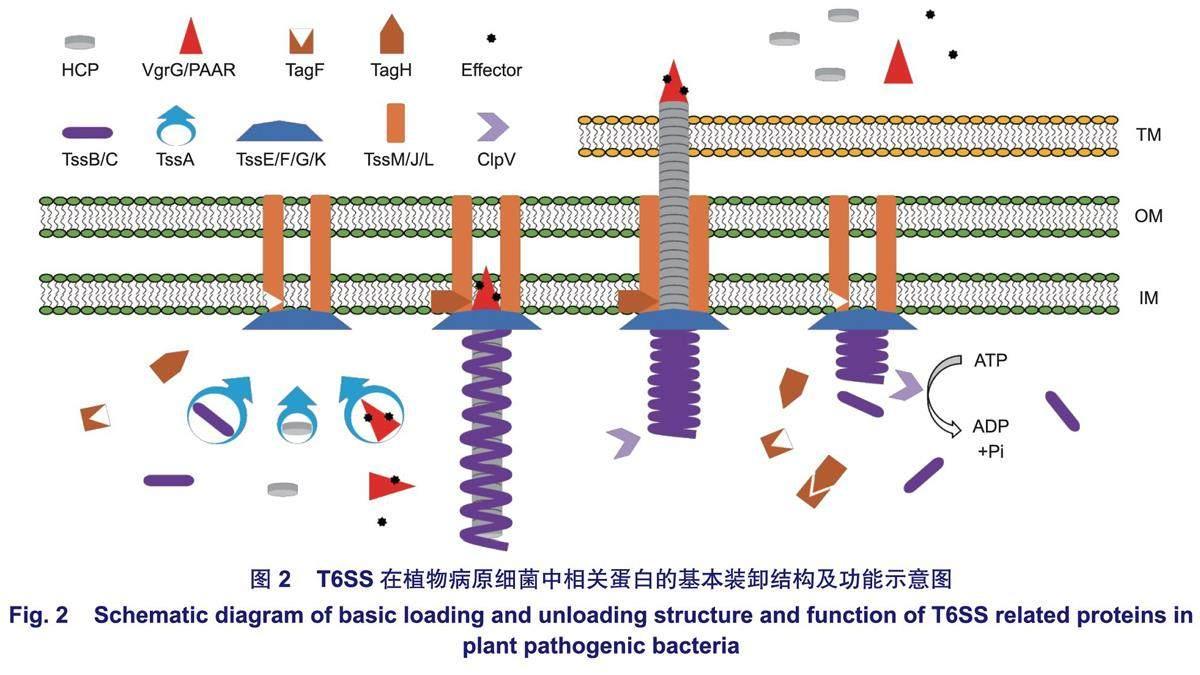
具體而言,VgrG是一個三聚體狀的尖端效應子結合蛋白,是對靶細胞執行毒性功能的核心蛋白,在5種植物病原細菌中均具有較多的數量(表1);TssM/J/L是一個跨內外膜復合體結構,是效應子等蛋白的膜運輸通道;TssE/F/G/K是一個錨定于內膜并鏈接TssM/J/L結構的漏斗狀復合體基座,用以VgrG蛋白的識別與吸附;HCP是一個管狀蛋白,當T6SS開始裝配時,其一端依附于VgrG,行使VgrG等尖端蛋白受力功能;TssB/C是一個空心彈簧狀蛋白復合體,包裹于HCP外側,是VgrG與HCP等結構被執行推力的來源;TssA是一個T6SS裝卸輔助識別蛋白,當T6SS開始裝配時,其—側可分別粘連VgrG、TssB/C和HCP,并有序進行組裝;TssH屬于AAA+ATP酶超家族和ClpV亞家族,主要在TssB/C鞘收縮釋放T6SS效應子過程中起作用;TagF通過與TagH相互作用來調節T6SS效應子的分泌過程;Tae4作為效應子參與細菌競爭中對目標細菌肽聚糖和膜脂的侵蝕;Tai4作為免疫蛋白用于抵御Tae4,它們與VgrG基因編碼相關聯。上述蛋白具有不同的功能,使T6SS在不同環境下執行多種生存策略,分泌多種效應蛋白,從而在結構域之間以及結構域與效應子之間具有相互緊密配合的特點,進而適應多變的細胞環境。
一般而言,T6SS中的TssM/J/L、TssE/F/G/K分別被組裝成跨膜通道和基座復合體,隨后TssB/C彈簧鞘的收縮推動HCP管、VgrG突刺和效應子并通過T6SS跨膜通道離開細胞,進入細胞外環境或附近的另一個細胞(圖2),毒性效應子發揮作用從而導致靶細胞生長抑制或死亡。
2 T6SS蛋白的遺傳分類
基于MEGA11軟件并根據序列同源性對上述5種植物病原細菌中138個T6SS蛋白進行遺傳關系分析,明確其可以分為3個亞家族,分別命名為A、B、C,其中TssB、TssC、TssH、Tai4等蛋白聚為A類,而TssF、TssK等聚為B類,TssM、TagH聚為C類(圖3)。在遺傳關系方面,一些蛋白同時存在于上述兩種或3種亞家族中,如TssE、TssJ、TagF等蛋白存在于A、B兩大類中;TssA、TssL、Tae4存在于A、C兩大類;TssG在A、B、C類中則分別存在1、6、1個蛋白,其中A類中僅包含A tumefaciens的TssG,C類中僅包含E.amy/ovora的TssG,這一現象與T6SS基因可以通過水平轉移所獲得的特性相一致,又或許是單菌種具有多個T6SS基因簇導致,例如,P.aeruginosa攜帶H1、H2和H3-T6SS3個基因簇,而V.cholerae只攜帶一個。對上述病原細菌T6SS蛋白結構域進一步預測分析,顯示C類中A tumefaciens的TssL包含OmpA結構域(蛋白ID為WP 080867199.1),不同于A類中E.amylovora的TssL,其余蛋白聚類差異均與其保守結構域無關。HCP與VgrG聚為一類,說明HCP與VgrG具有一定的共進化特性。
3 T6SS蛋白的功能
3.1侵染宿主的毒性功能
植物病原細菌通過T6SS中VgrG綁定毒性效應子(細胞壁降解酶、核酸酶、膜穿孔蛋白、磷脂酶和NADase等)傳遞至鄰近宿主細胞,通常在寄主組織內大量定殖,引起寄主細胞質壁分離、細胞器降解等,以達到營養汲取的目的。當前,已經明確P.syringae、R.solanacearum、E.amylovora等細菌中有較多T6SS蛋白參與侵染宿主植物的過程。P.syringae可以對豆科、茄科、薔薇科以及十字花科等300多種經濟作物致病,是當前變種最多的植物病原細菌之一。前人對P.syringae中T6SS參與侵染過程的研究多集中于TssM、TssJ蛋白以及RetS、LadS和GacS/GacA調控途徑。就其蛋白功能而言,當TssM、TssJ沉默時該菌致病性分別下降了78.7%和71.3%,同時伴隨生物膜形成與蛋白水解能力下降,然而其胞外多糖的分泌及運動性不受影響,并且存在突變復原現象,推測TssM、TssJ影響了P.syringae的自身保護膜而未參與鞭毛膜的形成,并且發生了基因水平轉移,從而導致突變失效;就其調控方式而言,T6SS與T3SS可以共同被(P) ppGpp、RetS和LadS調控表達并影響細胞運動,其中RetS負向控制粘液性,LadS負向調節成群運動;此外,低溫和植物免疫物質也會影響T6SS基因的表達,且該過程受GacS/GacA雙組分系統的調控。
R.solanacearum可以侵染茄科、豆科等雙子葉草本植物及桑樹、木麻黃等雙子葉木本植物,相關研究多集中于TssM、TssB、VgrG、HCP和TssL等蛋白。就其蛋白功能而言,TssM和TssB參與了該菌的生物膜(自身保護膜和運動鞭毛膜)的形成過程,當TssM和TssB沉默時,外膜蛋白、鞭毛相關基因flhC、flhD、flgM、fliA以及環磷酸腺苷受體蛋白等表達受阻。保護生物膜的失活導致菌株無法有效抵御來自宿主的活性氧免疫攻擊,進而導致毒力減弱,然而與Wang等人研究結果不同的是,鞭毛的失活導致運動受阻,進而影響菌株在宿主植物組織的定殖能力,與此相似的是該菌中VgrG1、VgrG2也參與了菌株的運動形成過程,并且存在突變復原的現象。此外,該菌的T6SS蛋白在同宿主不同組織中所表現的致病能力也不同,例如在葉柄致病過程中TssL相比其他蛋白將發揮更大作用,而在根部致病過程中VgrG3占主體影響因素,這表明在不同的侵染環境中,不同T6SS蛋白貢獻力不同。就其調控方式而言,該菌存在多種分泌系統互作調控,諸如編碼VgrG1、VgrG2、HCP等蛋白的基因簇在參與T6SS的同時也影響著T3SS效應子基因的表達。
E.amylovora可以引起薔薇科植物火疫病,主要侵染葉、花、嫩枝、果實等。相關研究集中于TssH、TssA、TssB、TssC、HCP、VgrG等蛋白。就其蛋白功能而言,位于T6SS1基因座的ClpV基因(TssH相關)與該菌中的致病效應子梨火疫病菌素(Amylovoran)的產量、生物膜呈正相關,同為致病效應子的果聚糖卻不受該基因影響,這表明不同T6SS蛋白、效應子之間可能存在兼容性差別。同時,編碼TssA1、TssB1、TssC1和HCP1等蛋白的基因與梨火疫病毒素產量呈負相關。就其調控方式而言,T6SS的HCP、VgrG與T3SS的SpaR3基因被證明參與聯合調控,此外,HCP、VgrG還與鞭毛(FlgB3)、菌毛(EAMY0247)、磷酸鹽轉運過程(pstA3、pstC3、pstS3)、硫代謝過程(cysC、cysl3、cysJ、cysN、tauA、tauB、tauC、tauD3)、趨化性(cheA1、cheB1、cher1、cheY1、che27)和細胞運動(motA1、motB1)等功能相關基因呈正相關。
3.2種間競爭的拮抗功能
在細菌競爭中發揮重要作用的各種抗菌毒素可以通過T6SS傳遞至靶細胞,當不同植物病原細菌擁有共同的宿主侵染目標時,便會啟用T6SS分泌多種降解酶,作為抗菌武器用以嘗試殺死營養競爭者。諸如在P.aeruginosa中含有H1、H2和H3-T6SS3個基因簇,其中H1-T6SS專注于自身防御,僅用于檢測到被異種細菌攻擊時的反擊作用,同時,細菌同種群之間相互接收信號并分泌對應的免疫蛋白從而避免誤傷。前人對于A.tumefaciens的T6SS的研究多集中于Tae、Tai、VgrG、基因轉移、調控方式等,其T6SS通過分泌肽聚糖酰胺酶效應子Tae,裂解肽聚糖中的D-丙氨酸和谷氨酸鍵引起細胞增大從而抑制E.coll生長,并在漫長的進化中產生特異性免疫蛋白Tai,用于競爭過程中保護自身細胞不被Tae殺傷。同時,該菌還具有兩種依賴于保守HxxD基序的DNA酶效應子Tde,通過引起DNA降解及細胞伸長導致Ecoli凋亡。因此,Atumefaciens通常將Tae和Tde聯合參與營養競爭,且在不同競爭環境下均可殺死E.coli、P-aeruginosa等細菌。此外,該細菌中T6SS的VgrG-a相關基因V2a編碼一個AHH家族核酸酶,同樣作為種間競爭的重要效應子。其效應子多樣性或許與其相關基因高效轉移機制有關,在營養競爭過程中導致部分細胞DNA裂解,隨后被同種間其他活細菌基因組整合,并利用整合的特異性免疫蛋白基因抵抗攻擊者。基于免疫基因轉移機制使得細菌競爭過程中的毒性功能發揮更具挑戰性,同時也提供了更多效應子的進化途徑。產生T6SS特異性免疫的被攻擊者可以大大增強其競爭優勢,諸如在E.coli中ClpA/ClpP基因的突變使其提高了對來自A.tumefaciens的T6SS毒性攻擊,其中ClpA與ClpP相互作用是A tumefaciens的T6SS效應子識別目標之一。就其調控方式而言,T6SS的激活與Chvl組分或TssL的磷酸化作用有關,該蛋白調控途徑與另一項關于P.aeruginosa的T6SS調控方式相似。
前人對于P.syringae利用T6SS參與種間競爭的研究多集中于HCP、金屬離子轉運機制等。該菌中HCP2的分泌依賴于IcmF2(由HSI-Ⅱ編碼),HCP2基因的特點在于其與E.coli、酵母菌的競爭過程中分泌活躍,而在侵染宿主植物過程中則保持沉默。然而,在HSI-I基因簇中HCP2相關的編碼基因被轉座酶終止,導致其相關功能喪失,該相似結果發現于P-aeruginosa,說明不同T6SS基因簇的功能存在專一性。此外,研究表明P.syringae中T6SS蛋白的運轉與金屬離子有關,諸如VgrG相關細胞壁靶向效應子PSPTO5413的活性依賴于鈣離子濃度,通過EF-Hand基序調節。同時,P.syringae中T6SS蛋白的運轉還與環境脅迫相關,諸如在滲透壓升高后表現為T6SS相關基因上調。
Xoc主要危害水稻分蘗期到抽穗前期的水稻葉片,且幼齡葉片最易受害,受害較嚴重時會導致減產50%以上甚至顆粒無收。前人對于其T6SS的研究相對較少,主要涉及HCP、VgrG等蛋白。該菌編碼2套T6SS基因簇,與細胞游動、趨化性、生物被膜及群體感應等表達有關,并參與調控胞外多糖和黃色素,通常利用T6SS效應子作為群體感應信號分子調控種間競爭趨勢,相比于HCP,VgrG有著明顯的分化現象,進化速度更快,并且其表達都與HCP呈正相關。與上述P.syringae相同,Xoc的T6SS2在細菌競爭中發揮了重要作用,其中HCP2基因表達最為活躍,進一步說明了T6SS基因簇的專一性。
4討論
4.1不同植物病原細菌中T6SS蛋白數量之間差異性
不同植物病原細菌中T6SS蛋白數量之間存在著較大的差異性。其中,E.amylovora中T6SS蛋白數量最多,為39個;P.syringae中T6SS蛋白數量次之,為37個;而A.tumefaciens僅為15個,明顯少于P.syringae與E.amylovora。推測不同細菌中T6SS蛋白數量的差異性可能與侵染宿主的種類數量有關,有待于進一步深化對比研究。通過對5種細菌中的T6SS蛋白種類數量進行分析,明確VgrG的數量明顯高于其他蛋白,為20個,HCP次之,為13個;除特有分泌蛋白VasK、CagE_TrbE_VirB外,TssL、TagH最少,僅有3個。上述不同蛋白之間數量的差異,推測VgrG作為效應子結合蛋白相比其他蛋白具有更深的進化水平,從而保證了其攜帶多種效應子以及靶向多種細胞的毒性能力。此外,部分細菌中不含特定蛋白,如P.syringae、R.solanacearum不含TssL、TagH;A.tumefaciens不含TssJ、TagH、Tai4等(表1)。這種數量上的差異是否與細菌在營養獲取、種間競爭過程中的生長發育、毒性強弱有關,有待于進一步深入研究。
4.2不同植物病原細菌中T6SS蛋白種類之間的差異性
在功能近似的蛋白中,如TssM/J/L作為跨膜復合體結構,其中,TssM均來自于同一個進化分支C,而TssJ/L卻分別聚為A、B與A、C類,且3個TssL蛋白所包含的結構域不盡相同,推測是水平基因轉移所造成,然而各種T6SS相關基因如何進行高效的轉移還有待進一步深入研究。HCP與VgrG的數量、結構域以及遺傳分類均具有一定共性,其協同進化特性與毒性功能的發揮具有怎樣的聯系?有待于進一步探究。此外,獨特的T6SS相關分泌蛋白CagE_TrbE VirB、VasK分別聚類為A、B類群(圖3),推測其作用主要由系統分泌的效應子的功能驅動。
4.3不同植物病原細菌中T6SS蛋白功能研究方面的差異性
前人關于植物病原細菌T6SS的相關研究主要涉及效應子釋放對宿主植物的攻擊性以及自身在種間競爭過程中面對脅迫反應的防御性兩大方面,其功能具有保守性和獨特性,其中包括結構、分類、功能機制等的研究已經取得了較多成果。然而,當前在植物病原細菌的T6SS相關研究具有一定差異性,一方面,對于不同研究面其研究側重點不同,如在侵染宿主方面的T6SS研究主要涉及VgrG、HCP、TssM/J/L、TssB/C、TssA、TssH等眾多蛋白,而在種間競爭方面主要涉及VgrG、HCP、Tai、Tae等較少的蛋白;另一方面,研究所涉及的細菌種類較少,在十大植物病原細菌中,X.oryzae pv.oryzae、X.campestris等目前鮮有相關報道,未來還有很大的發展空間。在上述5種植物病原細菌的T6SS研究報道中,多次出現T6SS組件參與生物膜的形成。最近研究發現,外膜發生的必要基因bamA、tolB和lptD并不影響P.aeruginosa中T6SS的激活,其中bamA的缺失卻導致了T6SS的非靶向性攻擊,說明外膜的破壞導致T6SS上游激活信號更加敏感,然而外膜發生必要基因和參與生物膜形成的T6SS基因有何聯系?有待于進一步研究。此外,在植物病原細菌的T6SS中關于金屬離子的轉運機制也鮮有報道,前人已通過對泰國伯克霍爾德氏菌(Burkholderia thailandensis、)、假單胞菌(Pseudomonas)等細菌的T6SS研究明確了錳、鐵、鋅離子作為抗氧化酶的結構成分或輔因子的轉運機制。未來還需對植物病原細菌T6SS作出進一步深入研究,將有助于細菌多種分泌系統的完善。
5展望
植物病原細菌通過T6SS釋放效應蛋白進而對宿主或其它競爭菌種實現接觸性破壞,以達到營養攝取的目的。最新研究表明,T6SS也可以采用非接觸依賴性毒性策略。在細菌與宿主以及種間協同進化的過程中,為了克服侵染過程中的免疫障礙及競爭壓力,T6SS進化出復雜多樣的生存機制,如錳離子結合蛋白應對宿主免疫、特異性免疫蛋白Tai、相關基因的高效水平轉移機制等。前期,本實驗組基于生物信息學與比較基因組學方法分析黃單胞菌(Xanthomonas campestris pv.raphanin)Ⅵ型分泌蛋白的信號肽、跨膜結構、保守基序、遺傳關系等。隨著諸多植物病原菌全基因組序列的釋放,為植物病原細菌特別是林木病原細菌致病基因的進一步研究夯實了理論基礎,更多的植物病原細菌中T6SS相關蛋白被不斷發現,對于進一步對比分析不同植物病原細菌的毒性特點與進化差異,以及不同T6SS相關結構和功能之間的關系,發揮著重要的作用。未來學術界對于植物病原細菌中T6SS功能的進一步解析,將有助于找尋和識別植物病原細菌的作用新靶點,有助于推動預防和治療植物病害的新型農藥的開發和利用。

