一株產IAA芽孢桿菌ST37對油菜的耐鹽促生作用
韋廷舟, 文 怡, 王 超, 王 爽, 陳 云, 張澤穎, 范清鋒, 胡琬新, 龍治堅, 江世杰
(1.西南科技大學生命科學與工程學院,四川綿陽 621010; 2.四川衛生康復職業學院,四川自貢 643000;3.西南科技大學生物質材料教育部工程研究中心,四川綿陽 621010)
土壤鹽漬化是造成土地荒漠化的主要原因,嚴重影響土壤結構和功能,對農業的可持續發展產生不可估量的損失[1-2]。據統計,目前已有20%的耕地受到鹽分脅迫,而且鹽漬化土壤的面積仍呈現不斷增加趨勢,預計到2050年全球將有50%的耕地受土壤鹽堿化的影響[3]。鹽漬化土壤中含有過高的鹽分,高鹽環境使植物產生滲透脅迫、質膜損傷、離子不平衡等問題,從而阻礙植物的生長[4]。由于鹽脅迫對土地和作物的影響日益嚴重,亟待開發一種高效可行的應對策略解決全球糧食安全問題,傳統方法是培育耐鹽新品種[5]或是開發轉基因耐鹽植物[6],但因其效果不佳且在應用過程中存在一定的局限性,亟須尋找一種有效可行的替代策略,近年來通過植物根際促生菌PGPR(plant growth-promoting rhizobacteria)改良鹽堿地土壤和提高植物抗逆性已然成為一種有效手段[7]。
植物根際促生菌PGPR是指生存于植物根際土壤中,具有促進植物生長特性的有益微生物[8],也是目前用于鹽堿地微生物改良措施中應用最為廣泛的微生物,PGPR通過激素促進植物對營養的吸收和利用,從而促進植物的生長[9]。吲哚乙酸IAA(indole-3-acetic acid)是植物內源激素,作用于植物生長發育全過程,影響植物細胞分裂、伸長、分化以及種子萌發、根系發育等諸多過程。除此之外,IAA在植物對鹽脅迫等不良環境的響應中也具有重要意義。已有研究表明,從植物根際土壤中分離出產IAA的PGPR能夠顯著促進植物的生長和發育[10]。從鹽堿地、海水等高鹽環境分離出的耐鹽PGPR能夠促進植物在鹽脅迫環境中的生長;Li等從鹽堿地花生根際土壤中分離出1株能產IAA的陰溝腸桿菌HSNJ4,在模擬鹽脅迫條件下,接種HSNJ4菌能夠顯著增加油菜幼苗的根長、株高、側根數量以及提高脯氨酸含量、抗氧化酶活性等指標,降低丙二醛含量,從而促進油菜幼苗的生長[11]。此外,PGPR還通過解鉀、產鐵載體和產ACC脫氨酶等多種方式促進植物生長;解鉀菌、溶磷菌通過分解土壤中的難溶性鉀、磷、硅等元素,使其轉變為易被植物吸收的可溶態的鉀、磷、硅等元素[12];產ACC脫氨酶PGPR通過降解乙烯前體物ACC,抑制乙烯的合成,調節植物體乙烯的含量,從而對植物生長起促進作用[13]。周波等從檸條根際土壤中分離出一株具有產鐵載體功能的根際促生菌,接種菌株后能使檸條幼苗的株高、根長、鮮質量、干質量分別增長17.25%、6.68%、42.51%和20.67%,這說明具有產鐵載體功能的PGPR能夠顯著促進檸條的生長[14]。因此利用耐鹽PGPR來改良鹽堿地具有較好的應用前景。
四川省自貢市享有“鹽都”之稱,其特殊的地質構造孕育了地下豐富的鹽鹵資源,隨著鹽礦開采過程中鹵水滲漏、礦鹽堆積、意外冒鹵事件均會導致大面積土壤鹽堿化,微生物群落對環境變化極為敏感,隨著環境變遷,土壤微生物的適應性進化被驅動,其種類和結構均不同于非鹽漬化污染的土壤[14]。因此本研究前期從自貢市長山鎮鹽礦區周邊鹽漬化土壤中分離出1株耐鹽芽孢桿菌,通過測定其促生特性,在鹽脅迫下將其接種于甘藍型油菜種子,測定種子的發芽率、發芽勢及其幼苗的根長和株高,以期為耐鹽PGPR的開發和鹽堿地的改良提供重要菌種資源。
1 材料與方法
1.1 試驗菌株及種子
本研究前期從自貢市榮縣長山鎮鹽礦區污染的植物根際土壤中分離獲得一批具有耐鹽能力的細菌,經分離純化保存于筆者所在實驗室;大腸桿菌DH5α和枯草芽孢桿菌WB600作為對照菌株。試驗所用甘藍型油菜種子由四川大學生命科學學院提供。所有試驗于2021年11月至2022年3月在四川省綿陽市西南科技大學生物質材料教育部工程研究中心完成。
1.2 試驗方法
1.2.1 菌株ST37的鑒定 將菌株接種于LB固體培養基中過夜活化,參照《常見細菌系統鑒定手冊》觀察細菌基本特征(包括形態、顏色、邊緣、透明度等),并對菌株進行革蘭氏染色。提取過夜培養的ST37菌株純培養物基因組DNA,以此為模板,使用通用引物F27/R1492進行PCR擴增。擴增產物經瓊脂糖凝膠電泳檢測后送至華大基因測序。獲得的16S rDNA序列經NCBI數據庫比對分析初步確定物種的分類地位。
1.2.2 菌株ST37的耐鹽能力測定 對菌株的耐鹽性進行分析,分別以大腸桿菌DH5α和枯草芽孢桿菌WB600為對照菌株。試驗菌株經過夜活化轉接于新鮮液體LB培養基中,于30 ℃、200 r/min搖床培養至菌液D600 nm為0.5,分別取培養物1 mL進行梯度稀釋(10-1~10-5),每個稀釋度分別取10 μL至含有不同濃度NaCl(0、2%、4%、6%)的固體LB培養基表面,于30 ℃培養箱中倒置培養1 d,觀察菌株在不同鹽脅迫下的生長情況。
1.2.3 菌株ST37對油菜種子萌發的影響 用0.1% HgCl2對油菜種子進行消毒并清洗后,分別置于ST37菌懸液(D600 nm=0.5)和無菌水中浸種1 h,待風干后置于含無菌濾紙培養皿中,每個處理50粒油菜種子,分別加入等體積不同濃度的鹽溶液(0、50、100 mmol/L NaCl),以浸泡無菌水的種子為對照組,每個實驗組設置5次重復。置于組培室,溫度設置為(20±2)℃,光照/黑暗為16 h/8 h處理。保持濾紙濕度,每日統計其發芽數,10 d后統計發芽率,并測定其株高和根長。
發芽率=(發芽種子總數/供試種子總數)×100%;
發芽勢=(前3 d發芽種子總數/供試種子總數)×100%。
1.2.4 ST37菌株分泌IAA能力測定 將ST37菌株接種到含有100 mg/L色氨酸的King氏培養基中(以不含色氨酸的King氏培養液為對照),以加 100 μL 無菌水的培養液為空白對照,置于28 ℃、120 r/min的搖床中培養2 d。取培養物 10 000 r/min、4 ℃離心10 min的上清液4 mL,等體積加入比色液混勻,在黑暗中靜置0.5 h,立即測定D530 nm值,通過IAA標準曲線計算ST37菌株產IAA的量[15]。按照上述方法,通過在King培養基中添加不同濃度NaCl(0~4%)測定鹽脅迫對菌株產IAA能力的影響。
1.2.5 ST37菌株其他促生能力的檢測 利用CAS檢測液分析菌株產鐵載體能力[16];利用含鉀長石的解鉀培養基檢測菌株解鉀能力[15];在ADF培養基上連續劃線5次分析菌株產ACC脫氨酶能力[15]。
1.3 數據統計
采用MEGA11構建系統發育樹,SPSS 26.0對生理指標數據進行統計分析,采用Origin 2017制圖。
2 結果與分析
2.1 菌株ST37的鑒定
ST37細菌在固體LB培養基中培養24 h,菌落呈淺黃色、圓形、邊緣凸起、表面光滑;經革蘭氏染色鑒定ST37菌株為革蘭氏陽性菌。提取ST37菌株基因組DNA,以F27/R1492為引物擴增16S rDNA片段,測序獲得1 434 bp序列,經NCBI數據庫比對分析,鑒定該菌為運動芽孢桿菌(Bacillusmobilis),系統發育分析也顯示菌株ST37與運動芽孢桿菌(NR_157731.1)親緣關系最近(圖1)。

2.2 ST37菌株對油菜種子萌發和幼苗生長的影響
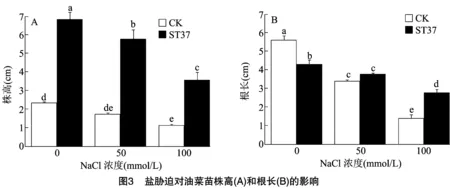
通過種子萌發試驗研究ST37菌株在不同NaCl脅迫下對油菜種子萌發的影響。結果顯示,隨著鹽脅迫水平的增加,種子發芽率與發芽勢隨之降低。與未接菌對照相比,接種ST37菌株能夠促進種子的萌發。在0、50、100 mmol/L 的鹽脅迫下,接種ST37菌株的發芽勢比未接菌的分別提高15.00%、6.67%、2.50%;接種ST37菌株的發芽率比未接菌的分別提高0.84%、6.67%、4.40%(圖2),表明ST37菌株的接種對油菜種子的萌發具有一定的促進作用。結果顯示,接種ST37菌株的油菜株高和根長均高于未接種的對照組的油菜苗株高和根長。

在50、100 mmol/L NaCl處理后,接種ST37菌株的油菜苗株高分別增加了235.40%、217.78%,接種ST37菌株的油菜苗根長分別增加了11.15%和100.00%。以上結果也說明ST37菌株能夠顯著提高鹽脅迫下油菜苗的生物量(圖3)。
2.3 ST37菌株的耐鹽能力測定
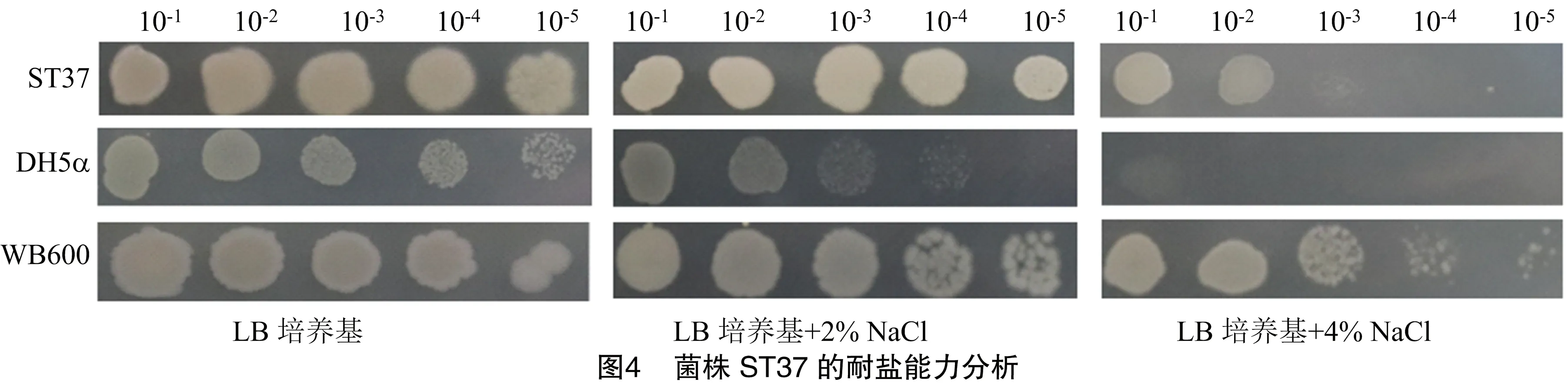
通過比較試驗菌株ST37和大腸桿菌DH5α、枯草芽孢桿菌WB600在不同NaCl脅迫下的生長狀況,進而評價其耐鹽能力(圖4)。結果顯示,與對照菌株相比,在2% NaCl處理下,菌株ST37和枯草芽孢桿菌WB600生長狀況一致,均優于大腸桿菌DH5α;在4%NaCl處理下,ST37菌株耐鹽能力強于DH5α而弱于WB600。總體而言,ST37菌株能夠耐受2%和4% NaCl 脅迫,具有一定的耐鹽能力。
2.4 鹽脅迫下菌株ST37產IAA能力
進一步分析ST37菌株在不同NaCl脅迫下產IAA能力,結果顯示,ST37菌株產IAA能力隨NaCl濃度的增加而顯著降低。不加NaCl的正常培養基培養2 d后,其分泌IAA的含量為6.82 mg/L;加入1% NaCl后,ST37菌株產IAA能力顯著降低,為不加NaCl對照組IAA含量的57.52%,加入3%~4%NaCl時,其產IAA含量差異不顯著,維持在2.15~2.88 mg/L之間,表明ST37菌株在中度鹽脅迫下仍具有產IAA的能力(圖5)。
2.5 菌株ST37的促生特性分析
微生物除通過分泌IAA之外,還可以通過解鉀、產鐵載體、產ACC脫氨酶等方式評價其潛在促生能力。由圖6結果顯示,ST37菌株在含有鉀長石的解鉀培養基上可產生明顯透明圈,說明其具有分解難溶性鉀鹽的能力;通過與對照相比,ST37菌株的接種導致培養液顏色變紅變深,說明該菌具有一定的產鐵載體能力;在ADF培養基上連續接種ST37菌株純培養物5次, 依然可以正常生長, 說明其具有產ACC脫氨酶的能力。基于上述試驗結果,表明ST37菌株可能通過產IAA、解鉀、產鐵載體、分泌ACC脫氨酶等方式使油菜幼苗表現出一定的耐鹽促生表型。


3 討論
本研究試驗菌株ST37分離自鹽礦區污染的土壤中,高鹽環境長期馴化使菌株產生一定的耐鹽能力,本研究通過試驗驗證ST37菌株能夠耐受4%的NaCl,經過16S rRNA基因測序初步鑒定ST37菌株是Bacillusmobilis,屬于芽孢桿菌屬(Bacillus)。目前,關于B.mobilis的研究較少;Korobov等從含有大量除草劑土壤中分離的B.mobilis能夠降解2,4,5-三氯苯氧基乙酸,接種該菌9 d后能夠降解培養基中62% 的2,4,5-三氯苯氧基乙酸,20 d后能夠有效降解土壤中的2,4,5-三氯苯氧基乙酸,去污程度達到58%,說明該菌株能夠作為改善土壤農藥的去污微生物菌劑[17]。杜慧慧等為尋找高效微生物肥料潛在菌株,從云南多葉樹根際土壤中篩選出41株解磷細菌,經過研究發現,B.mobilis是41株解磷細菌中溶磷能力最強的菌株,說明B.mobilis在去污、促生等方面具有一定的潛力[18]。
種子萌發是植物生長周期中最基本和最重要的階段,也是對鹽脅迫最為敏感的時期[8]。土壤中鹽分積累導致滲透勢增加,不利于種子吸收水分,阻礙種子內部核酸和蛋白質代謝[19],影響內源激素合成,從而抑制種子萌發[20-21]。大量研究表明,在鹽脅迫下,接種耐鹽PGPR可以促進種子萌發。本研究通過接種ST37菌株能夠有效緩解低鹽濃度(50 mmol/L NaCl)對油菜種子萌發的毒害作用,對種子的發芽率、發芽勢以及株高、根長等均有顯著的增益和改善作用。然而在高鹽脅迫下,ST37菌株緩解鹽脅迫的作用下降或不明顯,這與前人的研究結果[22]基本一致。有研究表明,接種耐鹽PGPR可以有效促進植物根系對土壤礦質營養物質的吸收和利用,增強植物體內的離子平衡,增加植物種子對水分的吸收和利用能力,從而促進植物種子的萌發;但是過高的鹽脅迫會導致種子胚細胞破裂,植物體內代謝失調,造成核酸蛋白合成受阻及毒素積累等,從而導致耐鹽PGPR緩解鹽脅迫能力下降[23]。
耐鹽PGPR通過自身代謝產生植物激素(如IAA等)、分泌ACC脫氨酶、產鐵載體等多種促生活性物質,或者具有將難溶性鉀、磷轉變為植物易吸收的可溶性鉀和磷的能力,從而促進植物生長。IAA能促進植物細胞生長,使細胞的體積和質量增加,也是調節植物生長發育全過程的信號物質[24]。研究表明,在處于高鹽等逆境條件下,植物自身合成IAA的能力受到抑制,外源IAA的介入能促進植物種子萌發和幼苗生長,從而增強植物對逆境的適應能力[25];Li等從鹽堿地獲得1株分泌IAA的陰溝腸桿菌能夠顯著促進油菜幼苗的生長,也證明了PGPR分泌的IAA能顯著促進植物的生長[11]。本研究中ST37菌株不僅是中度耐鹽菌,而且在不同鹽濃度下能分泌IAA,從而在不同鹽脅迫下促進植物種子萌發和幼苗的生長,這與前人研究結果基本一致。研究發現,利用可合成ACC脫氨酶的細菌可以增強水稻在鹽脅迫下的生長[26];陳小娟等從濱海鹽堿地根際土壤樣品中分離出2株芽孢桿菌,均具有分泌IAA、產鐵載體等促生能力,與施用普通有機肥相比,施用這2株菌的微生物肥料均能顯著增加玉米產量[27]。綜上,本研究中ST37菌株具有解鉀、分泌IAA、產鐵載體、產ACC脫氨酶等促生特性,且能在4% NaCl的鹽環境中生存,說明該菌株在鹽脅迫中具有促進植物生長的潛力,其可能通過以上一種或多種方式促進油菜種子萌發和幼苗生長,然而,對于該菌詳細的促生機制有待于進一步探究。
4 結論
本研究菌株ST37經初步鑒定為Bacillusmobilis,具有耐受4% NaCl、產IAA、解鉀、產鐵載體、產ACC脫氨酶等能力。在鹽脅迫下,ST37菌株能夠促進油菜種子萌發和油菜幼苗的生長,說明該菌株具有一定的耐鹽促生特性。本研究ST37菌株可作為植物促生菌的理想候選菌株,在改善和修復鹽堿地方面具有一定的應用潛力。

